慢性粒细胞白血病(chronic myeloid leukemia, CML)是一类发生在造血干细胞、以髓系细胞慢性增殖为主要特征的恶性克隆性疾病,占白血病新诊断病例15%~20%,年发病率为1~1.5/10万。CML随着年龄增大,发病率增加,儿童CML不足CML病例总数5%。90%以上CML患者有费城染色体(Ph),(t 9;22)(q34; q11)染色体易位并形成BCR-ABL融合基因[1]。现有文献报道CML与Wnt/β-catenin、JAK/STAT、PI3K/AKT/ mTOR、Hedgehog(Hh)等信号通路的异常激活密切相关[2]。
β-Arrestin1为Arrestin蛋白家族的一员,广泛存在于机体各组织与器官中。β-Arrestin1具有多重功能的信号蛋白[3],其经典功能是介导七次跨膜偶联受体(GPCRs)脱敏和内吞[4],近年来国内外研究均发现它在肿瘤的增殖、侵袭、转移等过程中也发挥重要作用[5]。此外,Arrestin-受体复合物能以衔接蛋白的形式作用于丝裂原激活蛋白激酶(MAPK)级联反应,导致JNK3[6]、ERK1/2 [7]和p38 [8]等信号激活。
我们课题组前期的研究发现,在CML中β-arrestin1表达增高[9],且影响其标志融合基因Bcr/Abl的H4组蛋白乙酰化,从而促进K562细胞增殖[10],但其影响的CML相关信号通路尚未见报道。本研究以干预β-arrestin1的CML K562稳定细胞为研究对象,探讨β-arrestin1促进K562增殖的相关信号通路。
1 材料与方法 1.1 主要试剂及药物1640培养基和胎牛血清(Gibco);CCK-8试剂(凯基公司);anti-β-arrestin1抗体和anti-Src抗体(Abcam);β-actin抗体(北京中衫金桥);JNK抗体和JNK磷酸化抗体(Cell Signaling);JNK抑制剂SP600125和MEK抑制剂PD98059(Sigma);Src抑制剂Saracatinib(Cayman Chemical)。
1.2 细胞培养人慢性髓细胞白血病细胞株K562由重庆医科大学附属儿童医院分子中心实验室保存。前期构建特异性敲减和过表达β-arrestin1及非特异性siRNA的慢病毒颗粒后感染K562细胞,经有限稀释法挑取单克隆细胞建立K562-Ctrl,K562-siβ1和K562-β1稳定细胞。细胞培养于含10%胎牛血清及1%青链霉素1640培养基中,置于37 ℃含5% CO2孵箱,当细胞密度长至80%左右时传代。
1.3 细胞增殖检测 1.3.1 CCK-8检测细胞数取对数期细胞96孔板铺板,3000/200 μl 1640全培养基每孔,铺5板,每24 h加入10 μl CCK-8试剂混匀37 ℃ 5% CO2孵育3 h后,检测450 nm光密度(D450 nm),连续监测5 d。每种细胞每次设两复孔。
1.3.2 细胞计数及细胞存活率检测每日于上述实验加入CCK-8试剂前取10 μl混匀细胞悬液与0.4%台盼蓝溶液以9:1混合混匀。取1滴混合液滴入改良牛鲍氏计数板,3 min内分别计数四个大方格内的活细胞及死细胞数,按照公式计算:细胞数/ml=4个大方格活细胞总数/ 4×104×稀释倍数;细胞存活率(%)=活细胞总数(/活细胞+死细胞总数)×100%。
1.4 Western blot检测β-arrestin1、JNK蛋白及磷酸化离心收集3×106细胞,PBS洗涤1次,加入200 μl RIPA裂解液,冰上裂解30 min,每间隔5 min震荡混匀1次。4 ℃,12 000 r/min离心20 min,保留上清。用BCA法检测蛋白浓度,随后按照4:1比例在蛋白液中加入5×上样缓冲液后煮沸5 min,取20 μg蛋白电泳,转膜,5%脱脂奶粉室温封闭1 h,加入一抗(β-arrestin1,总JNK,p-JNK,β-actin),4 ℃孵育过夜,次日加入二抗室温孵育l h,TBST充分洗涤后,用增强化学发光系统(ECL)检测膜上信号。
1.5 免疫共沉淀实验检测β-arrestin1与Src结合提取细胞蛋白方法同前。每500 μl总蛋白中加入2 μg anti-β-arr1或anti-Src抗体,4 ℃缓慢摇动,抗原抗体混合过夜,准备蛋白A/G琼脂糖珠,用PBS洗涤珠子3次,3000 r/min 2 min/次,每500 μl蛋白中加入30 μl珠子,4 ℃缓慢摇动抗原抗体混合物4 h。将抗原抗体复合物3000 r/min离心3 min,收集琼脂糖珠-抗原抗体复合物,弃上清,用预冷PBS洗3次,吸尽上清,加入50 μl 1×上样缓冲液将琼脂糖-抗原抗体复合物重悬与混匀。将样本煮5 min后离心,上清PAGE电泳与Western Blot。以IgG作为两蛋白分子结合的阴性对照。
将细胞分为两组,其中一组加入Saracatinib 5 μmol/L,另外一组为空白对照对照加入等体积DMSO,培养24 h后收集细胞提取蛋白做Co-IP。
1.6 JNK抑制剂SP600125、MEK抑制剂PD98059及Src抑制剂Saracatinib分别对p-JNK的影响将K562-Ctrl细胞10%完全培养基替换为0.5%培养基,37 ℃含5% CO2培养箱中静置培养24 h。将细胞分为3组,参考文献使用浓度[11-12]两组中分别加入SP600125 10 μmol/L及PD98059 50 μmol/L,另外一组为空白对照加入等体积DMSO,培养24 h后收集细胞提取蛋白质做Western blot。
1.7 JNK抑制剂SP600125对K562细胞增殖的影响取对数期K562-Ctrl细胞96孔板铺板,同上设3组铺5板,检测细胞增殖情况,方法同1.3。
1.8 统计学处理实验结果采用SPSS17.0统计软件进行分析,组间两两比较,方差齐性采用单因素方差分析,方差不齐时采用秩和分析,P < 0.05时认为有统计学差异。
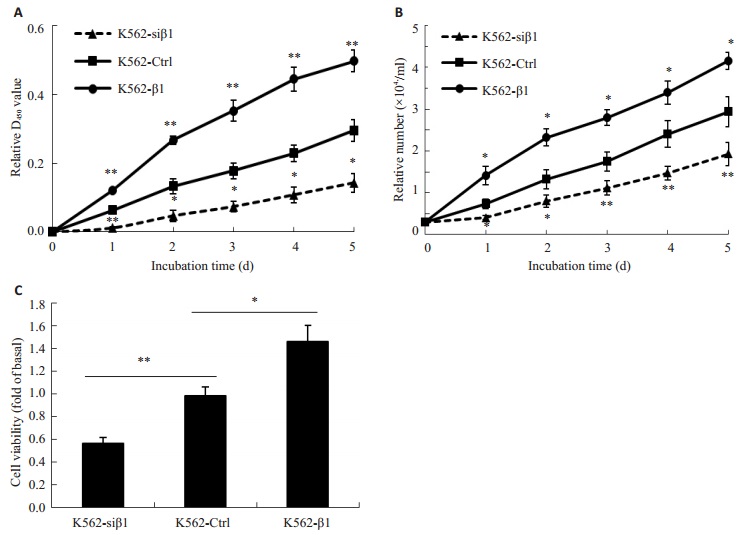
2 结果 2.1 β-Arrestin1促进CML K562细胞增殖用CCK-8实验连续监测5 d K562-Ctrl,K562-siβ1和K562-β1的D450值,结果显示K562-siβ1细胞中D450值从第1天到第5天显著低于K562-Ctrl细胞,而K562-β1从第1天到第5天D450值显著高于K562-Ctrl细胞。细胞计数显示K562-siβ1细胞较K562-Ctrl细胞存活率增加,而K562-Ctrl细胞又较K562-β1细胞存活率高(P < 0.05,图 1)。
|
图 1 β-arrestin1促进CML K562细胞增殖 Figure 1 β-arrestin1 promotes the cell proliferation of K562 cells. A: Proliferation of different K562 cell lines assessed with CCK8 assay; B: Viable cell number of different K562 cell lines; C: Viability of different K562 cells at 48 h. *P < 0.05, **P < 0.01. K562-siβ1 vs K562-Ctrl, *P < 0.05; K562-β1 vs K562-Ctrl, **P < 0.05. |
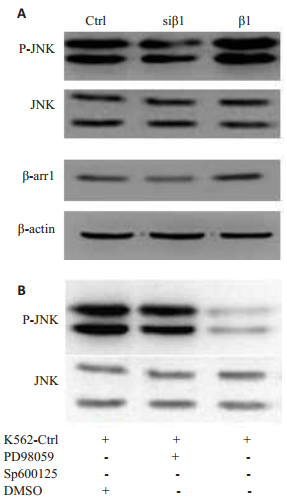
Western Blot结果显示,在β-Arrestin1干预K562细胞中总JNK表达不受影响,但磷酸化JNK(p-JNK)表达却与β-Arrestin1表达成正相关(图 2A)。为进一步探寻K562细胞增殖与JNK通路的关系,选用了JNK选择性抑制剂SP600125及MEK抑制剂PD98059,Western Blot显示SP600125能够特异地抑制JNK磷酸化,PD98059可作为阴性对照(图 2B)。
|
图 2 β-arrestin1促进JNK磷酸化 Figure 2 β-arrestin1 promotes JNK activation. A: We stern blot results for β-arrestin1, JNK and p-JNK in different K562 cells. B: Western blot results for JNK and p-JNK after treatment with PD98059 and SP600125. |
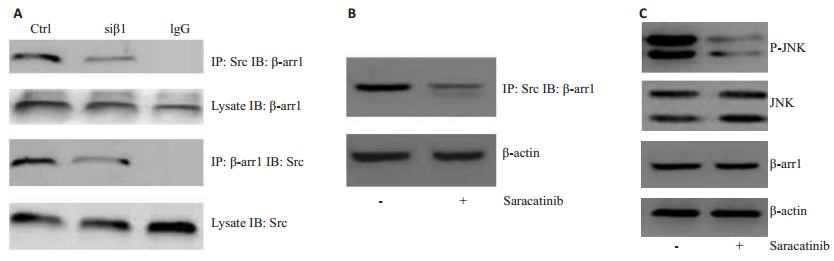
Co-IP实验结果显示在K562细胞中,β-Arrestin1能够与Src结合(图 3A)。加入Src抑制剂Saracatinib,结果显示β-Arrestin1与Src结合减少(图 3B)。Western Blot结果显示,加入Src抑制剂后,p-JNK表达减少,β-Arrestin1无明显变化(图 3C)。
|
图 3 Src参与β-arrestin1诱导的JNK磷酸化 Figure 3 Src is involved in β-arrestin1-induced JNK phosphorylation. A: Co-IP results for β-arrestin1 and Src in K562 cells; B: Co-IP results for β-arrestin1 and Src after treatment with Src inhibitor Saracatinib; C: Western blot results for β-arrestin1, JNK and p-JNK after treatment with inhibitor Saracatinib. |
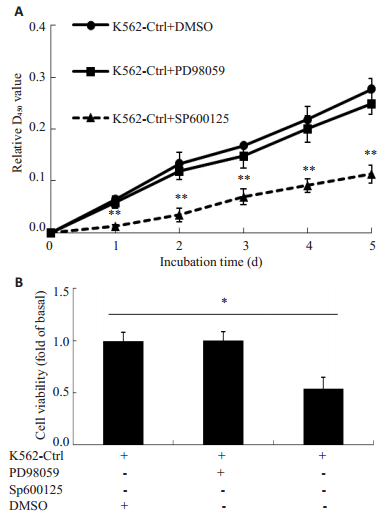
通过检测SP600125与PD98059处理后的K562细胞增殖情况,发现PD98059处理后的细胞增殖能力与生存率没有明显的改变,而SP600125处理后的细胞增殖能力与生存率明显下降(图 4,P < 0.05)。
|
图 4 JNK抑制剂SP600125特异下调K562细胞增殖 Figure 4 SP600125 specifically suppresses proliferation in K562 cells. A: CCK8 assay of K562 cells treated with PD98059, SP600125, and DMSO; B: Viability of K562 cells treated with PD98059 and SP600125 for 24 h. *P < 0.05, **P < 0.01. |
β-arrestins是一类在β肾上腺素受体激酶(βARK)提纯过程中发现[13]的重要支架蛋白[14]和信号调控因子[15]。Arrestins蛋白广泛存在于细胞内,且对绝大多数受G蛋白偶联受体(GPCR)调控的细胞信号通路起重要作用[16-17]。本研究利用β-arrestin1慢病毒载体构建的CML稳定K562细胞为研究对象,细胞增殖实验结果提示β-arrestin1能明显促进K562细胞增殖,与前期研究发现结果一致。
肿瘤的发生是多因素、多机制参与的结果, 其过程涉及到一系列信号传导分子的改变。随着各信号通路的作用被深入地研究,人们对肿瘤的认知愈加深入进而发现新的药物治疗靶点。细胞增殖是肿瘤形成的重要过程之一,可受多种信号通路调节。我们在检测β-arrstin1对细胞增殖相关通路激活的影响时发现,β-arrstin1特异促进JNK信号通路激活,在应用JNK选择性抑制剂SP600125后发现,JNK信号通路的激活参与K562细胞增殖。
c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK),是哺乳类细胞中MAPK的一亚类,在细胞发育、凋亡、生长及免疫应答等多细胞生物过程中发挥重要作用[18]。JNK/SAPK信号通路可被应激刺激、细胞因子、表皮生长因子及G蛋白偶联受体激活[19]。Src蛋白是Src家族激酶的成员之一,研究表明,在氧化应激,尤其在有ROS参与的应激过程中,Src可能是JNK信号通路途径的重要因子[20-21]。同时在功能结构域上,β-arrestin的N-端包含Src-SH3结合位点[22],C-端包含JNK3结合位点,调控GPCR信号通路和MAPK信号通路。其中部分MAPK信号通路中信号的传递涉及β-arrestin依赖型Src募集[23-24],Co-IP实验证明在K562细胞中β-arrstin1可与Src结合。以上结果提示,β-arrestin1可能通过招募Src进而促进JNK信号通路的激活。在应用Src抑制剂Saracatinib后我们发现β-arrstin1与Src结合以及p-JNK表达减少,而β-arrstin1表达无明显变化。实验结果表明Src确实参与了β-arrstin1诱导的JNK磷酸化。
综上所述,本文发现在CML细胞中β-arrestin1通过结合Src促进JNK信号通路的激活,进而促进CML K562细胞增殖,但其确切的机制有待进一步研究。本文中β-arrestin1对JNK信号通路的作用,为发现CML新的药物治疗靶点奠定了理论基础。
| [1] | Rowley JD. Letter: a new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining[J]. Nature,1973, 243 : 290-3. DOI: 10.1038/243290a0. |
| [2] | Sinclair A, Latif AL, Holyoake TL. Targeting survival pathways in chronic myeloid leukaemia stem cells[J]. Br J Pharmacol,2013, 169 (8) : 1693-707. DOI: 10.1111/bph.12183. |
| [3] | Lefkowitz RJ, Whalen EJ. Beta-arrestins: traffic cops of cell signaling[J]. Curr Opin Cell Biol,2004, 16 (2) : 162-8. DOI: 10.1016/j.ceb.2004.01.001. |
| [4] | Goldberg AD, Allis CD, Bernstein E. Epigenetics: a landscape takes shape[J]. Cell,2007, 128 (4) : 635-8. DOI: 10.1016/j.cell.2007.02.006. |
| [5] | Di W, Wu J. Involvement of b-arrestins in cancer progression[J]. Mol Biol Rep,2013, 40 (2) : 1065-71. DOI: 10.1007/s11033-012-2148-0. |
| [6] | Mcdonald PH, Chow CW, Miller WE, et al. beta-Arrestin 2: A receptor-regulated MAPK scaffold for the activation of JNK3[J]. Science,2000, 290 (5496) : 1574-7. DOI: 10.1126/science.290.5496.1574. |
| [7] | Luttrell LM, Roudabush FL, Choy EW, et al. Activation and targeting of extracellular signal-regulated kinases by beta-arrestin scaffolds[J]. Proc Natl Acad Sci USA,2001, 98 (5) : 2449-54. DOI: 10.1073/pnas.041604898. |
| [8] | Bruchas MR, Macey TA, Lowe JD, et al. Kappa opioid receptor activation of p38 MAPK is GRK3-and arrestin-dependent in neurons and astrocytes[J]. J Biol Chem,2006, 281 (26) : 18081-9. DOI: 10.1074/jbc.M513640200. |
| [9] | 刘慧, 龙娟, 谭俊杰, 等. β-arrestin1和β-arrestin2在白血病中的表达及意义[J]. 解放军医学杂志,2010, 35 (2) : 177-81. |
| [10] | Li K, Qi X. b-Arrestin1 promotes the progression ofchronic myeloid leukaemia by regulatingBCR/ABL H4 acetylation[J]. Br J Cancer,2014, 111 (3) : 568-76. DOI: 10.1038/bjc.2014.335. |
| [11] | Sasaki DT, Murray BW. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal kinase[J]. Proc Natl Acad Sci USA,2001, 98 (24) : 13681-6. DOI: 10.1073/pnas.251194298. |
| [12] | Cuenda A, Cohen P. PD 098059 is a specific inhibitor of the activation of mitogen-activated protein kinase kinase in vitro and in vivo[J]. J Biol Chem,1995, 270 (46) : 27489-94. DOI: 10.1074/jbc.270.46.27489. |
| [13] | Benovic JL, Kühn H, Weyand I, et al. Functional desensitization of the isolated beta-adrenergic receptor by the beta-adrenergic receptor kinase: potential role of an analog of the retinal protein arrestin (48-kDa protein)[J]. Proc Natl Acad Sci USA,1987, 84 (24) : 8879-82. DOI: 10.1073/pnas.84.24.8879. |
| [14] | Morrison DK, Davis RJ. Regulation of map kinase signaling modules by scaffold proteins in mammals[J]. Annu Rev Cell Dev Biol,2003, 19 (3) : 91-118. |
| [15] | Downward J. The ins and outs of signaling[J]. Nature,2001, 411 (6839) : 759-62. DOI: 10.1038/35081138. |
| [16] | Shenoy SK. Transduction of receptor signals by beta-arrestins[J]. Science,2005, 308 (3) : 512-7. |
| [17] | Lefkowitz RJ. GRKs and beta-arrestins:roles in receptor silencing, trafficking and signaling[J]. Trends Endocrinol Metab,2006, 17 (2) : 159-65. |
| [18] | davis RJ. Signal transduction by the JNK group of MAP kinases[J]. Cell,2000, 103 (1) : 239-52. |
| [19] | Karin M, Gallagher E. From JNK to pay dirt: jun kinases, their biochemistry, physiology and clinical importance[J]. IUBMB Life,2005, 57 (4/5) : 283-95. |
| [20] | Abe J, Haendeler J. Src and Cas mediate JNK activation but not ERK1/2 and p38 kinases by reactive Oxygen species[J]. J Biol Chem,2000, 275 (16) : 11706-12. DOI: 10.1074/jbc.275.16.11706. |
| [21] | Vita JA, Berk BC. c-Jun n-terminal kinase activation by Hydrogen peroxide in endothelial cells involves SRC-dependent epidermal growth factor receptor transactivation[J]. J Biol Chem,2001, 276 (19) : 16045-50. DOI: 10.1074/jbc.M011766200. |
| [22] | Luttrell LM, Ferguson SS, Daaka Y, et al. Beta-arrestin-dependent formation of beta (2) adrenergic receptor Src protein kinase complexes[J]. Science,1999, 283 (542) : 655-61. |
| [23] | Zalevsky J, Thoma MS. β-arrestin-dependent endocytosis of proteinase-activated receptor 2 is required for intracellular targeting of activated ERK1/2[J]. Cell Biol.,2000b, 14 (6) : 1267-81. |
| [24] | Andrews JD, Kelvin AA. Regulation of tyrosine kinase activation and granule release through β-arrestin by CXCRI[J]. Nat Immunol,2000, 1 (3) : 227-33. DOI: 10.1038/79767. |
 2015, Vol. 35
2015, Vol. 35
