2. 南方医科大学南京临床学院南京军区南京总医院内分泌科,江苏 南京 210002
2. Department of Endocrinology, Nanjing Clinical Institute of Southern Medical University, Nanjing 210002, China
T2DM患者在疾病早期就已存在胰岛β细胞功能受损,第一相胰岛素分泌障碍是其最早表现。改善胰岛素第一时相分泌可更好控制餐后血糖,减轻血糖波动,保护胰岛β细胞功能,减少糖尿病并发症的发生[1-2]。近年研究证实长期AT1R阻滞剂在体干预能减轻胰岛内氧化应激水平,增加胰岛内微血管数量和局部血流量,升高氧分压,从而改善第一相胰岛素分泌[3-4]。我们前期研究发现坎地沙坦治疗减轻了胰岛β细胞含量的丢失,较大程度地改善了db/db糖尿病小鼠的葡萄糖耐量和胰岛素分泌,但无法确定这些保护作用是源于胰岛局部RAS阻断还是全身RAS阻断[5]。本研究采用RNA干扰(RNA interference, RNAi)技术抑制胰岛局部AT1R表达,观察其对第一相胰岛素分泌的影响,并探讨可能的潜在机制。
1 材料与方法 1.1 实验动物及主要材料10只8周龄清洁级雌性C57BL/KsJ-db/db糖尿病小鼠及5只同周龄同窝出生的C57BL/KsJ-db/m非糖尿病小鼠(合格证号SCXX(苏)2007-0012)。总RNA抽提试剂盒、逆转录试剂盒、PCR引物合成(美国Invitrogen公司)。pSilencer 2.0载体购于美国Ambion公司。重组缺陷型腺病毒质粒pAdEasy-1系统、穿梭载体pAdTrack、BJ5183-AD-1感受态细菌、大肠杆菌Ecoli DH5a、空载腺病毒(Ad-siControl)以及包装细胞购于中科院上海细胞研究所。真核表达质粒pGCsi-U6-shRNA-ATIR由上海吉凯生物公司定制合成。小鼠抗AT1R抗体、GLUT-2抗体、GCK抗体、小鼠抗β-actin抗体、辣根过氧化物酶耦联山羊抗小鼠IgG抗体(美国Santa Cruz公司)。小鼠胰岛素ELISA试剂盒(Morinaga, Yokohama, 日本)。
1.2 实验方法 1.2.1 胰岛细胞的分离培养将db/db和db/m小鼠依次苯巴比妥麻醉后夹闭胆总管十二指肠乳头开口,体视显微镜下行胆总管穿刺后注射1 mg/ml浓度的Ⅳ型胶原酶2 ml,逆行进入胰管使胰腺膨大后迅速分离胰腺,将胰腺置于含Ⅳ型胶原酶1 mg/ml的Hank's平衡液中消化40 min,去除胶原成份后多次振荡洗涤,显微镜下成功分离胰岛,镜下手检胰岛,每孔50个胰岛,每组所获得胰岛至少5孔,置于装有Hank's平衡液24孔板中于37 ℃、5% CO2恒温箱孵育备用。
1.2.2 RT-PCR检测AT1R mRNA表达用TRIzol试剂抽提两组胰岛细胞总RNA,参照逆转录试剂盒说明书逆转录为cDNA。AT1R上游引物5'-AGCTACAACA AGGCAAGG-3',下游引物3'-TAGAAGGCACAGTC GAGG-5';内参基因β-actin上游引物5'-TGTTGTCCC TGTATGCCTCTG行GTC-3',下游引物3'-ATGTCAC GCACGATTTCCCTCTCA-5'。扩增条件:94°C预变性10 min,94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,共40个循环,72 ℃ 7 min。取PCR产物于2%琼脂糖行凝胶电泳,用BIORAD Flour-S MuiltiImager凝胶成像仪扫描并保存,并用凝胶成像分析系统测定灰度值,结果以AT1R条带密度占β-actin条带密度的百分率表示。
1.2.3 INS-1细胞培养INS-1细胞培养于RPMI 1640培养基中,加入10%(w/v)胎牛血清(GIBCO, Grand Island, NY)、11.1mmol/L葡萄糖、10 mmol/L HEPES、2 mmol/L L-谷氨酰胺、1 mmol/L丙酮酸钠以及50 μmmol/L β-巯基乙醇,5% CO2/95%空气的37 ℃孵箱中培养,并每隔1~2 d换1次培养液,每周按1:3传代。在转染前两天将细胞接种入75 cm2无菌细胞培养瓶中,细胞浓度为每瓶4×106个,当培养瓶中的细胞60%~70%汇合时进行转染。
1.2.4 shRNA的设计与筛选根据GenBank中小鼠AT1R基因(基因序列号:NM-030985)的核苷酸序列,按照美国Ambion公司的网上设计软件设计产生3对shRNA序列,同时设计一对不针对靶基因对照序列siControl。从5'-3'末端,整个shRNA序列为BamHⅠ酶切位点、19 nt正义序列、9 nt loop接头序列、19 nt反义序列、RNA聚合酶Ⅲ终止子(TTT TTT)和HindⅢ酶切位点。分别合成并纯化每对编码shRNA及siControl的DNA模板单链,退火形成双链DNA,用T4 DNA连接酶分别连接至pSilencer 2.0载体,利用阳离子脂质体转染至INS-1细胞,每5 μg DNA转染6× 106个细胞。转染3 d后,检测INS-1细胞RNA和蛋白表达。最后选定的siAT1R针对的靶基因序列的5'末端相对于起始密码子对应于小鼠AT1R核苷酸540(GCGTCTTTCTTCTCAATCT)。
1.2.5 重组腺病毒的构建由生物公司合成针对小鼠AT1R mRNA的特异性siRNA真核表达质粒psiRNAAT1R;双酶切得到siRNA-AT1R表达片段;插入穿梭载体pAdTrack上,获得转移质粒pAdTrack-siRNAAT1R;后者经线性化后,转化含有腺病毒骨架质粒pAdEasy-1的大肠杆菌BJ5183进行同源重组;PacⅠ酶切鉴定,筛选出正确重组腺病毒质粒pAdEasysiRNA-AT1R;酶切线性化后转染293细胞包装成重组病毒Ad-siAT1R,荧光显微镜观察绿色荧光表达,行PCR鉴定。通过反复感染扩增病毒,采用氯化铯密度梯度离心法纯化重组腺病毒。以同样方法扩增空载病毒Ad-siControl至相当量,并纯化。获得约3.6×109 pfu/ml滴度的重组腺病毒Ad-siAT1R和2.9×109 pfu/ml滴度的空载病毒Ad-siControl。
1.2.6 腺病毒感染胰岛细胞db/db小鼠胰岛过夜培养24 h后分为3组处理:(1)Ad-siAT1R感染组:按MOI为100(每个胰岛按含2000个细胞计算),将Ad-siAT1R病毒液加入胰岛细胞,隔30 min轻轻晃动,共计20 h;(2)Ad-siControl感染组:按照前述方法,用Ad-siControl病毒液感染胰岛细胞;(3)空白对照组:同等条件下培养未行任何干预处理的胰岛细胞。将病毒液从胰岛细胞移除后,继续培养72 h,每24 h换1次培养液。检测各组葡萄糖刺激的胰岛素分泌(Glucose-stimulated insulin secretion, GSIS)水平,随后收集各组胰岛,检测各组AT1R,GLUT-2,以及GCK的表达。
1.2.7 胰岛灌流将离体胰岛灌流系统置于37 ℃水浴,并将微量泵输注系统与其连接。将预先配置好的含2.8 mmoL/L葡萄糖的KRB溶液(129 mmol/L NaCl,5 mmol/L NaHCO3,4.8 mmol/L KCl,1.2 mmol/L KH2PO4,1.2 mmol/L MgSO4,0.2% BSA,10 mmol/L Hepes,2.5 mmoL/L CaCl2,2.8 mmol/L葡萄糖,pH 7.4)充填至整个管道系统,在层析柱中加入100 μl预先配置好的葡聚糖凝胶,静置5 min,然后将每组50个胰岛转移至层析柱,静置5 min,再加入100 μl葡聚糖凝胶,盖紧硅胶塞密闭胰岛舱,然后将胰岛舱包括整个管道系统全部浸入37 ℃水浴。连接微量泵,开始2.8 mmol/L KRB 0.5 ml/h速度灌流l h,后换为16.7 mmol/L KRB l ml/h。以开始16.7 mmol/L KRB灌流为0时间点,在灌流前30、20、10 min和灌流后0、20、40、60、80、100 s以及2、3、4、5、6、7、8、9、10、15、20、30 min时收集灌流出的液体,-80 ℃保存,胰岛素测定使用小鼠胰岛素ELISA试剂盒,胰高血糖素测定使用小鼠胰高血糖素ELISA试剂盒,根据测得的浓度绘制其动态分泌曲线。
1.2.8 Western blot检测各组胰岛AT1R,GLUT-2,以及GCK的表达按公司说明操作步骤抽提各组细胞蛋白,采用BCA蛋白定量试剂盒检测总蛋白浓度。取50 μg蛋白用于SDS-聚丙烯酰胺凝胶电泳,转移至NC膜,BSA室温封闭1 h,TBST溶液洗膜3次,每次5 min,用到的抗体主要有小鼠抗AT1R抗体、抗GCK抗体及抗GLUT-2抗体,4℃抗孵育过夜,同前法洗膜3次,室温下相应加入辣根过氧化物酶耦联山羊抗小鼠IgG抗体(1:2000)孵育2 h。用增强化学发光法显色,X片曝光显影,同时用同样方法对上述样品用抗鼠的β-actin单克隆抗体免疫杂交与显色作为内参对照,凝胶成像分析系统摄像分析。
1.3 统计学分析所有数值均表示为均数±标准差。所有统计分析均使SPSS 11.0软件。组间比较采用独立t检验或单因素方差分析。以P < 0.05为差异有统计学意义。
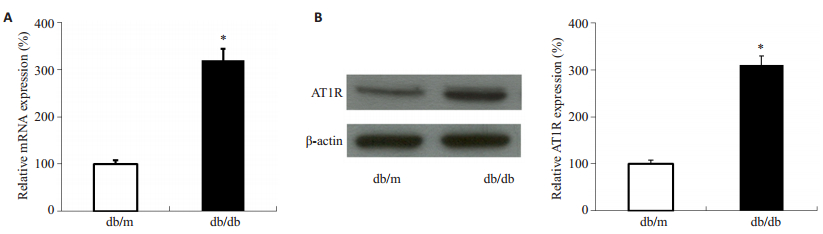
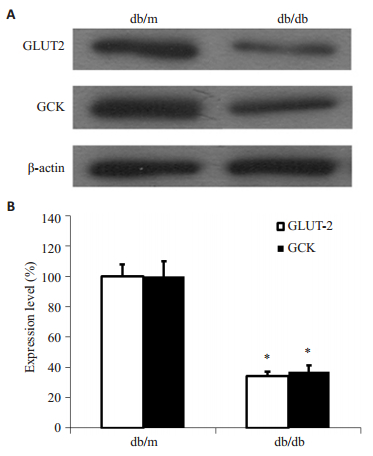
2 结果 2.1 db/db和db/m小鼠胰岛AT1R、GLUT-2,以及GCK的表达与db/m小鼠相比,db/db小鼠胰岛AT1R mRNA及蛋白的表达水平升高2倍左右,差异有统计学意义(P < 0.05,图 1);而GLUT-2和GCK表达水平分别下降65.8%和62.7%(图 2),差异均有统计学意义(P < 0.05),提示db/db小鼠AT1R存在过度表达,而GLUT-2和GCK表达明显受损。
|
图 1 db/m小鼠和db/db小鼠胰岛AT1R的表达 Figure 1 Expression levels of AT1R mRNA (A) and protein (B) in islets of db/m mice and db/db mice. *P < 0.05 vs db/m group. |
|
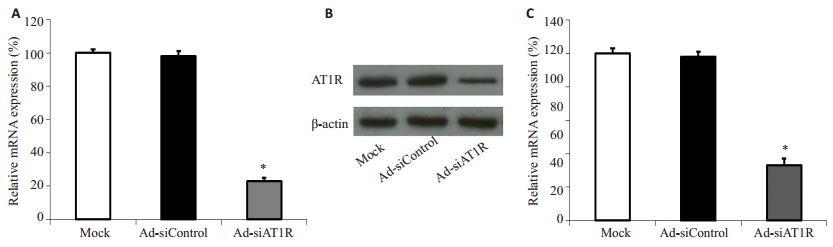
图 2 AT1R基因沉默对AT1R表达的影响 Figure 2 Effects of AT1R silencing on AT1R expression. A: AT1R mRNA expression in islets of db/db mice transfected with Ad-si AT1R, Ad-siControl, or Mock (*P < 0.05 vs Ad-siControl); B: Western blotting result of AT1R protein; C: AT1R protein expression in islets of db/db mice transfected with Ad-si AT1R, Ad-siControl, or Mock (*P < 0.05 vs Ad-siControl). |
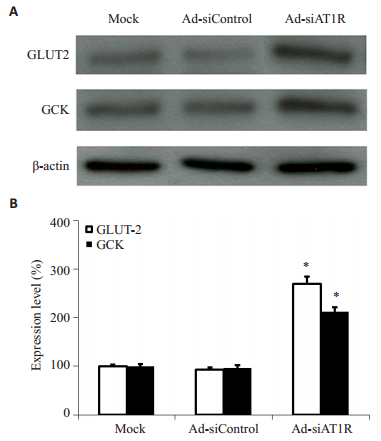
腺病毒感染后,Ad-siControl组和空白对照组之间AT1R的表达差异无统计学意义。Ad-siAT1R组AT1R mRNA表达水平较Ad-siControl组下降75%,蛋白表达水平下降65%,差异有统计学意义(P < 0.05),表明RNA特异性干扰成功抑制了胰岛局部AT1R表达(图 3)。与此同时,Ad-siAT1R组GLUT-2和GCK表达水平较Ad-siControl组分别升高190%和121%(均P < 0.05),提示db/db小鼠胰岛AT1R表达水平下调后,胰岛β细胞的GLUT-2和GCK表达明显升高(图 4)。
|
图 3 db/m小鼠和db/db小鼠离体胰岛GLUT-2和GCK的表达 Figure 3 Expression of GLUT-2 and GCK protein in islets of db/m mice and db/db mice. *P < 0.05 vs db/m group. A: Western blotting; B: GLUT-2 and GCK protein expression in islets of db/ db mice and db/db mice (*P < 0.05 vs db/m group). |
|
图 4 AT1R基因沉默对GLUT-2和GCK表达的影响 Figure 4 Effects of AT1R silencing on GLUT-2 and GCK expression. A: Western blotting; B: GLUT-2 and GCK protein expression in islets of db/db mice transfected with Ad-siAT1R, Ad-siControl, or Mock (*P < 0.05 vs Ad-siControl group). |
低糖灌流时,各组小鼠体外胰岛的胰岛素分泌水平无明显差异。高糖刺激后,空白对照组和Ad-siControl组的胰岛素分泌水平均出现一定程度升高,最高峰值90 mU/L左右,仅达到基础水平1.8倍。而Ad-siAT1R组的胰岛素分泌在给予16.7 mmol/L葡萄糖后1~2 min即达到最高峰值140 mU/L,为基础水平的2.8倍,与Ad-siControl组相比差异有统计学意义(均P < 0.05),表明RNA干扰特异性抑制胰岛局部AT1R表达后,db/db小鼠胰岛的第一相胰岛素分泌显著改善(图 5)。
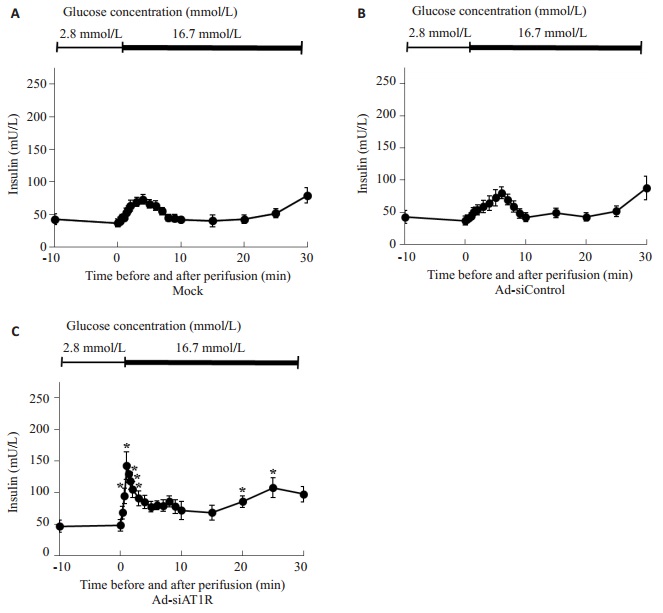
|
图 5 各组体外胰岛的胰岛素分泌曲线 Figure 5 Insulin secretion curve of the islets in different groups. *P < 0.05 vs Ad-siControl group. |
近年研究发现胰岛局部存在独立的RAS系统,血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)AT1和AT2受体、血管紧张素转化酶、血管紧张素原均在小鼠胰岛中表达,实时RT-PCR、western blot和二重荧光染色更证实AT1R特定地在胰岛β细胞表达[6]。高血糖可以剂量依赖的方式上调胰岛RAS系统各组分表达,亦有动物实验结果证实糖尿病小鼠胰岛细胞AT1R表达水平明显升高[7-8]。本次实验结果与此一致,db/db小鼠胰岛AT1R mRNA及蛋白的表达水平显著升高,约为db/m小鼠的3倍左右。
胰岛β细胞AT1R表达对胰岛功能可能有重要影响。AT1R阻滞剂替米沙坦长期干预治疗可下调高质饮食下胰岛炎症因子IL-1β表达,降低转录因子NF-KB百分比,降低解偶联蛋白-2(UCP-2)诱导的氧化应激,减轻内质网应激,最终减缓β细胞凋亡进而改善胰岛素分泌[9]。洛沙坦可减轻AT1R诱导的磷脂酶C-三磷酸肌醇-Ca2+信号通路对β细胞胰岛素分泌的损伤[10]。我们前期研究亦发现AT1R阻滞剂治疗能够改善胰岛局部血供,减轻胰岛内氧化应激,增加胰岛细胞数量并改善胰岛素第一相分泌[5, 11]。以上研究结果显示全身RAS阻断可不同程度保护胰岛分泌功能,但胰岛局部AT1R的表达对胰岛分泌功能有无直接调节作用尚不清楚。鉴于此,我们采用RNA干扰技术抑制离体db/db小鼠胰岛β细胞特异性AT1R表达,观察β细胞AT1R阻断后胰岛分泌功能有无变化。实验结果显示,腺病毒感染后Ad-siAT1R组AT1R表达水平显著降低,与此同时,第一相胰岛素分泌明显改善,峰值升高至140 mU/L,为基础水平的2.8倍,提示β细胞高表达的AT1R可直接损害胰岛素分泌功能。
但AT1R抑制β细胞胰岛素分泌的机制尚不清楚。有研究发现,AT II诱导的氧化应激可降低PI3K的活性,抑制其下游信号如AKT2介导的GLUTs的转运以及其他葡萄糖感受器的表达,减少胰岛素分泌[12]。GLUT2和GCK是β细胞最重要的葡萄糖感受器。血糖升高超过正常范围时GLUT2将葡萄糖转运至胰岛β细胞中,继而由GCK磷酸化进入糖酵解及氧化过程,结果使ATP/ADP的比值增加,细胞内K+通道关闭,细胞膜去极化,Ca2+通道开放,细胞内Ca2+浓度增加,存储胰岛素的囊泡与质膜融合,胰岛素释放至胞外[13]。胰岛β细胞GLUT2、GCK表达水平与胰岛分泌功能密切相关,GCK表达缺陷的β细胞需要更高的血糖浓度刺激才能启动胰岛素分泌,恢复GCK表达后可逆转这一现象,上调胰岛β细胞GLUT2表达水平亦可显著改善β细胞胰岛素分泌功能[14-15]。为此我们观察了腺病毒感染前后胰岛细胞GLUT-2及GCK表达变化情况。结果显示,抑制胰岛β细胞AT1R表达后,GLUT-2及GCK表达水平明显升高,同时伴有第一相胰岛素分泌显著改善。因此我们推测,糖尿病状态下胰岛局部高浓度的AngⅡ与β细胞过度表达的AT1R受体结合后,可通过降低GLUT-2及GCK表达水平,削弱胰岛β细胞第一相胰岛素分泌。
综上所述,本研究证实胰岛β细胞表达的AT1R与其胰岛素分泌功能密切相关,阻断β细胞AT1R可升高GLUT2和GCK的表达水平,显著改善胰岛素第一相分泌,这可能是AT1R拮抗剂改善胰岛分泌功能的机制之一。
| [1] | Ceriello A, Esposito K, Piconi L, et al. Oscillating glucose is more deleterious to endothelial function and oxidative stress than mean glucose in normal and type 2 diabetic patients[J]. Diabetes,2008, 57 (5) : 1349-54. DOI: 10.2337/db08-0063. |
| [2] | Hu Y, Liu W, Huang R, et al. Postchallenge plasma glucose excursions, carotid intima-media thickness, and risk factors for atherosclerosis in Chinese population with type 2 diabetes[J]. Atherosclerosis,2010, 210 (1) : 302-6. DOI: 10.1016/j.atherosclerosis.2009.11.015. |
| [3] | 邵加庆, 顾萍, 杜宏, 等. 替米沙坦对db/db小鼠胰岛内微血管结构的影响[J]. 中华老年心脑血管病杂志,2010, 12 (8) : 726-8. |
| [4] | Kampf C, Lau T, Olsson R, et al. Angiotensin II type 1 receptor inhibition markedly improves the blood perfusion, oxygen tension and first phase of glucose-stimulated insulin secretion in revascularised syngeneic mouse islet grafts[J]. Diabetologia,2005, 48 (6) : 1159-67. DOI: 10.1007/s00125-005-1761-z. |
| [5] | Shao J, Iwashita N, Ikeda F, et al. Beneficial effects of candesartan, an angiotensin II type 1 receptor blocker, on beta-cell function and morphology in db/db mice[J]. Biochem Biophys Res Commun,2006, 344 (4) : 1224-33. DOI: 10.1016/j.bbrc.2006.04.011. |
| [6] | Leung PS. The physiology of a local renin-angiotensin system in the pancreas[J]. J Physiol,2007, 580 (Pt 1) : 31-7. |
| [7] | Härdtner C, Mñrke C, Walther R, et al. High glucose activates the alternative ACE2/Ang-(1-7)/Mas and APN/Ang IV/IRAP RAS axes in pancreatic β-cells[J]. Int J Mol Med,2013, 32 (4) : 795-804. |
| [8] | Chu KY, Lau T, Carlsson PO, et al. Angiotensin II type 1 receptor blockade improves beta-cell function and glucose tolerance in a mouse model of type 2 diabetes[J]. Diabetes,2006, 55 (2) : 367-74. DOI: 10.2337/diabetes.55.02.06.db05-1022. |
| [9] | Yuan L, Li X, Li J, et al. Effects of renin-angiotensin system blockade on the islet morphology and function in rats with long-term high-fat diet[J]. Acta Diabetol,2013, 50 (4) : 479-88. DOI: 10.1007/s00592-010-0210-8. |
| [10] | Madec AM, Cassel R, Dubois S, et al. Losartan, an angiotensin II type 1 receptor blocker, protects human islets from glucotoxicity through the phospholipase C pathway[J]. FASEB J,2013, 27 (12) : 5122-30. DOI: 10.1096/fj.13-234104. |
| [11] | Shao JQ, Iwashita N, Du H, et al. Angiotensin II receptor blocker provides pancreatic beta-cell protection Independent of blood pressure lowering in diabetic db/db mice[J]. Acta Pharmacol Sin,2007, 28 (2) : 246-57. DOI: 10.1111/aphs.2007.28.issue-2. |
| [12] | Kasper SO, Phillips EE, Castle SM, et al. Blockade of the Renin-Angiotensin system improves insulin receptor signaling and insulin-stimulated skeletal muscle glucose transport in burn injury[J]. Shock,2011, 35 (1) : 80-5. DOI: 10.1097/SHK.0b013e3181e762da. |
| [13] | Henquin JC, Ravier MA, Nenquin M, et al. Hierarchy of the beta-cell signals controlling insulin secretion[J]. Eur J Clin Invest,2003, 33 (9) : 742-50. DOI: 10.1046/j.1365-2362.2003.01207.x. |
| [14] | Hua H, Shang L, Martinez H, et al. iPSC-derived β cells model diabetes due to glucokinase deficiency[J]. J Clin Invest,2013, 123 (7) : 3146-53. DOI: 10.1172/JCI67638. |
| [15] | Gu J, Li W, Xiao D, et al. Compound K, a final intestinal metabolite of ginsenosides, enhances insulin secretion in MIN6 pancreatic β-cells by upregulation of GLUT2[J]. Fitoterapia,2013, 87 : 84-8. DOI: 10.1016/j.fitote.2013.03.020. |
 2015, Vol. 35
2015, Vol. 35
