糖尿病脑病是糖尿病中枢神经系统慢性并发症,以大脑结构及功能改变为主要特征[1],其发生机制尚不清楚。胶质细胞源性神经营养因子(GDNF)作为转化生长因子β超家族的成员之一,主要来源于星形胶质细胞,对胆碱能神经元、海马神经元存活有营养作用[2],同时可抗神经元凋亡,可能参与了糖尿病脑病的发生。近几年研究发现肾素-血管紧张素系统(RAS)中除了包含经典成分如AngⅠ、AngⅡ等外,还有一些旁路代谢产物,如Ang(1-7)、Ang(3-8)等,其中Ang(1-7)作用尤为引人关注。最新研究发现,Ang(1-7)对学习记忆等认知功能有重要影响[3],但Ang(1-7)对GDNF的表达有无影响,目前尚不清楚。本实验通过建立糖尿病模型,侧脑室注射Ang(1-7)及其受体拮抗剂A779,观察Ang(1-7)对糖尿病大鼠海马星形胶质细胞、GDNF、凋亡相关蛋白caspase-3表达水平及认知功能的影响,探讨Ang(1-7)改善糖尿病认知功能障碍的可能机制。
1 材料与方法 1.1 实验试剂及仪器链脲佐菌素STZ(Sigma公司),Ang(1-7)(Sigma公司),Mas受体拮抗剂A779(中肽生化有限公司),兔抗大鼠GDNF多克隆抗体(Santa公司),小鼠抗大鼠GFAP单克隆抗体(Abcam公司),兔抗大鼠Caspase-3多克隆抗体(Immunoway公司),引物合成(上海生工生物有限公司),免疫组化试剂盒(中杉金桥生物技术有限公司),脑立体定位仪(美国Stoelting公司),Morris水迷宫及水迷宫记录分析系统(中国医科科学院药物研究所研制)。
1.2 实验动物40只SPF级雄性SD大鼠(8~10周龄,体质量180~220 g,由重庆医科大学动物实验中心提供),适应性喂养1周后,大鼠禁食12 h,随机选取30只SD大鼠一次性腹腔注射链脲佐菌素(streptozotocin, STZ)(60 mg/kg,溶于pH 4.5,0.1 mmol/L的柠檬酸-柠檬酸钠缓冲液)建立糖尿病模型[4],余10只大鼠腹腔注射等量柠檬酸-柠檬酸钠缓冲液作为对照,72 h后取尾静脉血,若随机血糖值≥16.7 mmol/L则视为建模成功。糖尿病大鼠随机分成3组:糖尿病组(DM组)、糖尿病+Ang(1-7)组(DM1组)、糖尿病+Ang(1-7)+A779组(DM2组)。实验过程中大鼠分笼饲养,自由采食、饮水,保持动物饲养室恒温(22~24 ℃),恒湿(60%~75%),12 h光照周期,定期更换洁净垫料。
1.3 Morris水迷宫测试建模后第12周,所有大鼠在Morris水迷宫系统中训练3 d,第4天记录大鼠从入池到站上平台的时间,即潜伏期,考察大鼠学习能力。第5天撤去平台,系统自动记录120 s内各组大鼠在目标象限穿越站台区域次数,测试大鼠空间记忆能力。药物干预7 d后,再次行该测试。
1.4 通过侧脑室进行药物干预Morris水迷宫测试后对大鼠侧脑室置管进行药物干预。腹腔注射水合氯醛(10%,1 ml/kg)麻醉大鼠后,脑立体定位仪固定大鼠,充分暴露颅骨,在侧脑室(前囟后1.0 mm,右1.5 mm,深4.0 mm)钻孔。将外径0.64 mm,内径0.45 mm的不锈钢套管(带内芯)垂直置入侧脑室,牙脱粉固定;置管第4天开始经套管注射药物:(1)NC组和DM组用微量注射器通过PE管将等量生理盐水(0.9%,1 μl)缓慢注入侧脑室,3 min内注射完毕,留针1 min;(2)DM1组用同样方法将Ang(1-7)(5 nmol,1 μl)缓慢注入侧脑室;(3)DM2组用同样方法将Ang(1-7)(5 nmol,1 μl)+A779(50 nmol,1 μl)缓慢注入侧脑室,1次/d,连续给药7 d。
1.5 RT-PCR检测大鼠海马中GDNF mRNA表达大鼠麻醉后断头取脑,快速分离海马,提取总RNA,测RNA浓度,于37 ℃、15 min,85 ℃、5 s条件下进行反转录。GDNF上游引物:5'-TCCTGACCAGTT TGATGACG-3',下游引物:5'-CTCTGCGACCTTTCC CTCT-3',扩增长度为158 bp;内参β-actin上游引物:5'-CACCCGCGAGTACAACCTTC -3',5'-CCCATAC CCACCATCACC-3',扩增长度为207 bp。向2%的琼脂糖凝胶孔中加入5 μl扩增产物进行电泳,电泳结束后利用凝胶成像分析系统显影拍照,通过quantity one软件(版本号4.5.2)分析,以目的基因/内参的灰度来计算相对表达量。
1.6 Western blot检测海马中GDNF表达新鲜海马称重,放入装有适量裂解液的匀浆管中,提取全蛋白,按照BCA法测定蛋白浓度,分装,-80 ℃保存。根据目的蛋白分子量配置SDS-PAGE分离胶,蛋白上样后电泳,恒流湿转,免疫印迹,利用ECL发光液在显影仪器上拍照,用FUSION软件(版本号Fusion FX7)分析条带灰度值,以目的蛋白/内参的灰度来计算相对表达量。
1.7 大鼠海马尼氏染色大鼠麻醉后固定,剪开胸腔充分暴露心脏,通过左心室、左心房经升主动注入约200 ml生理盐水使血管内的血液冲洗完全,然后用4%多聚甲醛灌注至大鼠四肢出现僵硬,断头取脑,固定,石蜡包埋,切片。将切片脱蜡脱水后,加入甲苯胺蓝溶液中,室温染色10 min,用双蒸水冲洗,75%乙醇进行分色,二甲苯透明,中性树胶封片。每只标本随机取1张切片,每张切片高倍镜(×400)下随机选择海马CA1区的3个视野,用ImagePro Plus软件(版本号Image-Pro Plus V 6.0)测定该区域神经元细胞存活数目。
1.8 免疫组织化学检测海马中GFAP及caspase-3表达免疫组织化学SP法进行染色,切片用二甲苯脱蜡,梯度酒精脱水;微波炉高火3 min,低火15 min抗原修复;PBS洗5 min×3次;3%过氧化氢37 ℃ 20 min;PBS洗5 min×3次;山羊封闭血清37 ℃ 30 min;分别滴加兔抗大鼠caspase-3多克隆抗体(1:100)、小鼠抗大鼠GFAP单克隆抗体(1:200),4 ℃过夜,第2天37 ℃复温1 h,PBS洗5 min×3次;滴加生物素标记二抗,37 ℃ 30 min;PBS洗5 min×3次;滴加辣根酶标记链霉卵白素工作液,37 ℃ 20 min;PBS洗5 min×3次;DAB显色,自来水冲洗后苏木精复染,盐酸酒精分化,饱和碳酸锂返蓝,梯度酒精脱水,二甲苯透明,最后中性树胶封片。每只标本随机取1张切片,每张切片高倍镜(×400)下随机选择海马CA1区的3个视野,采用Image-Pro Plus6.0软件测定该区域GFAP及caspase-3阳性染色细胞的平均光密度值(MOD)。
1.9 统计学分析数据用SPSS17.0分析,计量资料用均数±标准差表示,应用单因素方差分析多组数据间相互比较,采用LSD检验进行样本数据间的多重比较,以P < 0.05为差异有统计学意义。
2 结果 2.1 Morris水迷宫测试结果Ang (1-7)干预前,DM组、DM1组及DM2组与NC组大鼠相比,逃避潜伏期明显延长,在目标象限穿越平台的次数明显降低,存在显著性差异(P < 0.05),而DM组、DM1组及DM2组各大鼠之间逃避潜伏期和在目标象限穿越平台的次数差异无统计学意义(P > 0.05)。Ang(1-7)干预后,与DM组相比,DM1组逃避潜伏期明显下降而穿越平台次数明显提高(P < 0.05);与DM1组相比,DM2组逃避潜伏期明显延长而穿越平台次数明显减少(P < 0.05,表 1)。
| 表 1 各组大鼠Morris水迷宫测试结果 Table 1 Morris water-maze test results in different groups (Mean±SD, n=10) |
与NC组相比,DM组大鼠海马GDNF mRNA表达水平明显下降(P < 0.05);与DM组相比,DM1组大鼠海马部位GDNF mRNA表达水平提高(P < 0.05);与DM1组相比,DM2组大鼠海马GDNF mRNA表达水平明显下降(P < 0.05,图 1,表 2)。
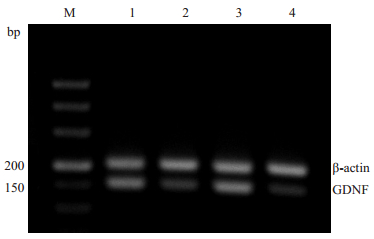
|
图 1 各组大鼠海马GDNF mRNA表达 Figure 1 Changes in GDNF mRNA expression in the hippocampus of rats in different groups. M: Marker (500 bp); Lane 1: NC group; Lane 2: DM group; Lane 3: DM1 group; Lane 4: DM2 group. |
| 表 2 各组大鼠海马GDNF mRNA和蛋白、GFAP和caspase-3MOD值及神经元存活数量的结果 Table 2 Hippocampal GDNF mRNA and protein expression, mean optical density of GFAP and caspase-3 and number of surviving neurons in the hippocampus (Mena±SD, n=10) |
与NC组相比,DM组大鼠海马GDNF蛋白的表达水平明显下降(P < 0.05);与DM组比较,DM1组大鼠海马GDNF蛋白表达增多(P < 0.05);与DM1组相比,DM2组海马部位GDNF蛋白的表达水平下降(P < 0.05,图 2,表 2)。
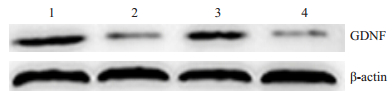
|
图 2 各组大鼠海马GDNF蛋白表达 Figure 2 Changes in GDNF protein expression in the hippocampus of rats in different groups. Lane 1: NC group; Lane 2: DM group; Lane 3: DM1 group; Lane 4: DM2 group. |
与NC组大鼠相比,DM组大鼠海马区神经元存活数量变少(P < 0.05),颜色浅;与DM组大鼠相比,DM1组大鼠海马区神经元细胞的数量、颜色均有明显改善(P < 0.05);与DM1组相比,DM2组大鼠海马区神经元细胞轮廓模糊,数量变少,颜色变浅(P < 0.05,图 3)。
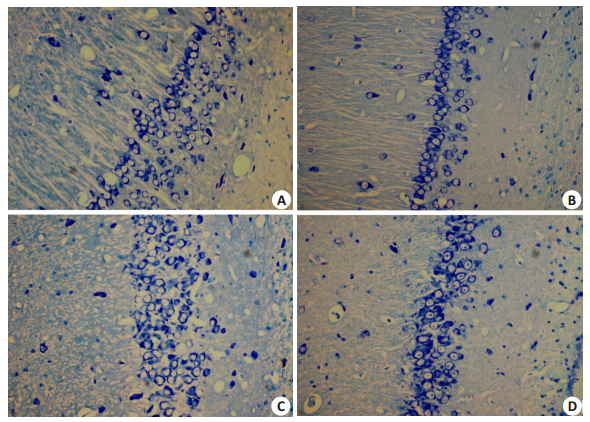
|
图 3 各组大鼠海马区尼氏染色 Figure 3 Nissl staining of the hippocampus of rats in different groups (Original magnification, × 400). A: NC group; B: DM group; C: DM1 group; D: DM2 group. |
与NC组相比,DM组大鼠海马区GFAP阳性细胞数目减少,细胞淡染,分布稀疏,突起细少,MOD值降低,caspase-3阳性细胞数增多,MOD值升高(P < 0.05);DM1组大鼠海马区GFAP阳性细胞数显著多于DM组,细胞突起粗多,MOD值升高(P < 0.05),而caspase-3阳性细胞数显著少于DM组,MOD值下降(P < 0.05);联合应用Ang(1-7)和A779后,A779阻断了Ang(1-7)对糖尿病大鼠海马GFAP和caspase-3表达的上述作用,差异有统计学意义(P < 0.05,图 4~5,表 2)。
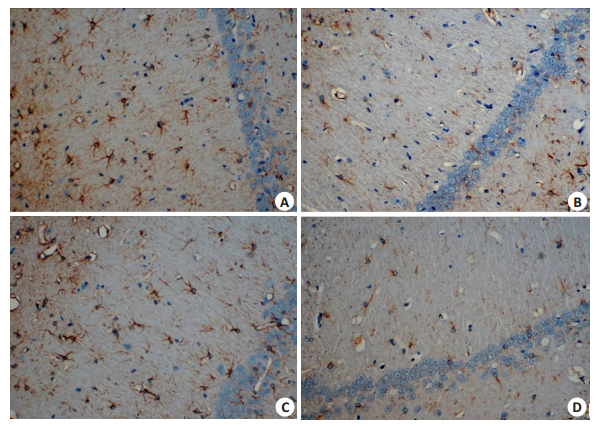
|
图 4 各组大鼠海马区GFAP免疫组化染色 Figure 4 GFAP expression in the hippiocampus of rats detected by immunohischemistry (SP staining, original magnification, ×400). A: NC group; B: DM group; C: DM1 group; D: DM2 group. |
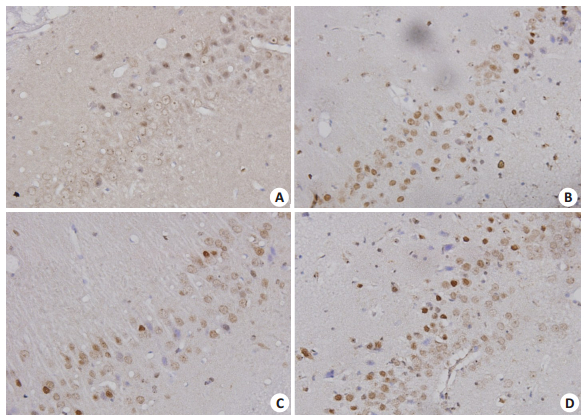
|
图 5 各组大鼠海马区caspase-3免疫组化染色 Figure 5 Caspase-3 expression in the hippiocampus of rats detected by immunohischemistry (SP staining, original magnification, ×400). A: NC group; B: DM group; C: DM1 group; D: DM2 group. |
20世纪20年代Mile和Root首先报道糖尿病影响认知功能,1965年Nielsen提出“糖尿病脑病”的概念,之后随着临床和动物研究的深入,糖尿病脑病逐渐成为神经病学、内分泌学等交叉学科的研究热点。糖尿病脑病主要表现为神经电生理、神经心理、神经生化、病理学、影像学等改变[5],其临床表现主要是学习功能减退、记忆能力下降等认知功能障碍。研究发现认知功能障碍主要是由于神经元和星形胶质细胞受损以及功能的下调引起[6]。
Ang(1-7)是RAS家族的新成员,Mas是其受体,Ang(1-7)及Mas广泛分布于海马、下丘脑、杏仁核、室旁核、齿状回等[7],激活Ang(1-7)/Mas通路后可以改善由糖尿病引起的血管、视网膜、肾脏、心脏等脏器损伤,说明Ang(1-7)对糖尿病所引起的终末器官损伤有一定的保护作用。星形胶质细胞是中枢神经系统中数量最多、分布最广、功能最复杂的一种胶质细胞,不仅起到支持、营养神经元的功能,而且与学习、记忆等认知功能也密切相关[8]。GFAP是星形胶质细胞合成的重要骨架蛋白,GFAP表达上调的程度代表星形胶质细胞增生活跃程度。本实验结果显示,糖尿病大鼠建模12周后出现认知功能障碍,海马中GFAP的表达降低,与Zuo等[4]研究结果一致,但Coleman[9]研究显示糖尿病大鼠海马GFAP表达增加,造成实验结果不同的原因可能与以下原因有关:建模所用的大鼠品种不一样;STZ量不同;建模后糖尿病持续时间不同。糖尿病大鼠应用Ang(1-7)后,糖尿病大鼠认知功能得到改善,海马中GFAP的表达增多,表明Ang(1-7)可能通过上调糖尿病大鼠海马区GFAP的表达而起到对认知功能的改善作用。
GDNF作为神经营养因子的新成员,对多种中枢神经细胞具有广泛的营养和促进存活的作用,是目前己知的神经营养因子中唯一的即可抗神经元凋亡,又可阻止神经细胞胞体萎缩的生物因子。大鼠海马内注射GDNF可以改善老龄鼠的空间学习记忆能力[10],表明GDNF可能与学习记忆有关。研究发现糖尿病大鼠认知功能障碍与海马中GDNF表达降低有关[11]。caspase-3在细胞凋亡中发挥重要作用,是多种死亡受体介导凋亡途径的共同下游效应部分,是细胞凋亡蛋白酶级联反应的必经途径。本实验结果提示Ang(1-7)与Mas受体结合后通过上调糖尿病大鼠海马中GDNF表达,抑制caspase-3的表达,减少海马神经元受损,进而改善糖尿病大鼠认知功能,其原因可能是外源性Ang(1-7)增强星形胶质细胞的功能,通过分泌营养因子和抗神经元凋亡等方式发挥脑保护作用。除此以外,Ang(1-7)改善糖尿病大鼠认知功能的作用可能还存在其他机制,如易化海马LTP效应[12]、调节类胆碱突触、上调海马中胰岛素降解酶的表达、增加Aβ的降解等[13]。
综上所述,本实验结果表明:Ang(1-7)对糖尿病大鼠认知功能有改善作用,机制可能与上调大鼠海马中GFAP和GDNF的表达、影响神经元存活有关。然而,糖尿病脑病的发病机制极其复杂,目前对Ang(1-7)的研究也主要集中在高血压等血管性病变[14-15],它与糖尿病脑病的相关研究还处于探索阶段,继续深入研究二者之间的关系对于阐明糖尿病脑病的发病机制以及指导其临床诊断与防治都有重要意义。
| [1] | Sima AA. Encephalopathies: the emerging diabetic complications[J]. Acta Diabetol,2010, 47 (4) : 279-93. DOI: 10.1007/s00592-010-0218-0. |
| [2] | Lapchak PA, Miller PJ, Jiao S. Glial cell line-derived neurotrophic factor induces the dopaminergic and cholinergic phenotype and increases locomotor activity in aged Fischer 344 rats[J]. Neuroscience,1997, 77 (3) : 745-52. DOI: 10.1016/S0306-4522(96)00492-7. |
| [3] | Renno WM, Al-Banaw AG, George P, et al. Angiotensin-(1-7) via the mas receptor alleviates the diabetes-induced decrease in GFAP and GAP-43 immunoreactivity with concomitant reduction in the COX-2 in hippocampal formation: an immunohistochemical study[J]. Cell Mol Neurobiol,2012, 32 (8) : 1323-36. DOI: 10.1007/s10571-012-9858-7. |
| [4] | Zuo ZF, Wang W, Niu L, et al. RU486 (mifepristone) ameliorates cognitive dysfunction and reverses the down-regulation of astrocytic N-myc downstream-regulated gene 2 in streptozotocininduced type-1 diabetic rats[J]. Neuroscience,2011, 190 : 156-65. DOI: 10.1016/j.neuroscience.2011.06.025. |
| [5] | Liu YW, Zhu X, Zhang L, et al. Cerebroprotective effects of ibuprofen on diabetic encephalopathy in rats[J]. Pharmacol Biochem Behav,2014, 117 : 128-36. DOI: 10.1016/j.pbb.2013.11.027. |
| [6] | Ma LY, Zhang DM, Tang Y, et al. Ghrelin-attenuated cognitive dysfunction in streptozotocin-induced diabetic rats[J]. Alzheimer Dis Assoc Disord,2011, 25 (4) : 352-63. DOI: 10.1097/WAD.0b013e31820ce536. |
| [7] | Pereira MG, Souza LL, Becari C, et al. Angiotensin II-independent angiotensin-(1-7) formation in rat hippocampus: involvement of thimet oligopeptidase[J]. Hypertension,2013, 62 (5) : 879-85. DOI: 10.1161/HYPERTENSIONAHA.113.01613. |
| [8] | Fields RD, Araque A, Johansen-Berg H, et al. Glial biology in learning and cognition[J]. Neuroscientist,2014, 20 (5) : 426-31. DOI: 10.1177/1073858413504465. |
| [9] | Coleman ES, Dennis JC, Braden TD, et al. Insulin treatment prevents diabetes-induced alterations in astrocyte glutamate uptake and GFAP content in rats at 4 and 8 weeks of diabetes duration[J]. Brain Res,2010, 1306 : 131-41. DOI: 10.1016/j.brainres.2009.10.005. |
| [10] | Pertusa M, García-Matas S, Mammeri H, et al. Expression of GDNF transgene in astrocytes improves cognitive deficits in aged rats[J]. Neurobiol Aging,2008, 29 (9) : 1366-79. DOI: 10.1016/j.neurobiolaging.2007.02.026. |
| [11] | 尹国平.糖尿病大鼠脑内GDNF和ChAT表达的变化及相关性[D].济南:山东大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10422-2005132283.htm |
| [12] | Hellner K, Walther T, Schubert M, et al. Angiotensin-(1-7) enhances LTP in the hippocampus through the G-protein-coupled receptor Mas[J]. Mol Cell Neurosci,2005, 29 (3) : 427-35. DOI: 10.1016/j.mcn.2005.03.012. |
| [13] | 唐燕霞, 肖谦, 薛艳艳, 等. 血管紧张素1-7对糖尿病大鼠海马胰岛素降解酶的表达及认知功能的影响[J]. 中国老年学杂志,2012, 32 (8) : 1651-3. |
| [14] | Jiang T, Gao L, Shi J, et al. Angiotensin-(1-7) modulates reninangiotensin system associated with reducing oxidative stress and attenuating neuronal apoptosis in the brain of hypertensive rats[J]. Pharmacol Res,2013, 67 (1) : 84-93. DOI: 10.1016/j.phrs.2012.10.014. |
| [15] | Regenhardt RW, Mecca AP, Desland F, et al. Centrally administered angiotensin-(1-7) increases the survival of stroke-prone spontaneously hypertensive rats[J]. Exp Physiol,2014, 99 (2) : 442-53. DOI: 10.1113/eph.2014.99.issue-2. |
 2015, Vol. 35
2015, Vol. 35
