2. 南方医科大学解剖学教研室//广东省医学生物力学重点实验室,广东 广州 510515
2. Department of Anatomy, Southern Medical University, Guangdong Provincial Key Laboratory of Medical Biomechanics, Guangzhou 510515, China
随着数字医学技术的发展,三维可视化系统MI-3DVS的出现[1],可快速将CT二维(2D)图像转化为3D可视化图像并应用于肝胆外科疾病的诊治。近年来,3D打印技术已经应用于医学领域,如头颈外科、骨科、生物医药研究等[2]。3D打印技术在小肝癌诊治中,顺利完成手术并获得阴性切缘的良好效果[3]。传统2D腹腔镜在肝切除术发挥了重要作用,但由于空间、深度感缺失等原因,一定程度上限制了腹腔镜肝切除术的发展。而3D腹腔镜具有良好的景深感、高清分辨率、可精确定位等优点[4]。我们采用三维可视化联合3D腹腔镜曾对16例肝胆疾病进行手术[5],实现了精准的肝胆外科数字化微创手术。在此基础上,为了全面实现肝脏肿瘤解剖数字化、诊断三维程序化、手术三维可视化,本研究将三维可视化、3D打印和3D腹腔镜技术相结合,应用于肝脏肿瘤的外科诊治。经查询,国内外尚未见类似文献报道。
1 资料与方法 1.1 研究对象收集2013年12月~2015年1月南方医科大学珠江医院肝胆一科22例患者的临床资料。其中男14例,女8例,年龄52±13(28~70)岁。术前诊断为原发性肝癌11例,肝功能级别均为Child -pugh A级,均伴有乙肝背景,其中AFP20 μg/L~6184 μg/L 6例;肝转移癌3例;结节性增生2例;肝血管瘤6例。所有患者均签署知情同意书,符合医疗护理操作常规。
1.2 CT扫描与数据收集采用256层螺旋CT (Philips Brilliance,荷兰)扫描,收集患者平扫、动脉期、门静脉期和肝静脉期薄层CT数据,具体参数及方法见文献[6]。
1.3 三维可视化 1.3.1 三维可视化将薄层CT数据导入腹部医学图像三维可视化软件系统(MI-3DVS),进行快速图像分割、配准和三维重建[6]。
1.3.2 肝脏脉管分型采用Michels肝动脉分型[7],Cheng门静脉分型[8],Nakamura等[9]和幕内雅敏肝脏外科》肝静脉分型[10]。
1.3.3 虚拟肝体积计算采用MI-3DVS软件进行虚拟肝切除,并计算功能肝体积、肝肿瘤体积、残肝体积等[11]。
1.4 3D打印物理模型步骤将MI-3DVS重建的3D图像STL文件导入到快速成型软件ZEditTM3.21(3D systems,美国)中,采用Spectrum ZTM 510(3D systems,美国)打印机进行打印1:1 3D物理模型,然后进行打印后处理,即完成3D打印模型制作[12]。
1.5 3D腹腔镜解剖性肝切除术步骤采用德国KARL STORZ 3D高清摄像系统和索尼高清监视器,结合三维可视化图像、3D打印模型,进行腹腔镜下解剖性肝切除术。
(1)体位:左肝病灶切除采用仰卧位;右肝病灶切除采用左侧倾斜卧位,右腰部略垫高,适当头高足底。(2)Trocar选择及操作空间的建立:根据情况需要采用4孔或5孔进行操作,于脐周,穿刺置入10 mm套管作为置入腹腔镜观察孔。右半肝切除术主操作孔位于剑突下,副操作孔位于右锁骨中线肋缘下2~3 cm,左半肝切除术主操作孔位于左锁骨中线肋缘下2~3 cm,副操作孔位于右腹直肌外侧缘,根据情况需要再适当增加1~2个辅助操作孔,进行辅助肝脏手术。(3)肝肿瘤定位:通过便携计算机的阅读三维可视化软件Viewer观看3D图像模型,辨认脉管、肿瘤位置,并调整至与患者肝脏同样的解剖位置,同时将3D打印模型放置于与患者肝脏同样的解剖位置,置入3D腹腔镜探查,进一步确定肝切除术方案。(4)第一肝门解剖与区域性血流阻断:根据术前三维可视化图像对肝动脉和门静脉辨认,结合3D打印模型定位,解剖第一肝门;根据肝切除术部位需要对入肝血流进行选择性阻断;根据肝脏表面会出现相应的缺血线、结合三维可视化图像虚拟肝切除平面和3D打印模型术前虚拟切除平面决策,确定实际肝切除术平面。(5)其余步骤同文献[13]。
1.6 观察指标虚拟肝切除体积、残肝体积、功能肝体积、肿瘤体积,以及手术时间、术中出血量、实际肝切除体积和术后住院时间。
1.7 术后随访术后定期1~11月进行随访,中位数5月,进行AFP和CT检查,并行三维可视化。
1.8 统计学分析采用SPSS19.0统计软件进行分析,计量资料用均数±标准差表示,分类变量资料采用率表示。虚拟肝脏体积与实际切除肝脏体积比较采用t检验,其相关检验采用Pearson相关分析,P < 0.05认为有统计学差异。
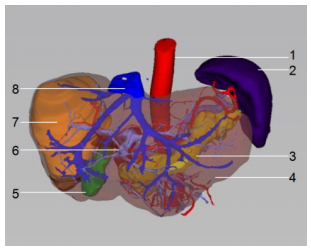
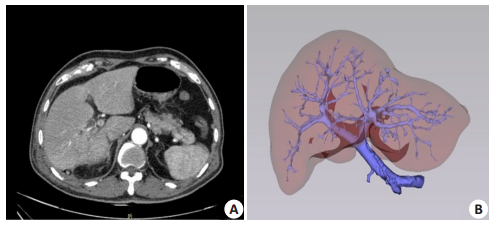
2 结果 2.1 三维可视化结果 2.1.1 肝脏、肝脏脉管与肝肿瘤的空间位置关系通过MI-3DVS三维可视化系统,可获得结构清晰、立体感强的可视化肝脏3D图像,并可清晰辨认肝肿瘤与肝脉管的空间关系(图 1)。
|
图 1 肝脏三维可视化图像 Figure 1 The 3D visualization image of the liver model. 1: Abdominal aorta, 2: Spleen; 3: Pancreas; 4: Liver; 5: Gallbladder; 6: Portal vein; 7: Liver tumor 8.hepatic vein. |
(1)Michels肝动脉分型:Ⅰ型19例,Ⅱ型2例,Ⅷ型1例,未见其他型变异;(2)Cheng门静脉分型:Ⅰ型17例,Ⅱ型2例,Ⅲ型2例,Ⅳ型1例,Ⅴ、Ⅵ、Ⅶ型变异未见;(3)Nakamura肝静脉分型:①LHV(肝左静脉)和MHV(肝中静脉)汇入ⅣC(下腔静脉)结果:LHV和MHV共干后汇入ⅣC共19例;LHV、MHV单独汇入IVC共3例;②肝右静脉(RHV)分型:根据RHV距离根部1 cm有无分支,以及出现引流Ⅶ段的肝右上静脉和/或引流Ⅷ段的静脉情况分型:距离根部1 cm以内无静脉分支(即Ⅰ型)17例;距离根部1 cm以内有静脉分支(即包括Ⅱa、Ⅱb、Ⅲ)为5例;③右半肝的静脉分型:根据右半肝静脉、肝右下静脉或肝右静脉以及肝中静脉的不同组合分型:Ⅰ型:RHV粗大,引流肝右叶大部分,伴有小的或不伴右后下肝静脉(IRHV),占10例;Ⅱ型:RHV中等大小,IRHV中等大小,占7例;Ⅲ型:只有引流Ⅶ段的短小的RHV,MHV粗大,IRHV较粗大,占5例。
2.1.3 虚拟肝切除体积测量根据肿瘤位于肝段,结合肝脏脉管走行,进行以肝段为本的虚拟肝切除,计算相应肝体积,结果:功能肝体积1 248±106 ml;肝脏肿瘤体积137±123 ml;虚拟切除肝体积490±228 ml;残肝体积885±139 ml;残肝体积与功能肝体积之比0.71±0.11(范围0.39~0.86)(注:功能肝体积=全肝体积-肿瘤体积)。
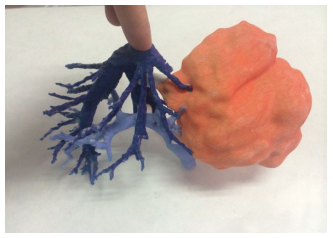
2.2 3D打印模型可获得高保真的3D打印模型,真实立体反映了肝肿瘤与脉管的空间关系,通过观察可明确重要脉管的走行,术前可多维度预见术中解剖(图 2)。
|
图 2 肝肿瘤与脉管3D物理模型 Figure 2 A physical 3D printed model showing the liver tumor (yellowish brown), the hepatic vein (dark blue), and the portal vein (grey). |
22例患者中,20例患者在3D腹腔镜下完成解剖性肝切除术,2例中转开腹。平均手术时间186±92 min,平均术中出血量284±286 ml,平均实际切除肝体积491±192 ml,平均术后住院时间8.6±3.7 d。20例在3D腹腔镜下完成解剖性肝切除术,其中右半肝切除4例,右后叶切除2例,左半肝切除2例,左外叶切除5例,肝段Ⅴ、Ⅵ、Ⅷ和亚肝Ⅳb段切除分别为2例、2例、1例和2例。平均手术时间175±89 min,平均术中出血量212±174 ml,平均术后住院时间8.0±3.2 d。中转开腹2例,其中1例为肝右后叶切除,1例为肝Ⅷ段切除。均为解剖位置所限制、术中出血而中转开腹完成手术。平均手术时间290±42 min,术中平均出血量1000±141 ml,平均术后住院时间15.1±2.6 d。20例腹腔镜完全手术患者术后第2~3天可下地活动,术后2~4 d拔除胃肠减压管,术后3~7 d可拔除腹腔引流管。
2.3.2 术后病理情况肝细胞癌11例,转移腺癌2例,肉瘤样肝细胞癌1例,海绵状肝血管瘤6例,结节性增生2例。14例肝恶性肿瘤均获得阴性切缘(R0)。
2.3.3 术后并发症胸腔积液3例,腹水1例,胆漏1例,其余17例术后无并发症,术后无肝功能衰竭发生。无患者围手术期死亡。
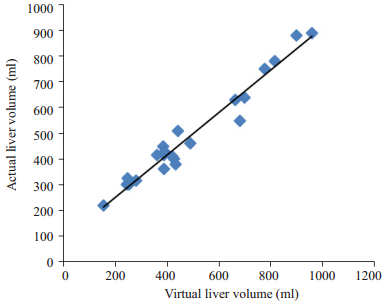
2.3.4 虚拟切除肝体积和实际切除肝体积比较虚拟切除肝体积为490±228 ml,实际切除肝体积为491±192 ml,两者t检验比较(t=-0.016,P > 0.05),差异无统计学意义,Pearson相关性检验(r=0.979,P < 0.001),说明虚拟切除肝脏体积和实际切除肝脏体积具有高度相关性(图 3)。
|
图 3 虚拟肝切除体积和实际肝切除体积Pearson相关分析 Figure 3 Correlation analysis of the resected liver volume between the virtual and actual operations of liver resection. |
术前6例AFP异常的患者,均于术后2周~3月下降至正常。1例原发性肝癌,术后6个月CT检查和三维可视化发现肝内转移并伴有门静脉癌栓形成。
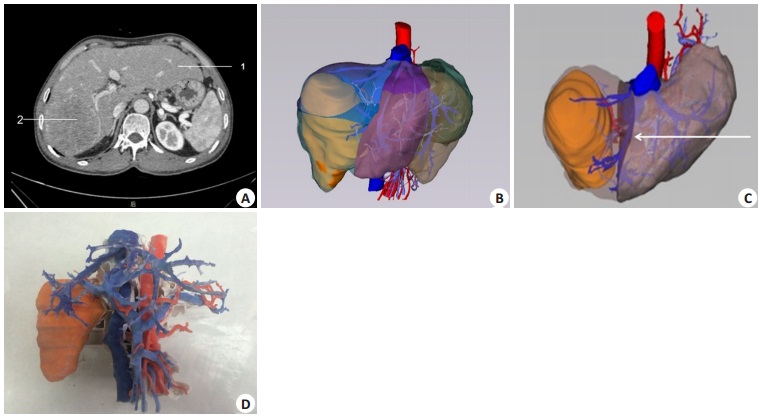
2.4 典型病例典型病例1:患者余某,男性,58岁,因“直肠癌术后6年余,反复右上腹胀痛7 d”入院。查体:腹部平坦,左下腹可见长约15 cm纵行手术疤痕。右锁骨中线肋缘下约5 cm,剑突下约3 cm可触及肝脏,边缘钝,无触痛,移动性浊音阴性。CT:肝右叶肿块,大小8.3 cm× 9.5 cm×12.0 cm,呈“快进快出”表现,考虑肝右叶肝癌。术前诊断:(1)右肝转移性腺癌;(2)直肠癌术后。术前三维可视化评估:功能肝体积为1 450 ml,肿瘤体积433 ml,虚拟切除肝体积为765 ml,残肝体积为1 018 ml,残肝体积比0.70。手术时间为290 min,术中出血650 ml,实际切除肝体积为750 ml,术后住院时间12 d。术后病理:肝右叶转移性腺癌。术后7月CT复查和三维可视化均未见肿瘤复发(图 4~6)。
|
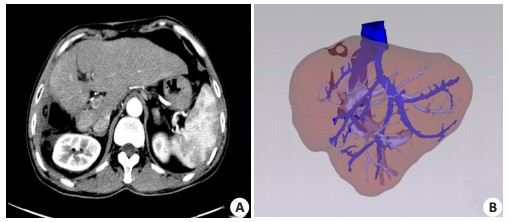
图 4 术前影像学资料 Figure 4 Preoperative imaging data. A: Preoperative CT image (1. liver, 2. hepatic tumor); B: Tumor location in couinaud Ⅴ, Ⅵ, Ⅶ and Ⅷ segments; C: The plane of virtual liver resection (yellow arrow); D: 3D printed model of the liver tumor and the vascular system. |
|
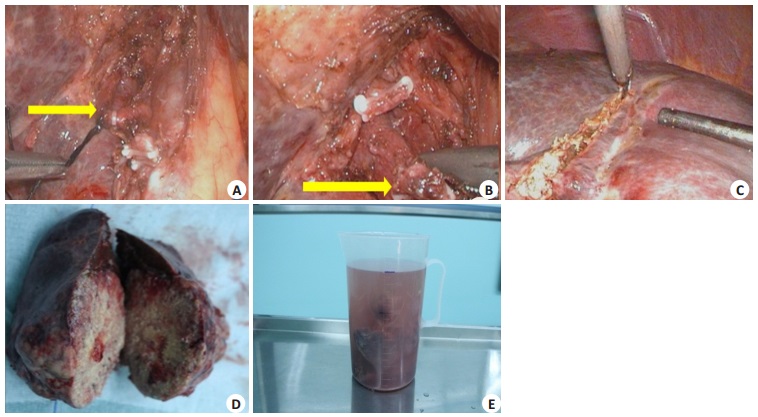
图 5 术中图像资料 Figure 5 Intraoperative imaging data. A: Dissection of the right hepatic artery (yellow arrow); B: Dissection of the right portal vein (yellow arrow); C: Resection of liver ischemia with the transection line; D: Resected specimen of the liver; E: Volume measurement of the resected specimen by liquid displacement. |
|
图 6 术后影像学资料 Figure 6 Postoperative imaging data. A: Postoperative CT image; B: Postoperative 3D imaging model. |
典型病例2:许某,男,68岁,体检发现肝脏占位10天入院。查体:腹部平坦,肝脏肋缘下未触及,未触及腹部包块,肝肾区无叩击痛,移动性浊音阴性。CT:肝右叶肿块,大小4.6 cm×5.4 cm×6.0 cm,增强扫描呈“快进快出”表现,考虑肝细胞癌。术前诊断:(1)肝右叶原发性肝癌(2)慢性乙型病毒性肝炎。术前三维可视化评估:功能肝体积为1050 ml,肿瘤体积为50 ml,虚拟切除肝体积327 ml,残肝体积722 ml,残肝体积比0.68。手术时间为300 min,术中出血量为450 ml,实际切除体积为310 ml,术后住院10 d。术后病理:肝细胞肝癌,伴脂肪变。术后5月CT复查和3D可视化未见肿瘤复发(图 7~9)。
|
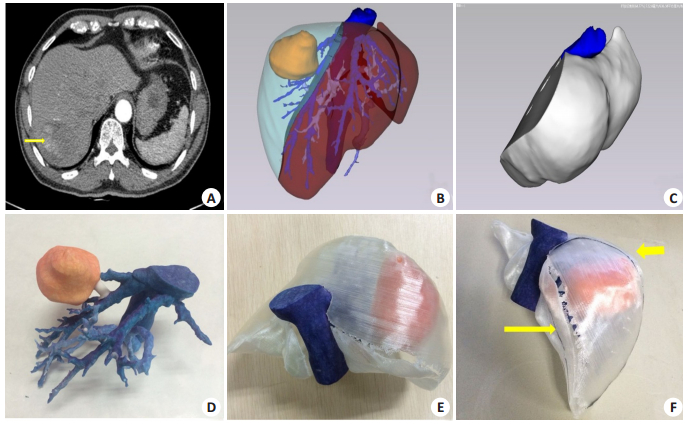
图 7 术前影像学资料 Figure 7 Preoperative imaging data. A: Preoperative CT image of the liver tumor (yellow arrow). B: Virtual hepatectomy showing the liver tissue to be virtually resected (light blue), liver tumor (brown), and virtually reserved liver tissue (red); C: Automatic measurement of the remnant liver volume (722 ml); D: 3D printed model; E: Semi-transparent 3D printed model of the liver showing the liver tumor (brown-yellow), the liver surface (white), and the inferior vena cava (dark blue); F: Virtual liver resection on 3D printed model with a virtual transection line (yellow arrow). |
|
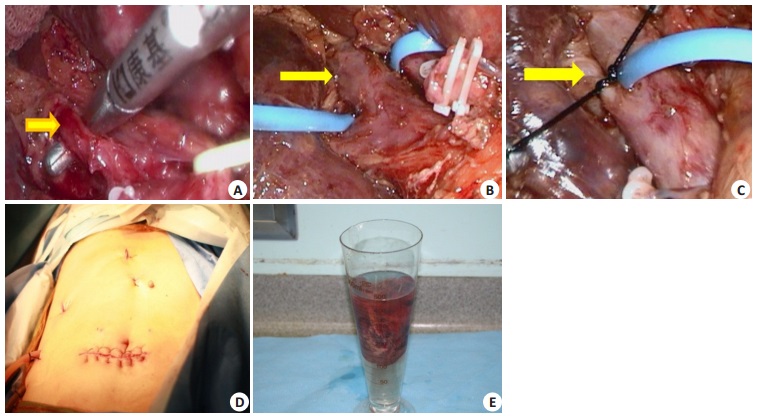
图 8 术中图像资料 Figure 8 Intraoperative imaging data. A: Dissection of the right posterior hepatic artery (yellow arrow); B: Dissection of the right anterior portal vein (yellow arrow); C: Ligation of the right posterior portal vein; D: Photograph after abdominal skin suture; E: Volume measurement of the resected specimen. |
|
图 9 术后影像资料 Figure 9 Postoperative imaging data. A: Postoperative CT image (arterial phase); B: Postoperative 3D reconstruction model showing the absence of the right posterior portal vein. |
通过三维可视化,可清晰辨认肝肿瘤位置、肝脏脉管结构,以及其立体空间关系。如果进行半肝切除术,对于Cheng氏门静脉Ⅱ型变异,在离断门静脉分支时,应距离左右分叉处1 cm以上进行处理,避免术后门静脉狭窄的发生[14]。对于门静脉Cheng分型Ⅲ、Ⅳ型,右半肝切除术时,必须确保没有结扎、离断门静脉左支,否则术后将导致门静脉左支缺如,引起灾难性的后果[15]。本研究中,Cheng氏门静脉Ⅱ型、Ⅲ型和Ⅳ型变异,分别为2例、2例和1例,其中2例进行右半肝切除术,1例为Ⅱ型变异,离断门静脉右支,于距离门静脉左右支分叉处1.5 cm以远进行离断,术后1月CT检查和三维可视化显示无门静脉狭窄;1例为门静脉Ⅳ型变异,进行第一肝门解剖,明确门静脉左支走行才进行离断门静脉右后、右前分支,确保了保留左半肝的门静脉供血的完整性,该患者术后恢复良好。
肝切除术中,保留足够的肝脏回流静脉,可减少术后肝脏淤血等不良事件的发生。如属于右半肝静脉分型Ⅰ型时,进行肝脏的肝Ⅶ段或/和肝Ⅷ段切除术之前,根据三维可视化和3D打印模型明确保留肝脏的肝静脉回流分支,保障肝Ⅵ段和肝Ⅴ段的回流静脉,可避免术后肝脏淤血而可能导致肝功能不全。Gobardhan等[16]认为进行腹腔镜右半肝切除时,明确肝Ⅷ段的回流静脉是汇入肝中静脉还是直接汇入下腔静脉,可避免必要的术中大出血。
术前准确评估残肝体积是至关重要的。基于CT数据进行的三维可视化除了能准确计算残肝体积[17],还能提供肝脏脉管结构与肝脏肿瘤的空间关系,对于术前手术规划及指导实际手术都有重要临床意义。正常肝脏,保留的残肝体积与功能肝体积比>0.3;伴肝炎肝硬化、肝脏化疗后等肝功能异常,残肝体积比>0.5 [18],一般可避免肝切除术术后肝功能衰竭发生。本文22例肝肿瘤患者,残肝体积比为0.71±0.11(0.39~0.86),术后无肝功能衰竭发生,并且虚拟肝切除肝体积和实际切除肝体积分别为490±228 ml和491±192 ml,Pearson相关性检验r=0.979,P < 0.001,这说明两者体积相关性高,也说明MI-3DVS可视化系统有助于肝切除术围手术期处理。
3.2 肝脏3D打印模型,可用于指导肝脏手术3D打印实现了三维图像向实体三维物理模型的跨越式转变。进行腹腔镜肝切除时,将3D打印模型带入手术室与术中实时手术进行比对,通过调整3D打印模型并置于最佳解剖位置,可为手术关键步骤提供直观的实时导航,对关键部位快速识别和定位。通过精确定位病灶并确定手术切除平面,实时引导重要脉管的分离和肿瘤病灶的切除,实现完整切除病灶和避免重要解剖结构的副损伤,从而提高手术的根治性切除,降低手术风险。本研究14例肝恶性肿瘤患者均获得了R0切缘。Zein等[19]采用半透明肝脏3D模型于活体肝移植中,表明术中通过实时调整3D打印模型,有助于关键部位的解剖定位、肝离断面的脉管处理,并减少手术时间和并发症。
3.3 3D腹腔镜对肝脏肿瘤手术的意义解剖性肝切除术[20]具有如下优势:符合肝肿瘤外科的根治原则,可获得更好的预后;相比于开腹,对肿瘤触摸和挤压更少,更符合“无瘤原则”;区域性血流阻断,更好地保护了剩余肝脏功能,减少了术后肝功能衰竭的发生;手术切口小,术后疼痛轻,对免疫功能影响小,患者术后恢复快,并发症少。Cai等[21]认为出血是腹腔镜肝切除手术过程中最常见的并发症,也是中转开腹的主要原因。而术中出血也是肝切除术后死亡的一个危险因素,已被证实是影响近期和远期预后的不利因素[22]。难以控制肝断面出血和肝内脉管出血,是腹腔镜肝切除术未能广泛开展的原因之一[23]。因此,控制出血是腹腔镜肝切除术成败的关键。3D腹腔镜具有良好的景深感、空间定位和高清视野,有助于辨认肝门、肝脏深部各种管道结构。结合3D打印模型,更有利于进行区域性入肝血流阻断[24],进而可从容地进行肝切除术。本研究中,肝切除术中需要进行第一肝门解剖,均可顺利完成并进行区域性血流阻断。Tranchart等[22]认为腹腔镜下进行区域性血流阻断,具有比全肝血流阻断更少的术中输血量和输血率,并可减少术后住院时间。本研究22例患者,共有20例在3D腹腔镜下完成解剖性肝切除术,平均手术时间175±89 min,平均术中出血量212±174 ml,说明3D腹腔镜下肝切除术手术操作、术中出血是可控的。
目前腹腔镜大块肝切除术[16, 25]的文献较少,本研究进行9例腹腔镜下大块肝切除术,顺利完成了8例,其中右半肝切除4例,左半肝切除2例,右后叶切除术2例(典型病例2是其中1例)。另外1例为右后叶切除中因术中出血中转开腹完成,说明3D腹腔镜在大块肝切除术中具有优势。因此,3-3D技术有助于术前安全评估、关键解剖部位的定位、实时导航手术和解剖性肝切除术。
| [1] | Fang CH, Tao HS, Yang J, et al. Impact of three-dimensional Reconstruction technique in the operation planning of centrally located hepatocellular carcinoma[J]. J Am Coll Surg,2015, 220 (1) : 28-37. DOI: 10.1016/j.jamcollsurg.2014.09.023. |
| [2] | Michalski MH, Ross JS. The shape of things to come 3D printing in medicine[J]. JAMA,2014, 312 (21) : 2213-4. DOI: 10.1001/jama.2014.9542. |
| [3] | Igami T, Nakamura Y, Hirose T, et al. Application of a threedimensional print of a liver in hepatectomy for small tumors invisible by intraoperative ultrasonography: preliminary experience[J]. World J Surg,2014, 38 (12) : 3163-6. DOI: 10.1007/s00268-014-2740-7. |
| [4] | 范应方, 项楠. 3D腹腔镜胆囊切除术治疗胆囊结石1例并文献复习[J]. 南方医科大学学报,2013, 33 (12) : 1856-7. |
| [5] | 项楠, 方驰华, 范应方, 等. 三维可视化技术联合3D腹腔镜在肝胆外科的应用[J]. 中华消化外科杂志,2014, 13 (4) : 306-9. |
| [6] | 杨剑, 方驰华, 范应方, 等. 基于亚毫米CT扫描数据的肝外胆管供血动脉三维可视化模型构建[J]. 南方医科大学学报,2014, 34 (7) : 945-9. |
| [7] | Michels NA. Newer anatomy of the liver and its variant blood supply and collateral circulation[J]. Am J Surg,1966, 112 (3) : 337-47. DOI: 10.1016/0002-9610(66)90201-7. |
| [8] | Cheng YF, Huang TL, Lee TY, et al. Variation of the intrahepatic portal vein; angiographic demonstration and application in living-related hepatic transplantation[J]. Transplant Proc,1996, 28 (3) : 1667-8. |
| [9] | Nakamura S, Tsuzuki T. Surgical anatomy of the hepatic veins and the inferior vena cava[J]. Surg Gynecol Obstet,1981, 152 (1) : 43-50. |
| [10] | 幕内雅敏. 要点与盲点:肝脏外科[M]. 北京: 人民卫生出版社, 2010 : 17 -21. |
| [11] | 方驰华, 冯石坚, 范应方, 等. 三维可视化技术在评估残肝体积及指导肝切除中的应用研究[J]. 肝胆外科杂志,2012, 20 (2) : 95-8. |
| [12] | 孔祥雪, 聂兰英, 肖菊姣, 等. 新型肝脏管道模型的数字化制造研究[J]. 中国临床解剖学杂志,2014, 32 (3) : 256-8. |
| [13] | 中华医学会外科学分会肝脏外科学组. 腹腔镜肝切除专家共识与手术操作指南(2013版)[J]. 中华消化外科杂志,2013, 12 (3) : 161-5. |
| [14] | 刘允怡. 肝切除与肝移植应用解剖学[M]. 北京: 人民卫生出版社, 2010 : 39 -50. |
| [15] | Germain T, Favelier S, Cercueil JP, et al. Liver segmentation: practical tips[J]. Diagn Interv Imaging,2014, 95 (11) : 1003-16. DOI: 10.1016/j.diii.2013.11.004. |
| [16] | Gobardhan PD, Subar D, Gayet B. Laparoscopic liver surgery[J]. Best Pract Res Clin Gastroenterol,2014, 28 (1) : 111-21. DOI: 10.1016/j.bpg.2013.11.012. |
| [17] | Ulla M, Ardiles V, Levy-Yeyati E, et al. New surgical strategy to induce liver hypertrophy: role of MDCT-volumetry to monitor and predict liver growth[J]. Hepatogastroenterology,2013, 60 (122) : 337-42. |
| [18] | Mise Y, Sakamoto Y, Ishizawa T, et al. A worldwide survey of the current daily practice in liver surgery[J]. Liver Cancer,2013, 2 (1) : 55-66. DOI: 10.1159/000346225. |
| [19] | Zein NN, Hanouneh IA, Bishop PD, et al. Three-Dimensional print of a liver for preoperative planning in living donor liver transplantation[J]. Liver Transplantation,2013, 19 (12) : 1304-10. DOI: 10.1002/lt.v19.12. |
| [20] | Ahn KS, Kang KJ, Park TJ, et al. Benefit of systematic segmentectomy of the hepatocellular carcinoma[J]. Ann Surg,2013, 258 (6) : 1014-21. DOI: 10.1097/SLA.0b013e318281eda3. |
| [21] | Cai X, Li Z, Zhang Y, et al. Laparoscopic liver resection and the learning curve: a 14-year, single-center experience[J]. Surg Endosc,2014, 28 (4) : 1334-41. DOI: 10.1007/s00464-013-3333-5. |
| [22] | Tranchart H, Di Giuro G, Lainas P, et al. Laparoscopic liver resection with selective prior vascular control[J]. Am J Surg,2013, 205 (1) : 8-14. DOI: 10.1016/j.amjsurg.2012.04.015. |
| [23] | Yin Z, Fan X, Ye H, et al. Short-and long-term outcomes after laparoscopic and open hepatectomy for hepatocellular carcinoma: a global systematic review and meta-analysis[J]. Ann Surg Oncol,2013, 20 (4) : 1203-15. DOI: 10.1245/s10434-012-2705-8. |
| [24] | 蔡秀军, 王一帆, 梁霄, 等. 区域性血流阻断技术在腹腔镜肝切除术中的应用[J]. 中华外科杂志,2006, 44 (19) : 1307-9. |
| [25] | Lin N, Nitta H, Wakabayashi G. Laparoscopic major hepatectomy[J]. Ann Surg,2013, 257 (2) : 205-13. DOI: 10.1097/SLA.0b013e31827da7fe. |
 2015, Vol. 35
2015, Vol. 35
