2. 西安交通大学医学院第一附属医院心内科,陕西 西安 710061 ;
3. 西安交通大学环境与疾病相关基因教育部重点实验室,陕西 西安 710061
2. Department of Cardiology, First Affiliated Hospital, Xi'an Jiaotong University College of Medicine, Xi'an 710061, China ;
3. Key Laboratory of Environment and Genes Related to Diseases, Xi'an Jiaotong University, Ministry of Education, Xi'an 710061, China
流行病学数据表明慢性肾功能不全(CRI)患者的心血管疾病风险远高于一般人群,透析患者心血管疾病死亡率较一般人群高10~20倍[1]。CRI患者相对于一般人群更易出现动脉粥样硬化(AS)病变,有更高的冠心病发病风险,透析人群中冠心病发病率接近40% [2]。与肾功能正常个体相比,慢性肾脏病(CKD)的每个时期AS发生率都明显升高,斑块的进展也明显加快。内环境紊乱是CRI患者的重要特征,可能是造成AS加速发展的原因,但其机制并不十分清楚。尽管透析可以部分纠正尿毒症患者的内环境紊乱,但并未明显降低AS相关疾病的发生率。硫酸吲哚酚(IS)是一类不能通过透析清除的白蛋白结合性尿毒症毒素,既往研究表明其主要通过炎症和氧化应激反应破坏血管内皮和平滑肌细胞的正常生理功能发挥致AS作用[3-4],但其对巨噬细胞脂质代谢(胆固醇为主的脂质流入流出)及泡沫细胞形成的作用尚无报道。我们建立尿毒症apoE-/-小鼠模型,观察尿毒症apoE-/-小鼠主动脉根部AS病变。同时观察CRI患者血清和IS对体外培养巨噬细胞脂质转运相关受体的表达及胞内脂质含量的影响,探讨尿毒症性AS的可能发病机制之一。
1 材料与方法 1.1 材料新生牛血清购自杭州四季青生物工程材料有限公司;硫酸吲哚酚钾盐、Ox-LDL、多聚甲醛粉剂、油红O粉剂、苏木素粉剂均购自Sigma公司;Trizol、逆转录试剂盒、实时荧光定量PCR试剂盒(DyNAmoTM SYBR Green qPCR Kits)均购于Takara公司。上海泰益医疗仪器设备有限公司932型电热烧灼器由由西安交通大学医学院机能中心提供;Nikon公司细胞照相机,日本Olympus公司倒置生物显微镜(2E14121),武汉千屏影像技术有限责任公司图像分析系统(HMIAS2000),美国BioRad公司IQ5实时定量PCR仪,Bio Rad公司核酸定量仪,德国LEICA公司恒冷箱切片机均由西安交通大学“环境与疾病相关基因”教育部重点实验室提供;Hitachi 7060全自动生化分析仪由西安交通大学医学院第一附属医院检验科提供。小鼠源性RAW264.7巨噬细胞株购自中科院上海细胞生物所细胞中心;C57BL/ 6J遗传背景的apoE-/-种鼠(B6.129P2-ApoEtm1Unc)购自中国南京大学模式动物遗传研究中心,C57BL /6J小鼠由西安交通大学医学院实验动物中心提供,实验用鼠均饲养于西安交通大学医学院实验动物中心层流室,出生后4周离乳,喂以标准饲料:5%脂肪、18.9%蛋白质、72.3%碳水化合物、1.01%钙、0.65%磷。
1.2 方法 1.2.1 尿毒症apoE-/-小鼠动物模型的建立及主动脉根部AS病变检测8周龄雄性apoE-/-小鼠随机分成尿毒症组及假手术组,C57BL/6J雄性小鼠作为对照组。参照Gagnon的方法[5]采用两步外科手术法建立尿毒症apoE-/-小鼠动物模型:行2 cm右侧腹切口,暴露右肾,除了肾门周围2 mm完整组织,电凝整个右肾皮质,仔细处理输尿管及避免损伤肾上腺;2周后即10周龄时,通过左侧腹切口暴露左肾,在双结扎肾血管及输尿管后摘除左肾。假手术组仅做双肾被膜剥离(8周龄暴露右肾,10周龄暴露左肾)[6-8]。0号丝线用于整个过程,所有操作在10%水合氯醛腹腔内麻醉下进行。造模后10周,尿毒症apoE-/-小鼠组、假手术apoE-/-小鼠组、对照C57BL/6J小鼠组各4只,采集血标本检测肾功能指标(尿素氮、肌酐)、血脂(胆固醇、甘油三酯)和血糖(Hitachi7060全自动生化分析仪检测),根据肾功指标判断造模是否成功。同时采集主动脉根部组织行横截面冰冻连续切片,油红O染色,以AS斑块占动脉管腔横截面的面积百分比(S斑块/S管腔)来代表AS病变相对大小[7]。
1.2.2 CRI患者及对照血清的采集及配制CRI患者血清(10例)采自西安交通大学医学院第一附属医院肾内科住院患者:血肌酐>445 μmol/L,肾小球滤过率(eGFR) < 30 ml/min·1.73 m2(CKD4期及5期),排除急性肾衰竭。健康对照血清(10例)采自西安交通大学医学院第一附属医院体检中心:血肌酐 < 75 μmol/L,排除心血管疾病。本研究符合赫尔辛基宣言的原则,所有CRI患者和健康对照者签字知情同意,并获得西安交通大学医学院第一附属医院伦理委员会的批准。两组人群年龄均在70岁以下;排除近期急性感染、手术外伤、心梗、脑卒中、急性心衰发作、糖皮质激素或免疫抑制剂治疗史;排除合并糖尿病、病毒性肝炎、结核、其他自身免疫疾病、肿瘤、妊娠。两组人群的年龄、性别、血脂(TG及LDL)无统计学差异。分别混合10例CRI患者血清及10例对照者血清,配制以下浓度分组干预巨噬细胞:①对照组:培养基+10%对照血清孵育(CRI血清终浓度0%,以0%表示);②5%血清组:培养基+5%对照血清+5%CRI血清(CRI血清终浓度5%,以5%表示);③ 10%血清组:培养基+10%CRI血清(CRI血清终浓度10%,以10%表示)。
1.2.3 硫酸吲哚酚溶液的配制及干预分组IS纯品易分解,多以盐类形式保存,所购IS为硫酸吲哚酚钾盐,为排除K+的影响,每组给予不同剂量的KCl,保证干预各组钾盐浓度一致,并设置空白对照组。分组干预巨噬细胞如下:①空白组:培养基(不含K+、IS,该组以Con表示);②对照组:培养基+500 μmol/L KC(l K+终浓度500 μmol/L,IS终浓度0%,该组以0 μmol/L表示);③低浓度组:培养基+250 μmol/L KCl+250 μmol/L IS(K+终浓度500 μmol/L,IS终浓度250 μmol/L,该组以250 μmol/L表示);④高浓度组:培养基+500 μmol/L IS(K+终浓度500 μmol/L,IS终浓度500 μmol/L,该组以500 μmol/L表示)。
1.2.4 诱导巨噬细胞泡沫化和油红O染色不同浓度的血清或IS干预RAW264.7巨噬细胞24 h,贴壁良好的巨噬细胞胰酶消化后接种于6孔板中,加入无血清DMEM培养基18 h(或过夜)后,每孔更换新鲜的无血清DMEM培养基2 ml,加入ox-LDL使每孔终浓度为50 mg/ml。水平放置于恒温细胞培养箱中静置培养48 h后行油红O染色。染色后立即显微镜下观察、拍照,细胞吞脂程度以脂滴面积/细胞面积表示,镜下随机选取3处视野,分析细胞脂质含量。
1.2.5 细胞总mRNA提取及胆固醇转运受体RT-PCR检测血清或IS干预12 h后的巨噬细胞加入0.5 ml Trizol试剂充分裂解,经氯仿、异丙醇提取组织RNA,乙醇洗涤,DEPC水溶解。将提取的RNA样本放置于冰上,按1:10稀释后于微量紫外分光光度计上测RNA浓度,保证所提取得mRNA在260 nm和280 nm吸光值之比(A260/A280)在1.8-2.0之间。将提取的RNA逆转录:按Takara逆转录试剂盒10 μl体系试剂盒操作要求进行逆转录反应。RT-PCR:选择GAPDH作为内参,根据GAPDH、CD36、SRA1、ABCA1、ABCG1、SRB1基因序列设计引物。引物如下:GAPDH:Forward 5-CTTTGGCATTGTGGAAGGGCTC-3,Reverse 5-GCAGGGA TGATGTTCTGGGCAG-3;CD36:Forward 5-GACATGATTAATGGCACAGACGC-3,Reverse 5-TTTCAG ATCCGAACACAGCGTAG-3;SRA1:Forward 5-GC TTTCTCCTTCTGCCTTTATCC-3,Reverse 5-GACA CCGAGAGCCATCTTTATCATT-3;ABCA1:Forward 5-GAACCGCTTCGTCTCTCCGCTC-3,Reverse 5-C CCGCCTCACATCCTCATCCTC-3;ABCG1:Forward 5-AAGGGGGTCGCTCCATCATTT-3,Reverse 5-GG TTGTGGTAGGTTGGGCAGTT-3;SRB1:Forward 5-GATCCCTATCCCCTTCTATCTCTCC-3,Reverse 5-C TTTTGTGCCTGAACTCCCTGTA-3。按Takara要求的加样体系进行Real Time PCR反应。扩增反应条件为预变性:95 ℃ 10 s;变性:95 ℃ 5 s;退火:60 ℃ 15 s;延伸:72 ℃ 10 s,共45个循环。分析CD36、SRA1、ABCA1、ABCG1、SRB1 mRNA的相对表达量用2-△△CT方法[9]。
1.2.6 统计学分析所有结果以均数±标准差表示,体外实验重复3次,应用SPSS 18.0统计软件分析实验数据。多样本参数检验采用one-way analysis of variance(ANOVA)方差分析。P < 0.05时认为有统计学差异。
2 结果 2.1 尿毒症apoE-/-小鼠模型的构建及主动脉根部AS病变特点造模后10周,假手术组与对照组的肾功能无显著性差异(尿素氮:10.9±1.64 mmol/L vs 9.42±3.20 mmol/L,P > 0.05;肌酐:14.7±1.82 μmol/L vs 15.2±3.25 μmol/L,P > 0.05)。尿毒症apoE-/-小鼠的肾功能指标较假手术组明显升高(尿素氮:26.9±3.97 mmol/L vs 10.9±1.64 mmol/L,P < 0.01;肌酐:45.4±3.80 μmol/L vs 14.7±1.82 μmol/L,P < 0.01),提示尿毒症apoE-/-小鼠造模成功(图 1)。假手术组与尿毒症apoE-/-小鼠的血清总胆固醇和甘油三酯水平均较对照组升高(P < 0.05)。与假手术组相比,尿毒症apoE-/-小鼠有更高的血清总胆固醇和甘油三酯水平(P < 0.05)。血糖水平在3组之间无显著性差异(P > 0.05,表 1)。
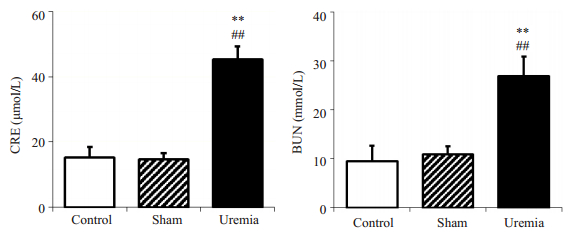
|
图 1 对照组、假手术与尿毒症apoE-/-小鼠肾功能指标的比较 Figure 1 Comparison of renal functional parameters in control, sham-operated and uremic apoE-/-mice. **P < 0.01 vs control group, ##P < 0.01 vs sham-operated apoE-/-mice; n=4 in each group. |
| 表 1 对照组、假手术与尿毒症apoE-/-小鼠血脂、血糖的比较 Table 1 Comparison of serum lipids and glucose parameters in control, sham-operated and uremic apoE-/-mice (Mean±SD, mmol/L, n=4) |
造模后10周,对照C57BL/6J小鼠主动脉根部横切面均无AS斑块形成;假手术apoE-/-小鼠可见明显的AS斑块,但管腔并未出现明显狭窄[S 斑块/S 管腔:(9.75±1.42)%];而尿毒症apoE-/-小鼠可见弥漫的AS斑块,并引起管腔狭窄[S 斑块/S 管腔:(24.5±1.71)%]。尿毒症组与假手术组相比AS病变相对面积显著增大([24.5±1.71)% vs(9.75±1.42)%,P < 0.01,图 2]。
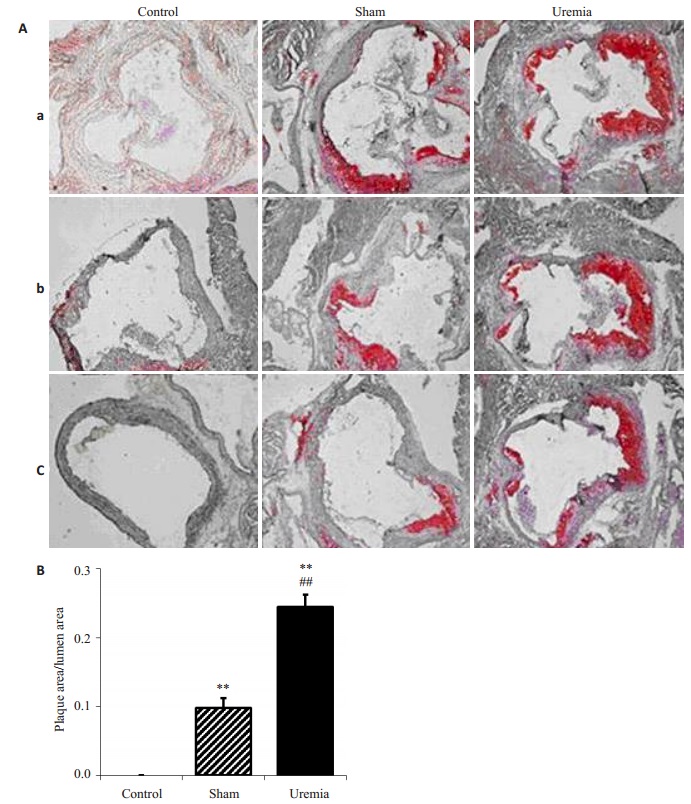
|
图 2 对照组、假手术与尿毒症apoE-/-小鼠主动脉根部AS损伤相对面积的比较 Figure 2 Comparison of relative area of atherosclerotic lesions from aortic root in control, sham-operated and uremic apoE-/-mice. A: Red oil O staining (Original magnification, × 100). a, b, c: Proximal, median, and distal segments of the aortic root. B: Comparison of relative area of AS lesion. n=4 in each group. **P < 0.01 vs control group, ##P < 0.01 vs sham-operated apoE-/-mice. |
与对照血清相比:5%浓度的CRI患者血清干预下巨噬细胞内脂质含量明显增加((10.35±1.46)% vs(5.30±0.63)%,P < 0.01),10%浓度的CRI患者血清干预下巨噬细胞脂质含量也明显升高((12.62±4.96)% vs(5.30±0.63)%,P < 0.05);10%较5%CRI血清干预下巨噬细胞内脂质含量稍增加,但差异无统计学意义((12.62±4.96)% vs(10.35±1.46)%,P > 0.05,图 3)。与对照血清相比,5%和10%浓度的CRI血清干预下巨噬细胞表面胆固醇流入受体CD36 mRNA表达量明显升高(P < 0.01或P < 0.05),而其他胆固醇转运受体SR-A1、ABCA1、ABCG1和SR-B1的mRNA表达量均未见明显差异(P > 0.05,图 4)。
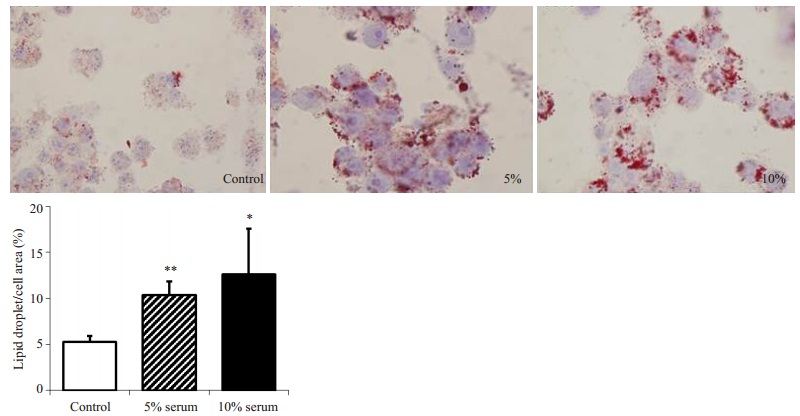
|
图 3 不同浓度CRI患者血清对巨噬细胞脂质聚集的影响 Figure 3 Effect of 5% and 10% CRI serum on lipid aggregating in macrophages. Red oil O staining (Original magnification, ×100). *P < 0.05, **P < 0.01 vs control group. n=3 in each group. |
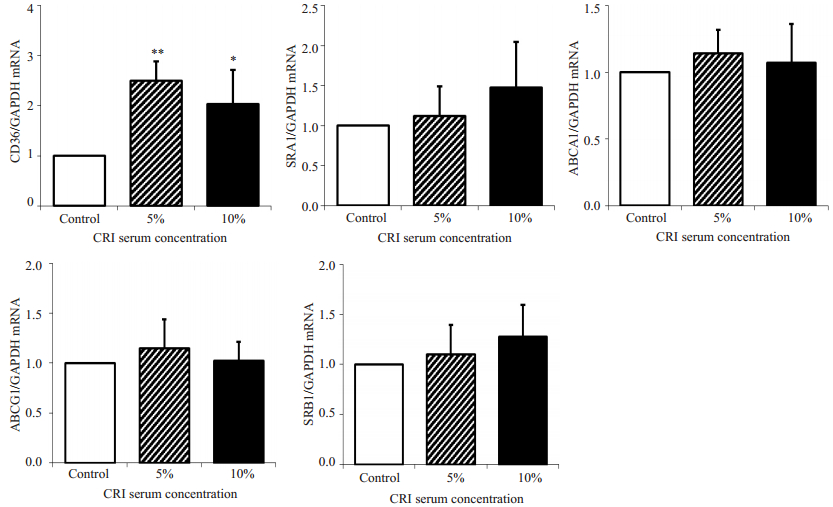
|
图 4 CRI患者血清对巨噬细胞胆固醇转运受体mRNA表达的影响 Figure 4 Effect of CRI serum on mRNA expression of cholesterol transporting receptors in the macrophages. *P < 0.05, **P < 0.01 vs control group. n=6 in each group. |
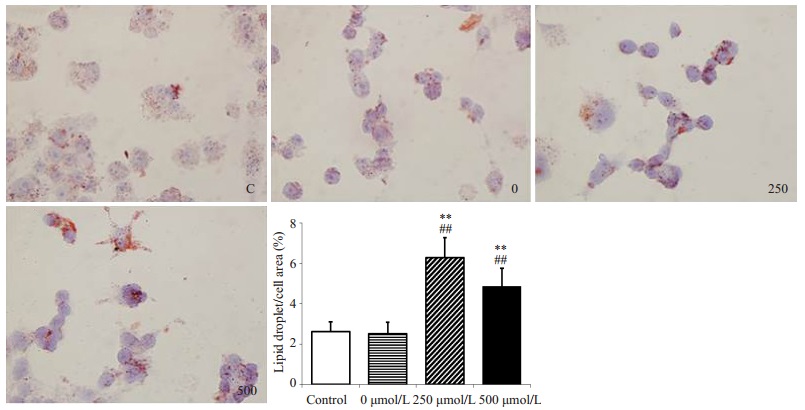
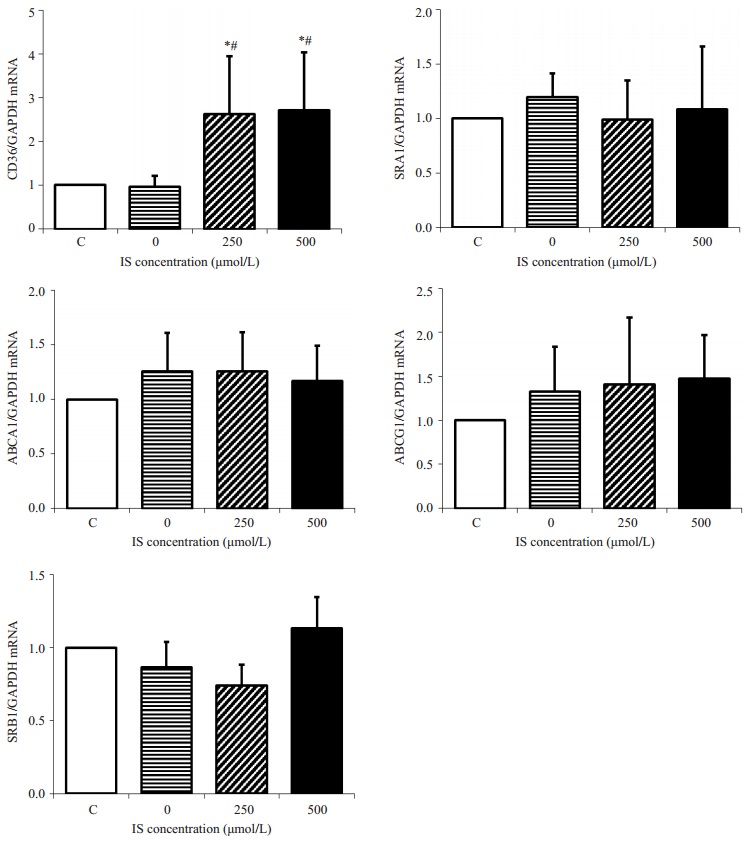
巨噬细胞脂质含量在空白培养基干预组和0 μmol/L的IS干预组之间无差异((2.62±0.49)% vs(2.51±0.57)%,P > 0.05),提示KCL对巨噬细胞吞脂无影响。250 μmol/L浓度的IS干预下巨噬细胞内脂质含量明显增加((6.29±0.99)% vs(2.51±0.57)%, P < 0.01),500 μmol/L浓度的IS干预下巨噬细胞脂质含量也明显升高((4.85±0.92)% vs(2.51±0.57)%,P < 0.01),而250 μmol/L和500 μmol/L浓度的IS干预组之间巨噬细胞脂质含量无显著性差异((6.29±0.99)% vs(4.85±0.92)%,P > 0.05,图 5)。空白培养基组和0 μmol/L的IS干预组之间胆固醇转运受体CD36、SR-A1、ABCA1、ABCG1和SR-B1 mRNA表达无显著差异(P > 0.05)。250 μmol/L和500 μmol/L的IS干预下巨噬细胞表面CD36 mRNA表达量均较空白对照组和0 μmol/L的IS干预组明显升高(P < 0.05),而250 μmol/L和500 μmol/L浓度的IS干预组之间无明显差异(P > 0.05);其余胆固醇转运受体SR-A1、ABCA1、ABCG1和SR-B1 mRNA的表达在各组间均未见明显差异(P > 0.05,图 6)。
|
图 5 不同浓度IS对巨噬细胞脂质聚集的影响 Figure 5 Effect of indoxyl sulfate at different concentrations on lipid aggr-egation in macrophages. Red oil O staining (Original magnification, × 100). C: Blank control group, 0: 0 μmol/L of IS; 250: 250 μmol/L of IS; 500: 500 μmol/L of IS. **P < 0.01 vs control group, ##P < 0.01 vs 0 μmol/L of IS group. n=3 in each group. |
|
图 6 IS对巨噬细胞胆固醇转运受体mRNA表达的影响 Figure 6 Effect of indoxyl sulfate on mRNA expression of cholesterol transporting receptors in the macrophages. C: Blank control group, *P < 0.05 vs control group, #P < 0.05 vs 0 μmol/L of IS group. n=4~8 in each group. |
CRI已经成为全世界所面临的重要公共卫生问题,AS相关的心血管疾病已成为CRI患者死亡的主要原因之一。CRI患者AS的进展往往较一般人群迅速,解剖学和病理学分析印证了CRI加速AS病变的事实[10-13]。CKD I期患者即已出现动脉内膜增厚的表现,而在CRI进展过程中,GFR低于60 ml/min·1.73 m2时冠脉狭窄会加速加重[14],并不可避免的发展为冠心病,药物和手术治疗效果也不如一般人群。探索尿毒症性AS的发病机制及有效治疗措施有望减少CRI患者AS相关疾病的死亡率和提高其生活质量。
在apoE-/-小鼠的基础上我们通过两步外科手术法建立了尿毒症apoE-/-小鼠的动物模型,模型鼠肾功能检测指标提示造模成功。我们发现野生型C57BL/6J小鼠主动脉根部无AS斑块形成,而C57BL/6J遗传背景的apoE-/-小鼠主动脉根部有明显的AS斑块形成,提示缺乏apoE基因的保护机制,小鼠易于发展AS。尿毒症apoE-/-小鼠主动脉根部AS斑块较假手术组明显增大,提示CRI加速加重AS的进展,为研究尿毒症性AS提供了理想的动物模型。
CKD患者内环境存在不同程度的病理改变,如持续的炎症状态、脂代谢紊乱以及毒素蓄积,可能是造成AS加重的原因[15]。巨噬细胞贯穿于AS斑块组织脂质代谢的全过程,定植于动脉壁的巨噬细胞过量吞噬氧化低密度脂蛋白形成具有致AS作用的泡沫细胞,巨噬细胞功能发生改变可能影响泡沫细胞的形成,是AS形成和进展中的关键环节,从而加快或延迟AS的发病过程。那么CRI内环境的紊乱与巨噬细胞吞脂即泡沫细胞形成之间的关系如何呢?我们研究发现CRI患者血清干预巨噬细胞株,其诱导的泡沫细胞脂质蓄积明显增加,提示CRI的确具有加速泡沫细胞形成的作用,而这种作用是通过血液内环境造成的。由于肾功能不全,GFR的逐渐降低,大量代谢产物包含多种毒素清除率下降,无法通过肾脏完全清除。血清中毒素的蓄积是尿毒症与非尿毒症内环境最鲜明的差异。我们进一步研究一种重要的蛋白结合性尿毒症毒素IS对巨噬细胞吞脂的影响,发现其也能促进巨噬细胞内脂质的蓄积。这提示CRI血清对巨噬细胞源性泡沫细胞蓄脂的影响至少部分通过IS而发挥作用的。本实验证实了蛋白结合类尿毒症毒素IS在泡沫细胞形成过程中的促脂质蓄积作用,这一作用似乎可以解释长期透析患者的高AS发生率现象,也为其他蛋白结合类毒素在尿毒症性AS发病中的作用打开了新的视角。
本研究结果提示CRI患者血清诱导巨噬细胞脂质蓄积作用并非呈浓度依赖性,低浓度CRI血清(5%)干预下的巨噬细胞诱导泡沫细胞出现脂质蓄积增加,而更高浓度CRI血清(10%)对于脂质蓄积的增强作用有限。在IS干预实验中也观察到类似的现象,IS促进脂质蓄积在250 μmol/L浓度下最为明显,这一浓度在CKD患者血清IS浓度范围内,具有一定实际意义,而2倍于此浓度的IS干预并未出现泡沫细胞脂质蓄积的进一步增加。更高浓度的CRI血清和尿毒症毒素IS对巨噬细胞有毒性作用,导致细胞活性降低,对脂质摄取能力不能进一步增加。这印证了CKD患者肾功和AS进展的非同步性,或许在肾功能轻度异常时即已产生促AS作用,从而导致CKD患者AS的早发性。
在AS的进展中,巨噬细胞通过表面受体介导内吞胆固醇,促进AS,同时通过活性转运体介导胆固醇流出,延缓斑块的形成[16]。巨噬细胞胆固醇的流入和流出相互平衡,而平衡的破坏是泡沫细胞形成的关键,直接导致AS斑块的加重[17]。为了明确CRI患者血清及IS是通过何种机制促进巨噬细胞内脂质聚集,我们观察CRI血清和IS对巨噬细胞胆固醇流入受体CD36、SRA1和流出受体ABCA1、ABCG1、SRB1 mRNA表达的影响,结果发现CRI患者血清及IS干预可诱导巨噬细胞CD36 mRNA表达上调,提示CRI患者血清中的IS可能通过上调CD36 mRNA的表达促进巨噬细胞吞脂形成泡沫细胞,进而加速AS的发生发展。病理环境下形成的ox-LDL通过巨噬细胞胞膜上的SRA1和CD36介导以脂筏途径吞噬入胞来启动泡沫细胞形成初始过程[18-19]。SRA在生理状态贫脂的巨噬细胞吞噬ox-LDL过程中起作用,而CD36则主要参与泡沫细胞形成过程中的吞脂行为[20],在AS的进展中发挥重要作用。CD36基因敲除可使AS小鼠主动脉斑块面积明显减少76.5%~45% [21]。持续血液透析和腹膜透析的CKD患者,血液中单核细胞CD36的表达较正常肾功者或未透析CKD患者明显升高[22-23]。因此巨噬细胞通过胆固醇转运受体CD36吞噬ox-LDL增加可能是CRI内环境紊乱促进泡沫细胞脂质蓄积的主要原因。
巨噬细胞胆固醇的外流通过两条途径完成,一是ATP结合盒转运蛋白(ABC),通过消耗ATP进行物质转运的膜蛋白家族,其中的A1和G1在细胞胆固醇流出中发挥重要作用;二是清道夫受体B1(SRB1),是HDL的另一类膜受体,在巨噬细胞膜上可介导胞内多余的胆固醇酯转运至贫脂的HDL中,降低脂质负荷。而此次CRI血清和尿毒症毒素IS干预巨噬细胞的实验中并未发现ABCA1、ABCG1、SRB1 mRNA表达的改变,这可能由于CRI内环境的紊乱对巨噬细胞胆固醇流出受体的影响较小,也可能与贫脂的巨噬细胞(尚未ox-LDL诱导)中低水平的胆固醇流出受体的变化轻微而不易被察觉有关。
总之,本研究发现CRI可加速AS的发展,这与CRI患者体内内环境紊乱,即不易被透析所清除的蛋白结合类尿毒症毒素如IS在体内蓄积,引起巨噬细胞表面胆固醇转运受体CD36 mRNA的表达升高,促进巨噬细胞摄脂转变为泡沫细胞有关。这对CKD患者早发的AS和冠心病的防治具有重要意义。更深入的研究CRI内环境的改变是通过何种细胞传导通路影响泡沫细胞的形成具有重要的临床意义。
| [1] | Hou FF. Cardiovascular complication in patients with chronic renal disease[J]. Chin J Cardiol,2004, 32 (Suppl) : 16. |
| [2] | Foley RN, Parfrey PS, Sarnak MJ. Epidemiology of cardiovascular disease in chronic renal disease[J]. J Am Soc Nephrol,1998, 9 (suppl) : S16-23. |
| [3] | Adelibieke Y, Shimizu H, Muteliefu G, et al. Indoxyl sulfate induces endothelial cell senescence by increasing reactive oxygen species production and p53 activity[J]. J Ren Nutr,2012, 22 (1) : 86-9. DOI: 10.1053/j.jrn.2011.10.027. |
| [4] | Muteliefu G, Enomoto A, Niwa T. Indoxyl sulfate promotes proliferation of human aortic smooth muscle cells by inducing oxidative stress[J]. J Ren Nutr,2009, 19 (1) : 29-32. DOI: 10.1053/j.jrn.2008.10.014. |
| [5] | Gagnon RF, Gallimore B. Characterization of a mouse model of chronic uremia[J]. Urol Res,1988, 16 (2) : 119-26. DOI: 10.1007/BF00261969. |
| [6] | Yan Shen, Zu-yi Yuan, Yan Xiao, et al. Establishment of a uremic apolipoprotein E knockout mouse model to explore the mechanism of uremic atherosclerosis[J]. Academic Journal of Xi'an Jiaotong University,2010, 22 (2) : 111-5. |
| [7] | 申燕, 袁祖贻, 刘艳, 等. 尿毒症ApoE基因敲除小鼠加速发展的动脉粥样硬化与体内T细胞(Treg/ Teff)平衡的关系[J]. 南方医科大学学报,2010, 30 (2) : 214-8. |
| [8] | Yan Shen, Zuyi Yuan, Aiping Yin, et al. Antiatherogenic effect of pioglitazone on uremic apolipoprotein-E knockout mice by modulating the balance of regulatory and effector T cells[J]. Atherosclerosis,2011, 218 (2) : 330-8. DOI: 10.1016/j.atherosclerosis.2011.07.112. |
| [9] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) Method[J]. Methods,2001, 25 (4) : 402-8. DOI: 10.1006/meth.2001.1262. |
| [10] | Liu IT, Wu JS, Yang YC, et al. Mild chronic kidney disease associated with greater risk of arterial stiffness in elderly adults[J]. J Am Geriatr Soc,2013, 61 (10) : 1758-62. DOI: 10.1111/jgs.12445. |
| [11] | Olechnowicz-Tietz S, Gluba A, Paradowska A, Banach M, et al. The risk of atherosclerosis in patients with chronic kidney disease[J]. Int Urol Nephrol,2013, 45 (6) : 1605-12. DOI: 10.1007/s11255-013-0407-1. |
| [12] | Amann K. Media calcification and intima calcification are distinct entities in chronic kidney disease[J]. Clin J Am Soc Nephrol,2008, 3 (6) : 1599-605. DOI: 10.2215/CJN.02120508. |
| [13] | Miyagi M, Ishii H, Murakami R, et al. Impact of renal function on coronary plaque composition[J]. Nephrol Dial Transplant,2010, 25 (1) : 175-81. DOI: 10.1093/ndt/gfp423. |
| [14] | Nicholls SJ, Tuzcu EM, Hsu A, et al. Comparison of coronary atherosclerotic volume in patients with glomerular filtration rates≤60 versus >60 ml/ min/1.73 m2: a meta-analysis of intravascular ultrasound[J]. Am J Cardiol,2007, 99 (6) : 813-6. DOI: 10.1016/j.amjcard.2006.10.038. |
| [15] | Kutyrina IM, Rudenko TE, Savel'eva SA, et al. Risk factors for cardiovascular system damage in chronic kidney disease[J]. Ter Arkh,2013, 85 (9) : 69-76. |
| [16] | Cuchel M, Rader DJ. Macrophage reverse cholesterol transport: key to the regression of atherosclerosis?[J]. Circulation,2006, 113 (21) : 2548-55. DOI: 10.1161/CIRCULATIONAHA.104.475715. |
| [17] | Yancey PG, Bortnick AE, Kellner-Weibel G, et al. Importance of different pathways of cellular cholesterol efflux[J]. Arterioscler Thromb Vasc Biol,2003, 23 (5) : 712-9. DOI: 10.1161/01.ATV.0000057572.97137.DD. |
| [18] | Kunjathoor VV, Febbraio M, Podrez EA, et al. Scavenger receptors class A-Ⅰ/Ⅱ and CD 36 are the principal receptors responsible for the uptake of modified low density lipoprotein leading to lipid loading in macrophages[J]. J Biol Chem,2002, 277 (51) : 49982-8. DOI: 10.1074/jbc.M209649200. |
| [19] | Endemann G, Stanton LW, Madden KS, et al. CD36 is a receptor for oxidized low density lipoprotein[J]. J Biol Chem,1993, 268 (16) : 11811-6. |
| [20] | Tsukamoto K, Kinoshita M, Kojima K, et al. Synergically increased expression of CD36, CLA-1 and CD68, but not of SR-A and LOX-1, with the progression to foam cells from macrophages[J]. J Atheroscler Thromb,2002, 9 (1) : 57-64. DOI: 10.5551/jat.9.57. |
| [21] | Febbraio M, Podrez EA, Smith JD, et al. Targeled disruption of the class B scavenger receptor CD36 protects against atherosclerotic lesion development in mice[J]. J Clin Invest,2000, 105 (8) : 1049-56. DOI: 10.1172/JCI9259. |
| [22] | Wu CC, Chen JS, Lin SH, et al. Aberrant activation of the TNF-α system and production of Fas and scavenger receptors on monocytes in patients with end-stage renal disease[J]. Artif Organs,2005, 29 (9) : 701-7. DOI: 10.1111/aor.2005.29.issue-9. |
| [23] | Chmielewski M, Bryl E, Marzec L, et al. Expression of scavenger receptor CD36 in chronic renal failure patients[J]. Artif Organs,2005, 29 (8) : 608-14. DOI: 10.1111/aor.2005.29.issue-8. |
 2015, Vol. 35
2015, Vol. 35
