2. 中国人民解放军总医院神经内科,北京 100853
2. Department of Neurology, General Hospital of PLA, Beijing 100853, China
有研究证实,增加调节性T细胞在体内的数量可以有效的预防或延缓自身免疫性疾病的发生[1]。按照提高或修复Treg的免疫抑制功能来治疗疾病的思路,在类风湿关节炎中有了初步的成果。用抗肿瘤坏死因子药物治疗类风湿关节炎患者后发现:患者体内的CD4+ CD25+ Treg的数量有明显的回升,其免疫抑制功能也得到了恢复,Foxp3的表达水平同时也有增加[2]。还有研究发现用抗TNF-α单抗治疗的RA患者体内,观察到一种有别于天然Treg的新的Treg亚型的增加,这种Treg主要能分泌IL-10和TGF-β来弥补天然Treg的不足[3]。基于同一思路,Treg细胞完全可以应用于多发性肌炎的治疗。
Waschbisch等[4]研究发现Foxp3+Treg细胞有助于抵消细胞毒性T细胞对多肌炎患者肌肉组织的破坏。Allenbach等[5]发现将注射Treg细胞可以显著改善多肌炎小鼠模型的病情,上述发现均提示Treg细胞与多发性肌炎免疫调节密切相关,且有可能应用于疾病的临床治疗。遗憾的是,均未涉及Treg细胞在多发性肌炎治疗机制的研究。
1 材料与方法 1.1 研究对象无特异病原体的雌性BALC/c小鼠,6~8周龄,体质量15~19 g,购于解放军总医院实验动物中心,提供充足饲料、清洁水,光照等条件,保持正常昼夜生活节律。制备骨骼肌匀浆用豚鼠1只(500 g)。本研究经解放军总医院动物伦理委员会通过。完全弗氏佐剂购于美国Sigma公司,百日咳杆菌原液购于北京天坛生物制品研究所。BCA蛋白定量试剂盒购于北京康为世纪生物科技有限公司。CD4+ CD25+ Regulatory T Cell Isolation Kit mouse(德国美天妮公司Miltenyi Biotec),小鼠IL-10和TGF-β ELISA检测试剂盒购自武汉博士德生物工程有限公司,小鼠PD-1和CTLA-4单克隆抗体购于Beckman Coulter公司,Beckman流式细胞仪,MiniMACS磁性分离仪,德国莱卡冰冻切片机,日本Olympus公司的光学显微镜及病理图像采集系统。
1.2 方法 1.2.1 EAM模型制作及实验分组用Perry改良方法[5]制备豚鼠骨骼肌匀浆,BCA蛋白定量法检测上清液蛋白含量。BALC/c小鼠免疫物为CFA 0.25 ml+等体积的20 μg/μl骨骼肌匀浆(冰浴下充分混合呈乳状),共6次免疫。将上述免疫物分别按皮下注射方法,注射至小鼠背部两侧,免疫剂量0.5 ml/次,1/周,分别于第0、7、14、21、28、35天进行免疫,共6次。所有实验动物均在第1次和第2次免疫注射同时进行百日咳杆菌原液(细菌数目370亿/ml),腹腔注射,0.5 ml/次。
6只EAM小鼠随机分为干预组及未干预组各3只,于第5、6次免疫前,干预组每只小鼠尾静脉注射2×106分离好的CD4+CD25+Foxp3+Treg细胞。
1.2.2 CD4+ CD25+ Foxp3+ Treg细胞分选及检测脱颈处死60只正常雌性BALC/c小鼠,无菌条件下取其脾脏,放入培养皿中,超净工作台内脾脏去筋膜,撕碎脾脏,400目金属网上研磨脾组织,PBS冲洗网和平皿,收集网下细胞悬液,用于CD4+ CD25+ Foxp3+ Treg细胞分选及检测,方法见文献[6]。
1.2.3 ELISA检测外周血清IL-10和TGF-β水平小鼠腹腔麻醉后摘眼球取血,约600~900 μl,2500 r/min离心10 min,吸取血清,-80 ℃保存备用。采用双抗体夹心ELISA法测定两组小鼠血清IL-10和TGF-β含量。
1.2.4 标本处理及染色处死所有动物,逐层剪开小鼠四肢皮肤、皮下组织,分离并剪下下肢近端肌肉,黄芪胶粉包埋,立即用液氮预冷的异戊烷速冻,-80 ℃超低温冰箱保存。-24 ℃冰冻恒温切片机连续切片,切片厚度为10 μm,行HE染色。
1.2.5 统计学分析小鼠脾脏淋巴细胞CD4+CD25+ Foxp3+Treg细胞表面PD-1和CTLA-4的表达以百分率表示其表达量,各项指标以均数±标准差表示,两组间均数比较采用t检验,采用SPSS 16.0软件进行统计学分析,P < 0.05有统计学意义。
2 结果 2.1 细胞回输前后两组病理形态学改变未干预组小鼠(n=3):病理可见:较正常小鼠,出现灶性大量炎性细胞浸润,伴有较多肌纤维变性、坏死、溶解及吞噬现象(图 1A~C)。
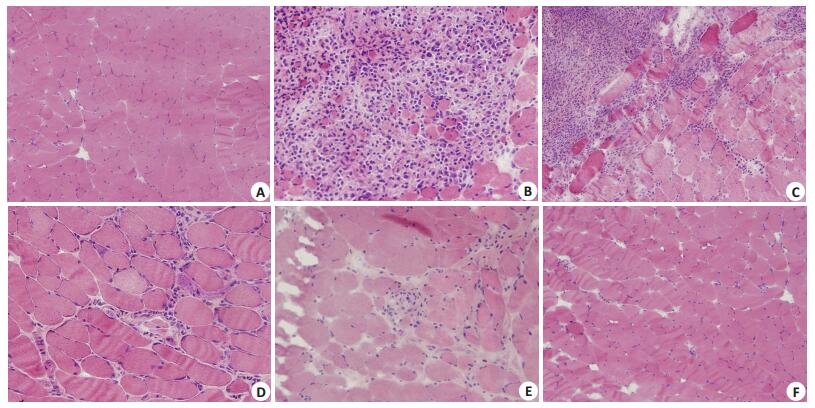
|
图 1 CD4+CD25+ Foxp3+ Treg细胞回输前后两组病理形态学改变 Figure 1 Muscular pathological changes in miceafter CD4+CD25+ Foxp3+ Treg cell reinfusion (HE staining, original magnification: × 200).A: Normal control group showing no inflammatory cell infiltration; B, C: Model group showing obvious focal inflammatory cell infiltration and muscle fiber degeneration, necrosis, dissolution, and phagocytosis; D, E, F: Treatment group showing significantly reduced inflammatory cells and lessened muscle fiber atrophy. |
干预组小鼠(n=33):病理可见:肌纤维大小基本一致,可见少许肌纤维萎缩,炎症反应部位明显局限,仅见少许炎性细胞浸润肌纤维,未见肌溶解现象(图 1D~F)。
2.2 两组脾脏CD4+ CD25+ Foxp3+ Treg细胞表面PD-1和CTLA-4比较(表 1,图 2)| 表 1 两组脾脏CD4+ CD25+ Foxp3+ Treg细胞表面PD-1和CTLA-4比较 Table 1 Comparison of PD-1 and CTLA-4 expressions on spleen CD4+ CD25+ Foxp3+Treg cell surface |
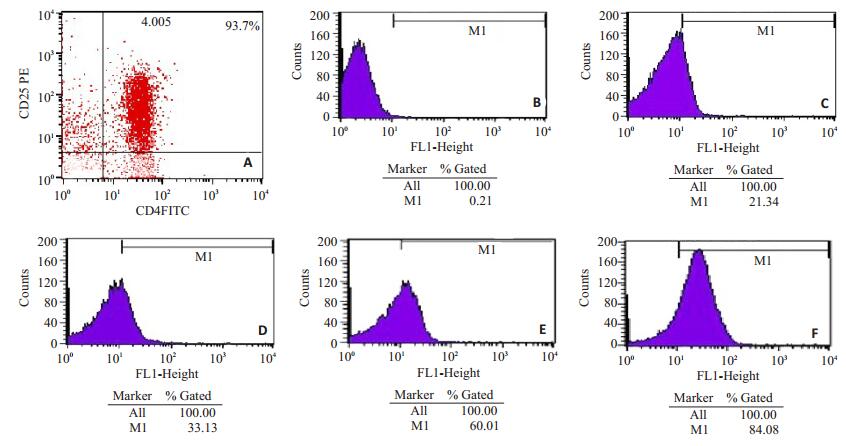
|
图 2 流式细胞仪检测两组脾脏CD4+ CD25+Foxp3+ Treg细胞表面PD-1和CTLA-4 Figure 2 Spleen CD4+ CD25+ Foxp3+ Treg cell surface PD-1 and CTLA-4 expressions detected by flow cytometry. A: Regulatory T cell purity reaching 93.7% after sorting; B: Negative control; C: PD-1 expression on spleen regulatory T cells in model group; E: PD-1 expression on spleen regulatory T cells in treatment group; F: CTLA-4 expression on spleen regulatory T cells in model group; G: CTLA-4 expression on spleen regulatory T cells in treatment group. |
干预组小鼠脾脏CD4+ CD25+ Foxp3+ Treg细胞表面PD-1和CTLA-4的表达均较未干预组明显升高(P < 0.05)。
2.3 两组外周血IL-10和TGF-β水平比较(表 2)干预组小鼠血清IL-10和TGF-β水平均较未干预组明显升高,其中TGF-β水平升高更明显(P < 0.01)。
| 表 2 两组外周血IL-10和TGF-β水平 Table 2 Comparison of IL-10 and TGF-β levels in peripheral blood (ng/L) |
Allenbach等[5]发现将注射Treg细胞可以显著改善多肌炎小鼠模型的病情,上述发现均提示Treg细胞与多发性肌炎免疫调节密切相关,且有可能应用于疾病的临床治疗[7]。对于Treg细胞的作用机制存在许多假说,最常见的两类机制是:(1)细胞接触依赖机制天然Treg细胞通过其表面分子与其它细胞上的相应配体特异结合发挥免疫抑制作用,其中最重要的是CTLA-4、GITR及PD-1;(2)分泌抑制性细胞因子除了通过直接细胞接触来发挥免疫抑制作用外,天然Treg还能分泌抑制性细胞因子来间接发挥免疫抑制作用。最重要的是TGF-β和IL-10。
PD-1是近年来鉴定的一个位于T、B细胞和髓系细胞的抑制性受体,它是免疫球蛋白超家族的一个55 kd的单体型Ⅰ型跨膜糖蛋白,是一个属于CD28/CTLA-4免疫球蛋白家族的免疫性受体[8]。PD-1的两个配体分子PD-L1和PD-L2也相继被发现。PD-L1比PD-L2的表达更为广泛,主要表达于鼠类T细胞、B细胞、树突状细胞、巨噬细胞,间充质干细胞和骨髓来源的肥大细胞,甚至在某些恶性肿瘤细胞系上也有表达。PD-L1在调节自身反应性T,B细胞和免疫耐受方面具有一定的广泛性[9-10]。
研究表明,PD-1/PD-L1信号在免疫应答的负性调控发挥着重要的作用[11-12]。Treg细胞通过下调机体对外来抗原或自身抗原的免疫应答水平来维持自身耐受。而且PD-1/PD-L1途径与Treg细胞关系密切,可以调控淋巴器官中的Treg细胞的发育,维持机体的免疫耐受与稳定,促进组织中的Treg细胞发育,保护组织的免疫损伤,维护和增强炎症微环境中的Treg细胞活性,有效调控Treg细胞的活性。
CD4+CD25+Treg细胞可以通过细胞接触依赖机制和抑制性细胞因子依赖机制主动抑制自身免疫T细胞的活化,维持自身免疫耐受,防止自身免疫病。Takahashi等[13]研究表明CD4+CD25+Treg细胞表面高表达的CTLA-4是参与抑制作用的主要因素之一,使用抗-CTLA-4单抗可以部分地抑制其对效应细胞的抑制活性。CTLA-4能与抗原提呈细胞(APC)表面的CD80和CD86结合,并且这种亲和力高于CD28与CD80和CD86的结合。很可能,APC提呈自身抗原至CD4+ CD25+Treg细胞时,如果通过CTLA-4(而不是CD28)接受信号,CD4+CD25+Treg细胞就可能被赋予了无应答表型和抑制功能。共刺激信号CTLA-4-B7可能参与介导CD4+CD25+Treg细胞对树突状细胞(DC)的调节作用[14]。另外,用同种异体细胞包被抗CTLA-4抗体增加CD4+ CD25+CTLA-4 T细胞数量,能抑制炎症前因子IFN-γ的产生,上调IL-2、IL-10、TGF-β1及IL-4 [15-16]。综上所述,增加EAM小鼠CD4+CD25+Treg细胞的含量,可以有效改善EAM小鼠的炎症状况,为下一步探索CD4+CD25+Treg细胞临床治疗价值奠定了基础。
| [1] | Dwivedi M, Kemp EH, Laddha NC, et al. Regulatory T cells in vitiligo: Implications for pathogenesis and therapeutics[J]. Autoimmun Rev,2015, 14 (1) : 49-56. DOI: 10.1016/j.autrev.2014.10.002. |
| [2] | Toubi E, Kessel A, Mahmudov Z, et al. Increased spontaneous apoptosis of CD4+ CD25+ T cells in patients with active rheumatoid arthritis is reduced by infliximab[J]. Ann N Y Acad Sci,2005, 1051 : 1506-14. |
| [3] | Nadkarni S, Mauri C, Ehrenstein MR. Anti-TNF-alpha therapy induces a distinct regulatory T cell population in patients with rheumatoid arthritis via TGF-beta[J]. J Exp Med,2007, 204 (1) : 33-9. DOI: 10.1084/jem.20061531. |
| [4] | Waschbisch A, Schwab N, Ruck T, et al. FOXP3+ T regulatory cells in idiopathic inflammatory myopathies[J]. J Neuroimmunol,2010, 225 (1/2) : 137-42. |
| [5] | Allenbach Y, Solly S, Grégoire S, et al. Role of regulatory T cells in a new mouse model of experimental autoimmune myositis[J]. Am J Pathol,2009, 174 (3) : 989-98. DOI: 10.2353/ajpath.2009.080422. |
| [6] | 蓝三春, 石蕊, 张晓颖, 等. 人CD4~+CD25~+调节性T细胞体外扩增研究[J]. 中国免疫学杂志,2010 (10) : 913-8. |
| [7] | Boursier G, Siri A, De Boysson H. Use of regulatory T cells in cellular therapies in autoimmune diseases[J]. Med Sci,2012, 28 (8/9) : 757-63. |
| [8] | Ishida Y, Agata Y, Shibahara K, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death[J]. EMBO J,1992, 11 (11) : 3887-95. |
| [9] | Keir ME, Butte MJ, Freeman GJ, et al. PD-1 and its ligands in tolerance and immunity[J]. Annu Rev Immunol,2008, 26 : 677-704. DOI: 10.1146/annurev.immunol.26.021607.090331. |
| [10] | Sharpe AH, Wherry EJ, Ahmed R, et al. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection[J]. Nat Immunol,2007, 8 (3) : 239-45. DOI: 10.1038/ni1443. |
| [11] | Ott PA, Hodi FS, Robert C. CTLA-4 and PD-1/PD-L1 blockade: new immunotherapeutic modalities with durable clinical benefit in melanoma patient[J]. Clin Cancer Res,2013, 19 (19) : 5300-9. DOI: 10.1158/1078-0432.CCR-13-0143. |
| [12] | Saresella M, Rainone V, Al-Daghri NM, et al. The PD-1/PD-L1 pathway in human pathology[J]. Curr Mol Med,2012, 12 (3) : 259-67. DOI: 10.2174/156652412799218903. |
| [13] | Takahashi T, Tagami T, Yamazaki S, et al. Immunologic self-tolerance maintained by CD25(+) CD4(+) regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4[J]. J Exp Med,2000, 192 (2) : 303-10. DOI: 10.1084/jem.192.2.303. |
| [14] | Misra N, Bayry J, Lacroix-Desmazes S, et al. Cutting edge: human CD4+ CD25+ T cells restrain the maturation and antigen-presenting function of dendritic cell[J]. J Immunol,2004, 172 (8) : 4676-80. DOI: 10.4049/jimmunol.172.8.4676. |
| [15] | Whalen JD, Lechman EL, Carlos CA, et al. Adenoviral transfer of the viral IL-10 gene periarticularly to mouse paws suppresses development of collagen-induced arthritis in both injected and uninjected paw[J]. J Immunol,1999, 162 (6) : 3625-32. |
| [15] | 调节性T细胞治疗多发性肌炎的实验研究[D].中国人民解放军军医进修学院. 2012. http://cdmd.cnki.com.cn/Article/CDMD-90030-1012432448.htm |
 2015, Vol. 35
2015, Vol. 35
