2. 广东省心血管研究所//广东省人民医院//广东省医学科学院南方医科大学 广东 广州 510515 ;
3. 广东省心血管研究所//广东省人民医院//广东省医学科学院心脏大血管外科 广东 广州 510100
2. Southern Medical University,Guangdong Provincial Cardiovascular Institute, Guangdong General Hospital, Guangdong Acedamy of Medical Sciences, Guangzhou 510515, China ;
3. Department of Cardiovascular Surgery, Guangdong Provincial Cardiovascular Institute, Guangdong General Hospital, Guangdong Acedamy of Medical Sciences, Guangzhou 510100, China
使用主动脉覆膜支架植入术对Stanford B型夹层、胸主动脉瘤及腹主动脉瘤的适合病例进行治疗被人们广泛接受,逐渐成为一线的治疗方式[1]。由于主动脉覆膜支架输送系统外径较大(16Fr至24Fr),在传统治疗中仍需要血管外科医生切开、暴露并缝合股动脉穿刺部位。近年来,随着器械研发的进步,国内外同行采用多个PercloseTM(Abbott,美国)装置进行进行“预缝合”方法处理穿刺部位,实现了更微创的完全经皮穿刺的主动脉覆膜支架植入介入治疗[2-4]。
一般认为如冠状动脉及其他周围血管经皮穿刺介入感染风险小,无需预防性应用抗生素。但主动脉腔内修复术移植入体积较大、术程往往较长、发生移植物感染预后差,是否应该在术前常规使用抗生素仍少见文献报道。我中心在开展完全经皮穿刺腔内修复术早期,常规于术前予以预防性抗生素,但一些术者认为,不予以术前预防性抗生素亦不增加不良事件。为进一步探讨在导管室进行该介入手术是否需要预防性应用抗生素,进行本前瞻观察性对照研究。
1 对象与方法 1.1 研究对象评价分析了2011年9月~2012年10月在广东省人民医院心内科因Stanford B型夹层择期行胸主动脉腔内修复治疗(TEVAR)的116例患者。排除标准:1、存在自身免疫疾病;2、服药免疫抑制药物;3、术前存在感染;4、行股动脉切开入路进行腔内修复术;5、同时行弓上分流的杂交手术患者;6、假性动脉瘤患者。所有病例在住院期间体温恢复正常48 h以后出院。
1.2 预防性抗生素使用方法预防组术前0.5 h内使用0.9%生理盐水+头孢呋辛1.5 g,术前使用1次,若手术时间 > 2 h加用抗菌药物,术后两组均不再用抗菌药物。是否使用预防性抗生素主要依据不同术者的用药习惯。
1.3 导管室准备所有手术在广东省人民医院心血管病研究所心血管介入导管室进行。按《消毒及隔离制度》,用0.2%过氧乙酸溶液对地面及物品擦拭,2次/d,用紫外线灯消毒2次/d,照射30 min/次,每月作1次空气细菌培养,空气菌落数为(234±10)个/m3。介入科医师手指细菌菌落数为(4±1)CFU/cm2,物品表面细菌菌落数为(5±1)CFU/cm2,介入病房空气菌落数为(78±10)个/m3,术中无菌操作,一次性器械无重复使用,可重复使用的器械按相应标准经过去污、清洁、消毒灭菌程序处理后使用。
1.4 手术方法局麻下穿刺左桡动脉,送入6Fr pigtail导管到升主动脉进行造影,明确主动脉夹层破口或主动脉瘤情况。以标准Seldinger方法穿刺股动脉前壁股动脉分叉以上1 cm左右位置,留00889 cm(0.035英寸)导丝于股动脉内,撤动脉鞘,再顺序释放2套Perclose ProGlideTM血管缝合装置。第1套释放时向股内侧旋转约20°~30°;再经第1套装置放入导丝,第2套释放时向股外侧旋转20°~30°,两套缝线以止血钳固定,均不收紧。送入泥鳅导丝及造影管,分段造影证实导丝及造影管位于主动脉真腔后,更换加硬钢丝后,以14~22 Fr扩张器扩张穿刺口。穿刺股静脉,送入临时起搏器到右心室备用。沿股动脉加硬导丝送入覆膜支架。临时起搏器以180次/分快速起搏下释放主动脉覆膜支架。撤出主动脉覆膜支架输送系统后依次收紧预埋的两把缝合器并适当压迫止血。
1.4 观察与随访研究采用前瞻的观察对照研究,按研究方案术前及术后进行血尿粪常规、C-反应蛋白(CRP)、血沉(ESR)、降钙素原(PCT)检查。每日重复测量体温4次,研究记录每日最高体温。所有病例术后体温 > 37.5 ℃时予以3次不同时间不同采血点标本的血培养。
1.5 感染及腔内修复术后综合症诊断由2位高级专业技术职务任职资格的医师对患者是否感染进行诊断,参考2001年中华人民共和国卫生部2001年颁布的《医院感染诊断标准》评定。腔内修复术后综合征的诊断标准主要为:排除感染的术后体温 > 37.5 ℃。
1.6 统计方法对所有计量资料采用均数±标准差表示,组间比较使用独立样本的t检验。计数资料之间比较使用χ2检验,若出现理论频数 < 5,使用Fisher精确检验计数统计值。对于术前及术后不同时间点的体温、ESR、CRP的比较使用重复检验方差分析进行,对不符合球形检验时采用Greenhouse-Geisser进行ε校正。
2 结果在116例患者中,11例为同时进行弓上分流+主动脉腔内修复术的“杂交手术”患者,4例因术前存在自身免疫性疾病长期口服免疫抑制剂,6例术前存在感染均予以排除,最后入组95例。非预防组:无术前预防性应用抗生素60例,预防组:术前应用抗生素35例。两组间患者年龄、性别、吸烟、饮酒、合并高血压、冠心病、糖尿病、术前体温、肝肾功能、血象等基线资料无显著差异(P > 0.05,表 1)。研究中手术时间为78.41±13.14 min。
| 表 1 基线资料 Table 1 Demographic and clinical data of the patients |
在观察的病例中,共有4例诊断感染患者(表 2),其中非预防组3例,预防组1例,两组对比的Fisher精确检验无显著性差异(5% vs 2.86%,P=1.000)。疑似移植物感染病例1例,患者术后反复高热,进行不同时间点,不同采血部位的血培养中培养出一致的致病菌表皮葡萄球菌,但术后2次复查的CTA的感染征象表现不典型(图 1),在使用了16 d的亚胺培南西司他丁钠(泰能)后痊愈出院。在术后6月随访中,无反复发热、消瘦、倦怠等慢性感染表现患者。
| 表 2 腔内修复术后确诊感染患者具体表现 Table 2 Clinical presentation of patients who was definite diagnosis of post-endovascular repair infection |
|
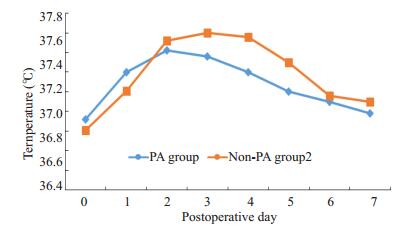
图 1 术前及术后体温变化 Figure 1 Comparison of the mean body temperature in the first 7 postoperative days in PA group and non-PA group. |
观察病例的在院及随访过程中,非预防组发生1例感染相关死亡,预防组发生1例因夹层逆撕进展为Stanford A型夹层破裂死亡,两组总死亡率(1.67% vs 2.85%, P=1.00)及感染相关死亡率(1.67% vs 0%, P=1.00)均无显著性差异。两组间术后腔内修复术后综合征发生率无显著性差异(70.90% vs 91.43%,P=0.20,表 1)。对两组患者在术后不同时间点体温进行重复测量的方差分析,Mauchly球形检验Wald=0.070,P < 0.001。使用Greenhouse-Geisser进行ε自由度校正后,统计时间因素效应有统计意义(F=19.831,P < 0.001),有无使用预防性抗生素组间效应无统计意义(F=0.978,P=0.326),时间*预防性抗生素交互效应无统计意义(F=1.431,P=0.231)。使用及不使用抗生素体温变化见图 1:两组间住院天数无显著性差异(9.30±7.21 vs 10.06±5.69,P=0.094)。
比较术前术后以及是否使用预防性抗生素的C-反应蛋白、血沉、降钙素原值,使用重复检验的方差分析,不同时间点比较CRP、ESR及PCT有统计学意义,统计值分别为:CRP:(F=12.240,P < 0.001);ESR:(F=14.439,P < 0.001);PCT(F=11.379,P=0.001);是否使用抗生素组间效应无统计学意义,统计值分别为:CRP(F=0.085,P=0.772);ESR:(F=0.318,P=0.576);PCT:(F=0.004,P=0.951)。故行腔内修复术后患者CRP、ESR及PCT均有显著升高,是否使用预防性抗生素无明显差异。
3 讨论 3.1 预防性抗生素与术后感染综合过去的回顾性研究,一般认为普通病例的血管造影、冠状动脉介入、射频消融等介入手术无需预防性应用抗生素[5]。一些血管介入医生在进行介入手术前常规使用预防性抗生素,但仍然缺乏相关研究结果支持该做法[6]。对于主动脉覆膜支架植入术是否应该予以预防性抗生素目前仍少见文献报道。
对于血管介入手术是否需要预防性应用抗生素这一问题被提出20年来,仍缺乏足够的随机对照临床研究作出可靠结论[5],目前主要依据仍参考外科清洁手术的推荐。一般认为:如果1个手术未进入胃肠道、呼吸道、胆道,无菌技术保持得好,这个手术就是无菌手术, 在这种环境下感染的风险率低5%,因此此类手术一般不需要预防性应用抗生素。有观点认为[7],如果洁净手术进行移植物植入,若出现感染会导致严重并发症的情况下,应考虑预防性应用抗生素。
我国卫生与计划生育委员会颁发《关于抗菌药物临床应用管理有关问题的通知》(2009)要求以严格控制Ⅰ类切口手术预防用药为重点,一类切口一般不使用预防性抗生素。而《抗菌药物临床应用指导原则》(2004年)指出:以下情况下时可考虑预防用药:(1)手术范围大、时间长、污染机会增加;(2)手术涉及重要脏器,一旦发生感染将造成严重后果者,如头颅手术、心脏手术、眼内手术等;(3)异物植入手术,如人工心瓣膜植入、永久性心脏起博器放置、人工关节置换等;(4)高龄或免疫缺陷者等高危人群。《指导原则》中未涉及主动脉介入治疗的推荐。
一项对涵盖了超过15000个血管支架植入(包括主动脉覆膜支架、肾动脉、冠脉等血管支架)的国际调查研究[8]认为,支架植入感染的发生率约0.4%。最常见分离出来的病菌是金黄色葡萄球菌,占感染病例的27%。影响术后感染的因素包括:动脉炎、假性动脉瘤、短时间内再次手术、免疫抑制、通过植入超过24 h的血管鞘等因素,在这些高危患者中预防性应用抗生素是合理的[5]。
在我们研究的病例中,总感染发生率为4.21%,其中确诊介入手术直接相关的感染为穿刺口感染1例,发生率为1.05%。有1例疑似移植物感染,但缺乏影像学支持。组间对比感染发生率无显著性差异,与既往王江云等[9]关于一般血管介入使用预防性抗生素研究结果一致。
我们研究还发现:非预防组发生的感染事件预后相对更差,该组发生的2例感染,其中1例为肺部感染,培养出恶臭假单胞细菌,最后因败血症、多脏器衰竭在住院期间死亡。另外1例疑似移植物感染的病例亦发生在该组,长时间大剂量高强度使用抗生素后痊愈出院。相对而言,预防性使用抗生素组发生的感染并发症更轻,仅1例患者出现了术后感染,该患者穿刺口感染通过加强伤口清洁和静脉使用抗生素痊愈出院。一些学者考虑到主动脉覆膜支架植入有较高的再次介入率并且一旦发生移植物感染将导致很高的死亡率,推荐在术前使用一次预防性抗生素(1g Ⅳ头孢唑林)[10]。如果出现主动脉覆膜支架的移植物感染,使用抗生素效果不理想,往往需要外科手术移除血管内移植物,治疗死亡率极高[11]。本研究发现使用预防性抗生素并不能减少感染的发生率,但是没有使用预防性抗生素的患者发生的感染可能更严重,预后更差。主动脉覆膜支架植入术的患者应考虑预防性使用抗生素,但由于术后感染发生率相对较低,研究结论仍需进一步的大规模临床研究证实[12]。
3.2 预防性抗生素与腔内修复术后综合征主动脉腔内修复术后部分患者出现白细胞升高、发热、血小板减少等全身系统性炎症表现, 目前被定义为腔内修复术后综合征(Post-implantation syndrome)[13]。发生机制尚未明确,可能与暂时菌血症、移植物的材料、手术操作技术、急性血栓形成及内皮损伤等方面有关[14, 15]。腔内修复术后综合征有很高的发生率[16]。在我们观察的病例中,在无预防性抗生素组及预防性抗生素组术后发热发生率分别为:70.90% vs 91.43%(P=0.20)。无论术后发热的发热程度、发热持续时间还是CRP、ESR、PCT这些炎症因子与是否使用预防性抗生素无显著性差异,而与覆膜支架植入术前及术后不同时间点有关。预防性应用抗生素可能不能预防腔内修复术后综合征的发生。
对于哪些术后发热的患者需要应用抗生素尚无明确标准。早期有资料表明[17],超过90%腔内修复术后综合征患者抗生素使用为经验性用药。最近一项研究对所以EVAR术后发热的患者进行血培养发现所有结果都为阴性,因而认为对于该类发热患者进行血培养是不必要的[18]。由于本对照研究中,诊疗认识受限于当时水平,在早期病例出现发热经验性使用抗生素往往更加积极。所以在观察病例中,预防组术后使用抗生素比率更高(52.9% vs 5.26%,P < 0.001),但无论术后死亡率、感染相关死亡率还是术后发热天数、住院天数都无显著性差异。我中心近期研究研究发现降钙素原可作为EVAR术后发热患者鉴别感染的一项可靠指标[19]。
研究的局限性在于:由于血培养的阳性率的不足,对于是否感染的判断尚乏理想的诊断金标准,是在目前感染标志物诊断评价、感染临床评价以及治疗评价等研究中为普遍面临的难题[20-21],因而可能存在偏倚。由于主动脉夹层疾病发病率以及腔内修复术后感染发生率较低,研究结果的统计把握度受限。为保证研究的可靠性,课题组进行了前瞻的观察对照,并按研究方案严格执行炎症指标以及影像学治疗的复查,并采用了降钙素原这一相对敏感性特异性更好的感染判断指标。感染的判断并由两名卫生副高级以上医师依照相关指南进行感染的判定,从而尽量减少了偏倚的发生。因而研究结论尚需进一步大规模临床研究证实。
本随机对照研究认为:目前资料不能证明在导管室条件下行完全穿刺腔内修复术,预防性应用抗菌药物对减少术后感染、腔内修复术后综合征发生有获益,但无预防性使用抗生素组一旦发生感染,预后相对更差。由于为观察性对照研究,并且病例数有限,研究结论有待进一步前瞻大样本随机对照研究证实。
| [1] | Grabenwöger M, Alfonso F, Bachet J, et al. Thoracic endovascular aortic repair (TEVAR) for the treatment of aortic diseases: a position statement from the European association for Cardio-Thoracic surgery (EACTS) and the European society of cardiology (ESC), in collaboration with the European association of percutaneous cardiovascular interventions (EAPCI)[J]. Eur Heart J,2012, 33 (13) : 1558-63. DOI: 10.1093/eurheartj/ehs074. |
| [2] | Marchant D, Schwartz R, Chepurko L, et al. Access site management after aortic valvuloplasty using a suture mediated closure device: clinical experience in 4 cases[J]. J Invasive Cardiol,2000, 12 (9) : 474-7. |
| [3] | 罗建方, 黄文晖, 刘媛, 等. 血管缝合器在经皮行主动脉腔内修复术应用中的早期经验[J]. 中国介入心脏病学杂志,2010, 18 (3) : 135-7. |
| [4] | Ni ZH, Luo JF, Huang WH, et al. Totally percutaneous thoracic endovascular aortic repair with the preclosing technique: a case-control study[J]. Chin Med J (Engl),2011, 124 (6) : 851-5. |
| [5] | Beddy P, Ryan JM. Antibiotic prophylaxis in interventional radiology--anything new[J]. Tech Vasc Interv Radiol,2006, 9 (2) : 69-76. DOI: 10.1053/j.tvir.2006.12.005. |
| [6] | Moon E, Tam MD, Kikano RN, et al. Prophylactic antibiotic guidelines in modern interventional radiology practice[J]. Semin Intervent Radiol,2010, 27 (4) : 327-37. DOI: 10.1055/s-0030-1267853. |
| [7] | O'grady NP, Alexander M, Burns LA, et al. Guidelines for the prevention of intravascular catheter-related infections[J]. Clin Infect Dis,2011, 52 (9) : e162-93. DOI: 10.1093/cid/cir257. |
| [8] | Fiorani P, Speziale F, Calisti A, et al. Endovascular graft infection: preliminary results of an international enquiry[J]. J Endovasc Ther,2003, 10 (5) : 919-27. DOI: 10.1177/152660280301000512. |
| [9] | 王江云, 李彦豪, 汪能平, 等. 血管内介入治疗围手术期抗菌药物应用的前瞻性研究[J]. 中华医院感染学杂志,2010, 20 (17) : 2659-61. |
| [10] | Sharif MA, Lee B, Lau LL, et al. Prosthetic stent graft infection after endovascular abdominal aortic aneurysm repair[J]. J Vasc Surg,2007, 46 (3) : 442-8. DOI: 10.1016/j.jvs.2007.05.027. |
| [11] | Fatima J, Duncan AA, De Grandis E, et al. Treatment strategies and outcomes in patients with infected aortic endografts[J]. J Vasc Surg,2013, 58 (2) : 371-9. DOI: 10.1016/j.jvs.2013.01.047. |
| [12] | Moulakakis KG, Mylonas SN, Antonopoulos CN, et al. Comparison of treatment strategies for thoracic endograft infection[J]. J Vasc Surg,2014, 60 (4) : 1061-71. DOI: 10.1016/j.jvs.2014.07.012. |
| [13] | Velázquez OC, Carpenter JP, Baum RA, et al. Perigraft air, fever, and leukocytosis after endovascular repair of abdominal aortic aneurysm[J]. Am J Surg,1999, 178 (3) : 185-9. DOI: 10.1016/S0002-9610(99)00144-0. |
| [14] | Akowuah E, Wilde P, Angelini G, et al. Systemic inflammatory response after endoluminal stenting of the descending thoracic aorta[J]. Interact Cardiovasc Thorac Surg,2007, 6 (6) : 741-3. DOI: 10.1510/icvts.2007.157339. |
| [15] | Arnaoutoglou E, Kouvelos G, Milionis H, et al. Post-implantation syndrome following endovascular abdominal aortic aneurysm repair: preliminary data[J]. Interact Cardiovasc Thorac Surg,2011, 12 (4) : 609-14. DOI: 10.1510/icvts.2010.256784. |
| [16] | De La Motte L, Vogt K, Panduro Jensen L, et al. Incidence of systemic inflammatory response syndrome after endovascular aortic repai[J]. J Cardiovasc Surg (Torino),2011, 52 (1) : 73-9. |
| [17] | Eliason JL, Guzman RJ, Passman MA, et al. Infected endovascular graft secondary to coil embolization of endoleak: a demonstration of the importance of operative sterility[J]. Ann Vasc Surg,2002, 16 (5) : 562-5. DOI: 10.1007/s10016-001-0275-5. |
| [18] | Corfield L, Chan J, Chance T, et al. Early pyrexia after endovascular aneurysm repair: are cultures needed[J]. Ann R Coll Surg Engl,2011, 93 (2) : 111-3. DOI: 10.1308/003588411X12851639107719. |
| [19] | Xue L, Luo S, Luo J, et al. Procalcitonin could be a reliable marker in differential diagnosis of post-implantation syndrome and infection after percutaneous endovascular aortic repair[J]. Chin Med J (Engl),2014, 127 (14) : 2578-82. |
| [20] | Schuetz P, Albrich W, Christ-Crain M, et al. Procalcitonin for guidance of antibiotic therapy[J]. Expert Rev Anti Infect Ther,2010, 8 (5) : 575-87. DOI: 10.1586/eri.10.25. |
| [21] | 经皮主动脉覆膜支架植入术后炎症指标研究[D].南方医科大学. 2013. http://cdmd.cnki.com.cn/Article/CDMD-90023-1014100033.htm |
 2015, Vol. 35
2015, Vol. 35
