先天性角化不良(dyskeratosis congenita, DC)的发病率约为1/1, 00万。典型的DC患者约80%~90%具有皮肤黏膜异常三联征, 表现为皮肤网状色素沉着、指(趾)甲萎缩、口腔黏膜白斑[1]。皮肤网状色素沉着及指(趾)甲萎缩常常在儿童时期就已出现, 而口腔黏膜白斑常于20岁左右出现。其他临床表现包括非皮肤黏膜异常, 如骨髓衰竭、肺纤维化、肿瘤易感性等, 可先于皮肤黏膜异常出现, 导致非典型临床表现的患者的早期诊断更为困难。DC患者最主要的死亡原因为骨髓衰竭(60%~70%), 肺部并发症(10%~15%), 和恶性肿瘤(10%)[2]。目前文献报道, 可引起DC的突变基因主要有CTC1, DKC1, TERC, TERT, TINF2, NHP2, NOP10及WRAP53。其中, DKC1基因突变最为常见, 占突变基因的17%~36%[3]。其为X连锁隐性遗传的主要基因。此基因编码角化不良蛋白, 定位于染色体Xq28[4], 与细胞周期及核仁功能相关。目前国内文献报道的病例绝大多数为30岁左右皮肤受累的临床病例, 病例数较少, 且较少进行基因检测, 本文通过对我院1例以血小板减少为初发表现的DC患者的临床特征和基因特点进行分析, 以期提高临床医师对于该病的认识, 有助于早期诊断, 减少误诊、漏诊率。
1 病例及方法 1.1 临床资料患儿男, 8岁, 因"发现皮肤出血点4年, 指(趾)甲萎缩3年, 发热3 d"于2013年12月18日入我院。患儿家属于2009年9月发现患儿双下肢皮肤出血点, 遂至当地医院查血常规提示"血小板减少", 当地医院予"强的松口服治疗, 疗程约1周。其后未定期随诊。2010年患儿家属发现患儿十指(趾)甲变形、萎缩, 未予重视。该年6月, 患儿进食后出现嘴唇、牙龈出血, 至当地医院就诊, 行骨髓穿刺术示"特发性血小板减少性紫癜", 予口服"强的松"治疗, 疗程半年。监测血小板维持在70~80 g/L。2012年7月患儿家属携患儿至广州某大型教学医院就诊, 行胸骨穿刺术提示"血小板减少性紫癜骨髓象"。先后予"强的松"、"硫唑嘌呤"口服治疗, 仍有反复血小板低下。2013年7月在广西某大型教学医院行骨髓穿刺活检提示"再生障碍性贫血", 予"环孢素"口服治疗, 但血小板上升不明显。查体:体型消瘦, 营养不良, 全身皮肤可见网状褐色色素沉着(图 1)。口腔双侧颊粘膜及舌体表面可见白斑(图 2)。十指(趾)甲远端萎缩、发黄及纵脊改变(图 3、4)。双肺呼吸音粗, 未闻及明显干湿性啰音。心音有力, 律齐, 各瓣膜听诊区未闻及病理性杂音。腹平软, 肝脾肋下未及, 肠鸣音正常。肛门及生殖器周围未见明显白斑。家族史:其母亲左手食指指甲变形, 有纵嵴, 趾甲变形, 10余岁时出现后背部皮肤色素沉着, 20余岁时出现左上肢皮肤色素脱失斑。其二舅因直肠癌于31岁去世, 伴有皮肤色素沉着、指甲变形。其三舅因舌癌于20岁去世。其四舅于13岁时不明原因去世, 伴有皮肤瘀斑及出血点。
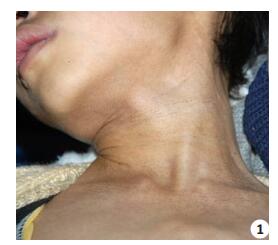
|
图 1 患儿颈胸部皮肤网状色素沉 Figure 1 Reticular pigmentation on the neck and chest. |
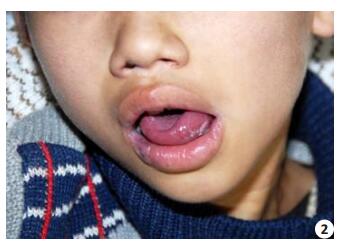
|
图 2 患儿口腔及舌体黏膜白斑 Figure 2 Oral leukoplakia. |
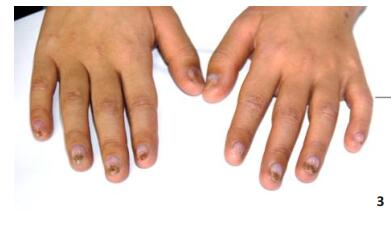
|
图 3 患儿指甲萎缩、变形 Figure 3 Atrophy and deformation of the finger nails. |
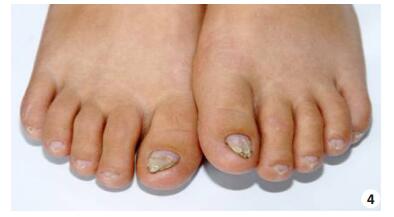
|
图 4 患儿趾甲萎缩、变形 Figure 4 Atrophy and deformation of the toe nails. |
根据患儿临床表现及辅助检查, 临床初步怀疑为DC。分别抽取患儿及其母亲、弟弟的外周静脉血各2 ml行相关基因突变热点的检测, 提取白细胞中的基因组DNA, 利用PCR方法扩增检测患儿DKCl基因外显子序列。基因序列来源于基因库中的参考序列。DKC1引物序列见表 1。
| 表 1 DKC1基因扩增外显子的PCR引物 Table 1 PCR primer sets for amplifying exons of DKC1 |
经过基因测序, 检测到患儿DKC1基因的c.85-15位点半合子变异:c.85-15T>C, 为国内首次报道。c.85-15位点处于第3号外显子与2号内含子之间, 碱基由T转变为C (图 5)。其母亲为该变异的杂合携带者。受检者弟弟c.85-15位点未见异常。TERT、TERC、TINF2、NOP10、NHP2、WRAP53均未检测出相应突变基因。
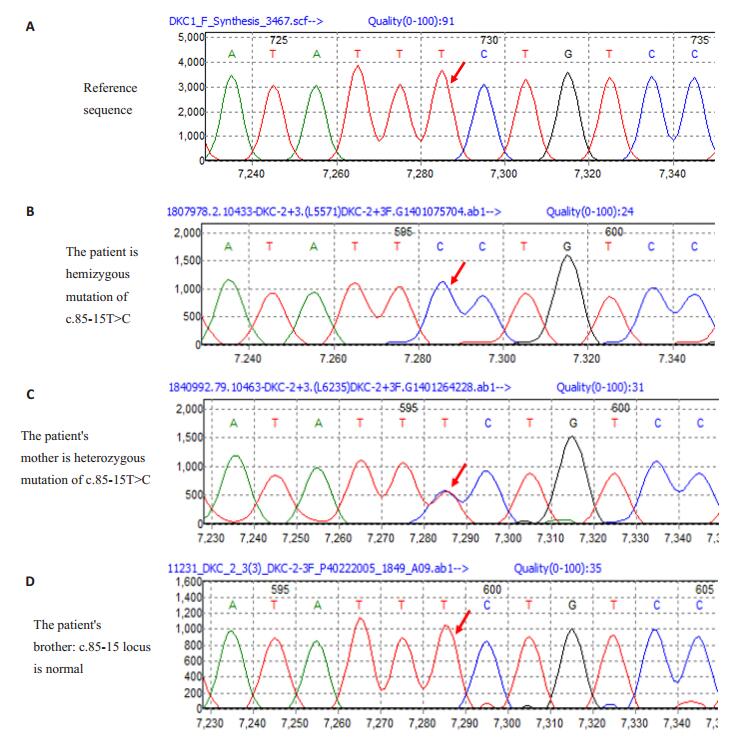
|
图 5 患儿、患儿母亲及患儿弟弟DKCl测序图,箭头指示突变碱基 Figure 5 DKC1 sequence diagrams of the patient and his family members.The arrow indicates the mutated base.A:DKC1 reference sequence; B:The patient's DKC1 sequence; C:His mother's DKC1 sequence; D:His brother's DKC1 sequence. |
先天性角化不良是一种少见的具有临床特征和遗传异质性的遗传综合征, 是由编码角化不良蛋白基因、编码端粒酶的RNA组分基因、编码端粒酶的逆转录酶基因及其他未确认的致病基因突变引起的基因疾病[5]。该病的中位发病年龄是10岁, 大部分患者以皮肤网状色素沉着、口腔黏膜白斑、指(趾)甲变形、萎缩为初发症状。
DC临床表现主要为三联征:皮肤网状色素沉着、口腔黏膜白斑、指(趾)甲变形、萎缩。最具诊断意义的特征是皮肤斑点状或网格状的色素沉着或色素减退。暴露于日光的区域, 包括躯干上部、颈部、颜面部, 是最容易受到影响的区域。其次, 大约80%的患者表现为黏膜白斑, 是DC的特征之一, 主要在口腔黏膜、舌头、口咽部等处发生。白斑发生的地方是癌变的高发区, 需要定期监测[6]。此外, 大约90%的患者都有指(趾)甲的变形、萎缩, 多数患者指甲较趾甲容易受累。指(趾)甲萎缩首先表现为指(趾)甲纵嵴并逐步发展至变小, 甚至缺如。其他临床表现包括, 外胚层的异常如头发、眉毛、睫毛的脱失, 未成熟的灰色头发, 大汗, 手掌及足底的过度角化, 皮纹病(手指及脚趾脱失皮嵴)。并发严重的骨髓衰竭、骨髓增生异常综合征、急性髓系白血病或实体肿瘤等, 都是预后不良的因素。骨髓衰竭是死亡的主要原因之一, 大约70%患者的死亡与出血及机会性感染有关。约80%患者存在肺部并发症, 包括肺纤维化及肺脉管系统的异常[7]。DC患者肿瘤易感性增高, 病人拥有更高的恶性黏膜肿瘤的患病率, 最常见的肿瘤为头颈部鳞状细胞癌, 其次为皮肤及肛门直肠肿瘤, 常发生在黏膜白斑处[8]。其他报道的恶性肿瘤包括霍奇金淋巴瘤, 胃肠道腺瘤, 支气管癌, 喉癌等。恶性肿瘤多于30余岁时发生[9]。此外, 骨骼系统、消化系统、泌尿生殖系统也可受累, 如骨质疏松、泌尿生殖器畸形等。本例患儿无上述系统受累表现。女性DC携带者也会有轻微的临床症状。
目前有八个基因证实可导致DC, 分别为CTC1, DKC1, TERC, TERT, TINF2, WRAP53, NHP2及NOP10。本例患儿已行除CTC1基因以外的全部基因的检测。文献报道, 这些基因有3种遗传方式, 分别为X-连锁隐性遗传、常染色体隐性遗传、常染色体显性遗传[10]。但目前仍约50%患者遗传特征不明确。X-连锁隐性遗传包括DKC1, 常染色体显性遗传包括TERC及TINF2, 常染色体隐性遗传包括CTC1, WRAP53, NHP2, NOP10, 既可以作为常染色体显性遗传又可以作为隐性遗传的有TERT。约30%的DC患者是由于DKC1基因突变所致。DKCl主要编码蛋白角化不良素, 是端粒酶发挥活性的重要成分之一[11]。研究证实DKCl突变能引起端粒酶RNA水平减低及端粒长度明显缩短[12]。DKC1基因为X连锁隐性遗传, 典型患者均为男性, 但是少数女性携带者由于带有致病性等位基因的X染色体而部分出现皮肤黏膜改变、指(趾)甲异常等。本例患儿所检测到的DKC1基因c.85-15T>C半合子变异为国内首次报道, 即患儿第3号外显子与2号内含子之间出现T到C的转变。本例患儿有家族肿瘤史及不明原因死亡史, 其母亲出现皮肤色素沉着及指甲变形, 据此推测患儿可能为DC患者, 进而对患儿进行基因检测, 最终发现变异位点, 确定X连锁先天性角化不良的诊断。
对于DC的治疗尚无理想方案。对于有骨髓衰竭的患者, 异基因造血干细胞移植可能为唯一治愈手段, 但存在风险, 包括移植失败、移植物抗宿主反应、败血症、肺部纤维化、肝硬化、静脉闭塞等[13]。最近, 经过改良的非清髓性的以氟达拉滨为基础的治疗方案在一些患者中成功地移植物植入, 这方案并发症较少, 毒性较低[14]。
DC为先天性骨髓衰竭综合征的其中一种疾病, 以皮肤黏膜异常三联征为主要临床表现, 常伴有骨髓衰竭, 肿瘤易感性增高。临床表现及基因型的检测可确诊该病。目前尚无DC的理想治疗方案, 异基因造血干细胞移植可能为目前治愈骨髓衰竭的唯一手段, 但移植并不能改变患者其它系统的症状及成年后易患恶性疾病的倾向。其他治疗方法还待进一步研究。
| [1] | 纪健, 苏雁. 先天性角化不良1例报告[J]. 临床儿科杂志,2013, 31 (12) : 1175-6. |
| [2] | Nishio N, Seiji kojima. recent progress in dyskeratosis congenita[J]. Int J Hematol,2010, 92 (3) : 419-24. DOI: 10.1007/s12185-010-0695-5. |
| [3] | Pagon RA, Adam MP, Ardinger HH. GeneReviews®[M]. Seattle (WA): University of Washington, Seattle, : 1993 -2015. |
| [4] | 刘香, 李喜英, 邓伟平, 等. 中国一先天性角化不良家系患者端粒长度测量[J]. 国际遗传学杂志,2012, 35 (3) : 157-60. |
| [5] | 刘嵘, 师晓东, 王天有, 等. 二例先天性角化不良症患儿的临床特征和基因分析[J]. 中华血液学杂志,2011, 32 (10) : 684-7. |
| [6] | 马寒, 陆春, 朱国兴, 等. 先天性角化不良伴舌癌一例[J]. 中华医学遗传学杂志,2007, 24 (4) : 452. |
| [7] | 李建国, 李岩, 林志淼, 等. 先天性角化不良一例临床和遗传学特点[J]. 中华儿科杂志,2009, 47 (11) : 867-70. |
| [8] | Alter BP, Giri N, Savage SA, et al. Cancer in dyskeratosis congenita[J]. Blood,2009, 113 (26) : 6549-57. DOI: 10.1182/blood-2008-12-192880. |
| [9] | Walne AJ, Dokal I. Advances in the understanding of dyskeratosis congenita[J]. Br J Haematol,2009, 145 (2) : 164-72. DOI: 10.1111/bjh.2009.145.issue-2. |
| [10] | Kirwan M, Dokal I. Dyskeratosis congenita, stem cells and telomeres[J]. Biochim Biophys Acta,2009, 1792 (4) : 371-9. DOI: 10.1016/j.bbadis.2009.01.010. |
| [11] | 乌云. 基因检测确诊1例先天性角化不良[J]. 中国麻风皮肤病杂志,2013, 29 (2) : 99-100. |
| [12] | 张莉, 张凤奎. 先天性骨髓衰竭[J]. 国际输血及血液学杂志,2009, 32 (4) : 293-9. |
| [13] | Shahinaz MG, Sales-Bonfim C, Carreras J, et al. Outcomes of allogeneic hematopoietic cell transplantation in patients with dyskeratosis congenita[J]. Biol Blood Marrow Transplant,2013, 19 (8) : 1238-43. DOI: 10.1016/j.bbmt.2013.05.021. |
| [14] | Coliţă A, Tanase A, Varady Z, et al. Fludarabine, low-dose cyclophosphamide and rabbit antithymocyte globulin allowed stable engraftment after allogeneic peripheral blood stem cell transplantation for poly-transfused dyskeratosis congenita patient: case report[J]. Transplant Proc,2013, 45 (7) : 2849-53. DOI: 10.1016/j.transproceed.2013.02.137. |
 2015, Vol. 35
2015, Vol. 35
