随着糖尿病发病率的逐年上升, 其并发症糖尿病心肌病也日益受到重视。糖尿病心肌病是一种独立于高血压、冠心病的特异性心肌病, 其机制可能涉及代谢紊乱、心肌纤维化、氧化应激、心肌凋亡等, 其具体机制仍不清楚[1]。有研究表明其心肌纤维化的发生发展与基质金属蛋白酶(MMPs)的活性异常密切相关[2]。
硫化氢(H2S)是继NO、CO之后的第三类气体信号分子, 已发现其参与一系列的生理机制的调控, 并具有一定的心脏保护作用[3]。同时有研究表明H2S具有抗纤维化作用[4], 但在糖尿病心肌纤维化中的作用并不是十分清楚。MAPK1/3是一种丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)家族中的多通路的功能蛋白, 有研究显示其在心肌纤维化的发生发展中具有重要作用。有报道显示MMPS表达和活性异常与MAPK通路的激活有关[5]。同时也有学者发现H2S能抑制MAPK的表达[6]。本研究拟通过观察糖尿病大鼠心肌中MMP-8和MAPK1/3蛋白表达的变化, 探讨H2S对糖尿病心肌纤维化以及MMP-8和MAPK1/3表达蛋白表达的影响。
1 材料与方法 1.1 实验动物36周成年雄性SD大鼠40只, 体质量300±30 g, 购自南华大学动物实验中心; 动物饲养在恒温恒湿环境中, 黑夜白天各12 h; 实验动物可以自由获得水和食物。
1.2 主要实验试剂硫氢化钠(H2S供体)购于美国Sigma公司; 兔源Collagen I、MMP-8和MAPK1/3一抗购于中国博士德公司; 抗兔二抗购于美国Proteintech公司; BCA蛋白定量试剂盒、细胞裂解液购于碧云天公司。
1.3 实验分组及糖尿病模型建立40只SD大鼠随机分为4组(每组10只):正常对照组; 糖尿病大鼠组(STZ组); 硫化氢干预糖尿病大鼠组(STZ+H2S组); 硫化氢干预正常大鼠组(H2S组)。STZ组与STZ+H2S组大鼠按体质量(40 mg/kg)腹腔注射STZ; 注射后的24 h, 为防止大鼠发生低血糖休克, 给予5%葡萄糖水腹腔注射; 注射后72 h, 尾静脉采血测血糖, 血糖大于16.7 mmol/L提示造模成功(成功率大约为70%)。造模成功后, STZ+H2S组与H2S组每天腹腔注射硫氢化钠溶液(100 μmol/kg); 对照组和糖尿病大鼠组每天腹腔注射等剂量生理盐水; 实验持续8周。
1.3 HE染色观察心肌纤维病理形态学变化取心肌组织, 100 g/L多聚甲醛固定后, 常规石蜡包埋、切片后, 以HE染色法染色, 显微镜下观察摄像。
1.4 Western Blot检测Collagen I、MMP-8和MAPK1/3蛋白的表达取各组新鲜大鼠左室心肌组织, 提取蛋白, 采用BCA比色法进行蛋白定量; 配置10% SDS-PAGE分离胶电泳分离蛋白, 蛋白样品在100℃煮沸5 min, 每孔20 μl细胞蛋白样品上样, 置于电泳缓冲液中电泳, 分离目的蛋白, 将目的条带切下, 10 V半干式电转膜30 min, 将蛋白质转移至PVDF膜。用TBST配制的5% BSA封闭2 h, 封闭后以Collagen I、MMP-8和MAPK1/3以及GAPDH一抗(稀释度为1:500)37℃孵育1 h后4℃过夜; TBST洗膜后, 用HRP标记的羊抗兔二抗(稀释度为1:2000)37℃孵育1 h, TBST洗膜, ECL显色, 曝光后扫描, 用Image J图像分析软件进行光密度分析。以GAPDH为内参。
1.5 统计学分析采用SPSS 18.0软件对数据进行分析, 计量资料用均数±标准差表示, 各组间比较用单因素方差分析法, 以P < 0.05为差异有统计学意义。
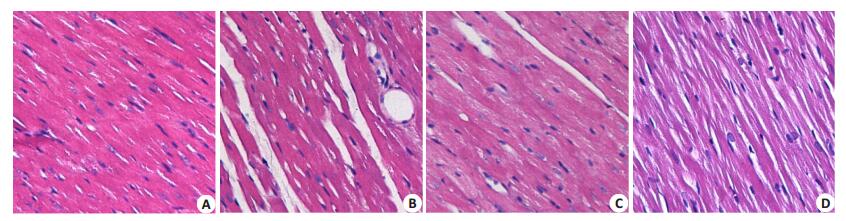
2 结果 2.1 各组大鼠心肌超微结构比较光镜下可见STZ组与对照组相比心肌纤维排列明显紊乱, 心肌细胞间隙增宽, 间质可见纤维化; 而STZ+ H2S组与STZ组相比心肌纤维排列明显改善, 大部分心肌纤维呈平行排列, 结构清晰, 间质有少量疏松结缔组织。H2S组大鼠心肌组织结构和纤维排列与对照组类似(图 1)。
|
图 1 各组心肌组织HE染色 Figure 1 HE staining of myocardial tissue in the 4 groups (Original magnification:×200).A:Control; B:STZ group; C:STZ+H2S group; D:H2S group. |
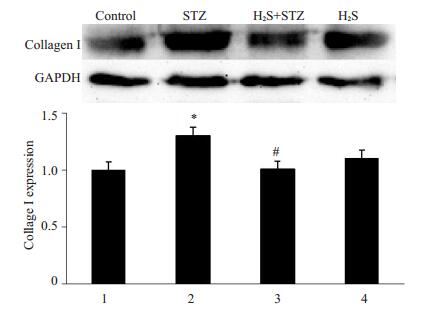
Western blot法检测各组蛋白Collagen I表达水平, 结果(图 2)发现:与对照组相比, STZ组大鼠心肌组织中Collagen I蛋白表达明显升高(P < 0.05);与STZ组相比, STZ+H2S组大鼠心肌Collagen I蛋白表达减少(P < 0.05);H2S组与对照组比较无明显差异。结果提示硫化氢干预抑制了糖尿病大鼠心肌组织Collagen I的表达上调。
|
图 2 Collagen I的表达 Figure 2 Expression of collagen I in the rat myocardium.*P < 0.05 vs Control; #P < 0.05 vs STZ group. |
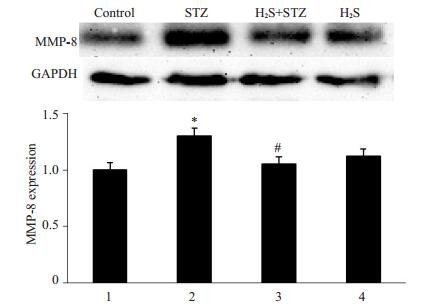
Western blot法检测各组MMP-8蛋白表达水平, 结果(图 3)发现:与对照组相比, STZ组大鼠心肌组织中的MMP-8蛋白表达明显升高(P < 0.05);与STZ组相比, STZ+H2S组大鼠心肌MMP-8蛋白表达减少(P < 0.05); H2S组与对照组比较无明显差异。结果提示硫化氢干预抑制了糖尿病大鼠心肌组织MMP-8的表达上调。
|
图 3 MMP-8的表达 Figure 3 Expression of MMP-8 in rat myocardium.*P < 0.05 vs Control; #P < 0.05 vs STZ group. |
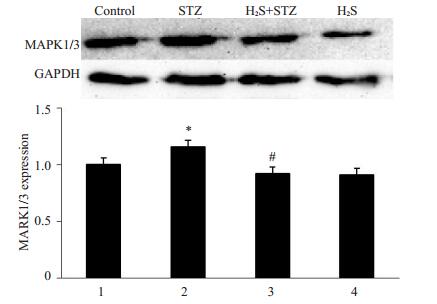
Western blot法检测MAPK1/3蛋白表达, 结果(图 4)发现:与对照组相比, STZ组大鼠心肌组织中的MAPK1/3蛋白表达明显升高(P < 0.05);而与STZ组相比, 硫化氢干预下STZ+H2S组大鼠心肌组织中的MAPK1/3蛋白表达减少(P < 0.05);H2S组与对照组比较无明显差异。结果提示硫化氢干预抑制了糖尿病大鼠心肌组织MAPK1/3的表达。
|
图 4 MAPK1/3的表达 Figure 4 Expression of MAPK1/3 in rat myocardium.*P < 0.05 vs Control; #P < 0.05 vs STZ group. |
心肌纤维化是糖尿病心肌病心肌重构的重要标志, 也是导致左心功能不全的主要原因。而糖尿病心肌纤维化的发病机制较为复杂, 具体机制尚不十分清楚[2, 7]。有研究表明其发生发展与MMPs的表达和活性异常有关。MMPs是一组能特异地降解细胞外基质(ECM)的Zn2+依赖酶家族, 作为ECM最主要蛋白水解系统, MMPs在降解ECM的同时还可通过调节基质素的形成及释放生物活性因子, 造成组织胶原比例失衡或形成丧失正常结构与功能的胶原蛋白和结缔组织, 从而破坏原有的胶原纤维网络导致组织纤维化[2, 5, 8]。
MMP-8为基质金属蛋白酶家族中一员, 亦称中性粒细胞胶原酶, 主要由中性粒细胞分泌产生, 在炎症及创伤修复过程中常见MMP-8表达和活性明显增加[9]。活化的MMP-8可以降解基质的胶原成分, 破坏胶原网的结构, 导致心肌纤维化, 胶原蛋白Ⅰ和Ⅲ表达升高[10-11]。已有研究发现心肌梗死后心肌组织发生纤维化过程中, MMP-8的表达显著增加, 同时有学者发现终末期心力衰竭患者中心肌MMP-8的mRNA水平可升高30倍[7]。本研究发现糖尿病大鼠心肌存在明显心肌纤维化, 而Collagen I可反应纤维化的程度, 也是动物实验中检测纤维化程度常用的方法。本实验中检测Collagen I表达水平明显增加, 提示心肌纤维化。而心肌组织间的MMP-8表达也明显增加, 提示糖尿病心肌纤维化可能与MMP-8表达上调有关。目前人们已发现MAPK在心肌纤维化的信号调控中发挥着重要的作用[12-13]。研究发现肿瘤坏死因子相关的凋亡诱导剂在骨骼肌细胞中可引起MAPK通路的激活, 从而引起基质金属蛋白酶家族中MMP-9及胶原蛋白IV表达增强, 最终导致心肌纤维化和心脏重构[4]。本实验发现糖尿病心肌纤维化的同时不仅存在MMP-8表达的明显上调, 而MAPK1/3蛋白的表达水平也是明显上调的。已有研究发现骨骼肌组织中MAPK通路激活可上调MMPs[5, 8], 而本研究结果也提示糖尿病大鼠心肌MAPK通路存在过度激活, 并可能参与了上调MMP-8水平以及心肌纤维化的信号调控。
H2S作为一种具有广泛生理功能的气体信号分子, 已有大量研究证明了H2S具有抗炎、抗凋亡、抗氧化等作用, 对心血管系统具有十分重要的保护作用[3, 6, 14]。H2S对心肌胶原含量有良好的疗效, 减少心肌纤维化。本实验发现H2S干预后的糖尿病大鼠心肌纤维化明显减轻, 心肌组织中Collagen I表达水平也明显下降。与此同时还发现:H2S处理后糖尿病大鼠心肌中的MMP-8蛋白的表达也明显降低, 提示H2S改善糖尿病大鼠心肌纤维化的作用可能与下调MMP-8蛋白的过度表达有关。已发现MMPs的表达受MAPK通路的调控[15], 而在实验中我们同样发现H2S处理后糖尿病大鼠心肌中的MAPK1/3蛋白的表达水平也是明显降低的, 提示H2S可以抑制MAPK1/3的表达, 并可能与其下调MMP-8以及改善糖尿病心肌纤维化有关。到目前为止, 在哺育动物细胞中己至少发现有3条MAPK通路:细胞外信号调节蛋白激酶通路、c-jun氨基末端激酶通路和p38 MAPK通路[16], 故对于MAPK通路调控MMP-8的表达以及参与糖尿病心肌纤维化的具体信号转导通路仍有待深入研究。
| [1] | Ward ML, Crossman DJ. Mechanisms underlying the impaired contractility of diabetic cardiomyopathy[J]. World J Cardiol,2014, 6 (7) : 577-84. DOI: 10.4330/wjc.v6.i7.577. |
| [2] | Briest W, Hölzl A, Rassler B, et al. Significance of matrix metalloproteinases in norepinephrine-induced remodelling of rat hearts[J]. Cardiovasc Res,2003, 57 (2) : 379-87. DOI: 10.1016/S0008-6363(02)00700-9. |
| [3] | 朱丽娟, 陈筱山, 何选丽, 等. 外源性硫化氢对高糖条件下原代神经元β淀粉样蛋白的影响[J]. 南方医科大学学报,2014, 34 (4) : 504-6. |
| [4] | Fang L, Li H, Tang C, et al. Hydrogen sulfide attenuates the pathogenesis of pulmonary fibrosis induced by bleomycin in rats[J]. Can J Physiol Pharmacol,2009, 87 (7) : 531-8. DOI: 10.1139/Y09-039. |
| [5] | Li H, Mittal A, Paul PK, et al. Tumor necrosis factor-related weak inducer of apoptosis augments matrix metalloproteinase 9(MMP-9) production in skeletal muscle through the activation of nuclear factor-kappaB-inducing kinase and p38 mitogen-activated protein kinase:a potential role of MMP-9 in myopathy[J]. J Biol Chem,2009, 284 (7) : 4439-50. DOI: 10.1074/jbc.M805546200. |
| [6] | 兰爱平, 梅卫义, 孟金兰, 等. 硫化氢通过抑制p38 MAPK保护PC12细胞对抗化学性缺氧损伤[J]. 中国药理学通报,2010, 26 (10) : 1339-43. |
| [7] | Spinale FG. Matrix metalloproteinases:regulation and dysregulation in the failing heart[J]. Circ Res,2002, 90 (5) : 520-30. DOI: 10.1161/01.RES.0000013290.12884.A3. |
| [8] | Yang F, Liu Z, Wang Y, et al. Hydrogen sulfide endothelin-induced myocardial hypertrophy in rats and the mechanism involved[J]. Cell Biochem Biophys,2014, 70 (3) : 1683-6. DOI: 10.1007/s12013-014-0113-3. |
| [9] | Ye S. Putative targeting of matrix metalloproteinase-8 in atherosclerosis[J]. Pharmacol Ther,2015, 147C : 111-22. |
| [10] | Pei XM, Yung BY, Yip SP, et al.Protective effects of desacyl ghrelin on diabetic cardiomyopathy[J].Acta Diabetol, 2014.[Epub ahead of print]. https://www.ncbi.nlm.nih.gov/pubmed/25192951 |
| [11] | Polyakova V, Loeffler I, Hein S, et al. Fibrosis in endstage human heart failure:severe changes in collagen metabolism and MMP/ TIMP profiles[J]. Int J Cardiol,2011, 151 (1) : 18-33. DOI: 10.1016/j.ijcard.2010.04.053. |
| [12] | Kandalam V, Basu R, Moore L, et al. Lack of tissue inhibitor of metalloproteinases 2 leads to exacerbated left ventricular dysfunction and adverse extracellular matrix remodeling in response to biomechanical stress[J]. Circulation,2011, 124 (19) : 2094-105. DOI: 10.1161/CIRCULATIONAHA.111.030338. |
| [13] | Li M, Yi X, Ma L, et al. Hepatocyte growth factor and basic fibroblast growth factor regulate atrial fibrosis in patients with atrial fibrillation and rheumatic heart disease via the mitogen-activated protein kinase signaling pathway[J]. Exp Ther Med,2013, 6 (5) : 1121-6. |
| [14] | Polhemus DJ, Calvert JW, Butler J, et al. The cardioprotective actions of Hydrogen sulfide in acute myocardial infarction and heart failure[J]. Scientifica (Cairo),2014, 2014 : 768607. |
| [15] | Liu X, Huang X, Chen L, et al. Mechanical stretch promotes matrix metalloproteinase-2 and prolyl-4-hydroxylase α1 production in human aortic smooth muscle cells via Akt-p38 MAPK-JNK signaling[J]. Int J Biochem Cell Biol,2015, 62 : 15-23. DOI: 10.1016/j.biocel.2015.02.009. |
| [16] | 陈建勇, 王聪, 王娟, 等. MAPK信号通路研究进展[J]. 中国医药科学,2011, 1 (8) : 32-4. |
 2015, Vol. 35
2015, Vol. 35
