2. 中山大学生命科学学院, 广东 广州5 10275
2. School of life sciences, sun yat-sen university
树突状细胞(dendritic cell, DC)是能力最强的抗原提呈细胞(antigen presentation cell, APC)。DC特异的结合细胞间黏附分子3的非整合素(DC-specific intercellular adhesion molecule3-grabbing nonintegrin, DC-SIGN, CD209)属于C型凝集素家族成员, 为Ⅱ型跨膜蛋白, 由胞浆区、跨膜区、颈区和胞外区构成, 其天然配体是细胞或病原体表面的甘露糖等结构。DC-SIGN是一种天然免疫模式识别分子(pattern-recognition receptors, PRR), 主要分布在DC膜表面[1-2]。借助PRR, DC可识别病原体表达的高度保守的分子结构即病原体相关分子模式(pathogen associated molecular patterns, PAMP), 在DC诱导的免疫应答中起着非常重要的作用[3-4]。2001年, Mummidi等[5]发现细胞内存在多种无跨膜区和胞浆区的短截DC-SIGN mRNA剪切体, 并认为其编码可溶性DC-SIGN (soluble DC-SIGN, sDC-SIGN)。2011年, Plazolles等[6]采用在DC培养上清、人血清和类风湿关节炎病人关节液中检测到sDC-SIGN, 发现人体液中sDC-SIGN含量与疾病相关。本实验室从健康产妇胎盘中提取了RNA, 克隆了人DC-SIGN cDNA, 表达了融合蛋白sDC-SIGN-GST[7], 并对其功能进行了研究, 发现sDC-SIGN可抑制Con A或anti-CD3/CD28活化T细胞的CD69表达、细胞增殖及细胞因子的分泌[8]。为更好地研究sDC-SIGN的作用, 我们又优化表达了无标签蛋白的sDC-SIGN[9]。有研究发现未成熟DC (immmature DC, imDC)可吞噬金黄色葡萄球菌(金葡菌)[10], 且DC-SIGN胞外段-IgG Fc嵌合蛋白能结合幽门螺杆菌、结核杆菌的裂菌产物及血吸虫提取物[11]。因此, 本实验就sDC-SIGN对imDC吞噬金葡菌的影响及其机制进行了初步研究。
1 材料和方法 1.1 主要材料重组质粒pET-17b-sDC-SIGN由本室构建[7]并保存; IL-4、GM-CSF购自Sigma; 抗人DC-SIGN抗体(DCN46)购自美国BD Biosciences Pharmingen; 1C6、4H3为本室制备的抗sDC-SIGN单克隆抗体; E.coli BL21(DE3)表达菌为本室保存; HRP-羊抗鼠IgG抗体购自博奥森公司; CFSE购自Invitrogen; LTA购自Sigma; 金葡菌菌株43300由本室保存。
1.2 sDC-SIGN的表达及纯化将重组表达质粒pET-17b-sDC-SIGN转入BL21 (DE3)感受态细胞中, 将菌液均匀涂布于含100 mg/L氨苄青霉素的LB琼脂板上, 倒置, 放入37℃培养箱中, 反应12~16 h, 等到菌落长出来后, 挑取单个菌落, 接种于含同样浓度氨苄青霉素的LB液体培养基中, 37℃震摇(250 r/min)培养过夜。按1:100转种于同样培养基中, 37℃震摇培养约2~3 h, 至A600 nm为1.0~1.2时, 加入IPTG (终浓度1 mmol/L), 37℃震摇培养3 h。收集细菌并裂菌处理, SDS-PAGE鉴定。将收集的包涵体沉淀用4℃预冷的2 mol/L尿素约25 ml洗涤2次后, 每克菌约用6 ml 8 mol/L尿素溶解, 以pH8.0预冷PBS进行梯度透析复性后, 用1C6-sepharose 4B柱进行亲和层析纯化, 以Western-Blot鉴定纯化产物。
1.3 CFSE标记金葡菌细菌常规培养至对数期, 6000 r/min离心10 min, 弃上清, 用PBS洗涤2次; 将细菌调整成为1×109 CFU/ml, 加入CFSE 1.5 μg/ml, 37℃避光震摇反应20 min; 用PBS洗涤2次, 6000 r/min离心10 min, 弃上清, 以PBS重悬, 4℃避光保存备用。
1.4 sDC-SIGN对DC吞噬金葡菌的影响采用密度梯度离心和免疫磁珠负选法分离纯化外周血CD14+单核细胞, 用含10%胎牛血清(fetal bovine serum, FBS)的RPMI 1640培养基培养, 加入GM-CSF和IL-4至终浓度各40 ng/ml, 培养5 d收集细胞即为imDC。将imDC加入反应孔, 2×105/孔, 按20:1比例加入CFSE-细菌, 然后每孔分别加入sDC-SIGN 0 μg、0.2 μg, 37℃轻摇反应1 h; FACS洗液洗涤3次, 加入PE-anti-CD11c抗体, 4℃反应30 min; FACS洗液洗涤2次后, 上机(FACScalibur)分析。
1.5 sDC-SIGN与金葡菌的结合常规培养细菌至对数期, 6000 r/min离心10 min, 弃上清, 以PBS洗涤2次, 将细菌调整为5×107 CFU/ml; 加入酶联板孔中, 100 μl/孔, 室温放置18 h; TBS-T洗板5次, 加入含1% BSA的TBS-T封闭, 300 μl/孔, 37℃反应1 h; TBS-T洗板5次, 加入含10 mmol/L Ca2+稀释的sDC-SIGN, 浓度(μg/ml)分别为40、20、10、5和2.5, 室温反应2 h; TBS-T洗板5次, 加入anti-CD209抗体(2.5 μg/ml), 37℃反应1 h; TBS-T洗板5次, 加入HRP-羊抗鼠抗体(1:8000), 37℃反应30 min; TBS-T洗板5次, 显色, 用酶标仪测A450 nm。
1.6 sDC-SIGN与金葡菌磷壁酸、脂多糖的结合将自金葡菌的磷壁酸(lipoteichoic acid, LTA)和脂多糖(lipopolysaccharides, LPS), 浓度均为20 μg/ml, 4℃反应过夜; TBS-T洗板5次, 5% BSA-TBS-T封闭, 300 μl/孔, 37℃反应1 h; TBS-T洗板5次, 分别加入sDC-SIGN, 浓度为0、5、10、20 μg/ml, 室温反应2 h; TBS-T洗板5次, 加入anti-CD209, 2.5 μg/ml, 37℃反应1 h; TBS-T洗板5次, 加入HRP-羊抗鼠, 1:8000稀释, 37℃反应30 min; TBS-T洗板5次, 显色, 用酶标仪测A450 nm。
1.7 甘露聚糖、LTA、1C6、4H3对sDC-SIGN与金葡菌结合的影响细菌常规培养至对数期, 6000 r/min, 10 min, 离心后弃上清, 用PBS洗涤2次, 将细菌调整成为5× 107 CFU/ml, 100 μl/孔室温包被18 h; TBS-T洗板5次, 加入1% BSA的TBS-T封闭, 300 μl/孔, 37℃反应1 h; TBS-T洗板5次, 加入10 mM Ca2+稀释的sDC-SIGN, 浓度为20 μg/ml, 同时分别加入甘露聚糖100 μg/ml, LAT 20 μg/ml, 1C6 100 μg/ml, 4H3 100 μg/ml, 室温反应2 h; TBS-T洗板5次, 加入anti-CD209 2.5 μg/ml, 37℃反应1 h; TBS-T洗板5次, 加入HRP-羊抗鼠, 1:8000稀释, 37℃反应30 min; TBS-T洗板5次, 显色, 用酶标仪测A450 nm。
1.8 Ca2+对sDC-SIGN与金葡菌结合的影响细菌常规培养至对数期, 6000 r/min, 10 min, 离心后弃上清, 用PBS洗涤2次, 将细菌调整成为5×107 CFU/ml, 100 μl/孔室温包被18 h; TBS-T洗板5次, 加入1% BSA的TBS-T封闭, 300 μl/孔, 37℃反应1 h; TBS-T洗板5次, 分别加入含有1 mmol/L Ca2+、10 mmol/L Ca2+稀释的sDC-SIGN, 浓度为20 μg/ml, 和EDTA 10 mmol/L, 室温反应2 h; TBS-T洗板5次, 加入anti-CD209 2.5 μg/ml, 37℃反应1 h; TBS-T洗板5次, 加入HRP-羊抗鼠, 1: 8000稀释, 37℃反应30 min; TBS-T洗板5次, 显色, 用酶标仪测A450 nm值。
1.9 统计学分析应用SPSS 13.0软件进行数据处理, 两组间均数比较采用两独立样本t检验, P < 0.05表示差异有统计学意义。
2 结果 2.1 sDC-SIGN的表达及纯化Western-Blot结果显示, 在非还原和还原条件时都在40 000处有目的条带出现, 并且, 同还原条件相比非还原条件时在高于170 000处还有条带存在(图 1), 这些条带是sDC-SIGN的高聚体形式。结果表明, sDCSIGN蛋白的纯度较高, 可用于后续实验。
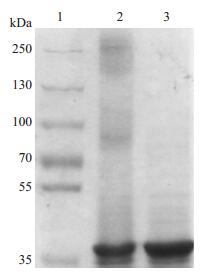
|
图 1 Western-blot鉴定sDC-SIGN Figure 1 Identification of sDC-SIGN by Western blotting.1:Protein marker; 2:Unreduced sDC-SIGN; 3:Reduced sDC-SIGN. |
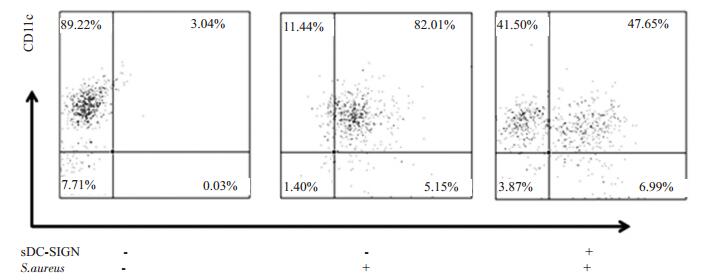
|
图 2 sDC-SIGN抑制imDC吞噬金葡菌 Figure 2 sDC-SIGN suppresses phagocytosis of S.aureus by imDC. |
imDC能够吞噬金葡菌, 但在加入sDC-SIGN (0.2 μg)后, imDC吞噬金葡菌的能力明显下降。
2.3 sDC-SIGN结合金葡菌ELISA结果显示, sDC-SIGN可与金葡菌结合, 且存在浓度依赖关系, 结合能力随着sDC-SIGN的浓度增加而增加(图 3)。
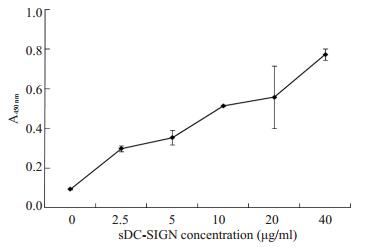
|
图 3 ELISA分析sDC-SIGN与金葡菌的结合 Figure 3 Analysis of sDC-SIGN binding to S.aureus by ELISA. |
ELISA结果显示, sDC-SIGN可与LTA结合, 并且随着sDC-SIGN浓度增加, 其结合力也随之增强; 但sDC-SIGN不与革兰氏阴性菌LPS结合(图 4)。
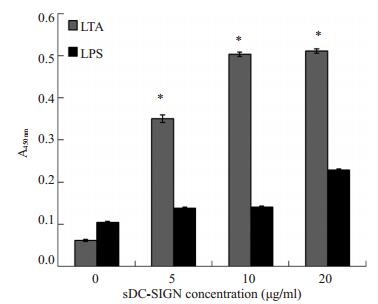
|
图 4 ELISA分析sDC-SIGN与LTA、LPS的结合 Figure 4 Analysis of sDC-SIGN binding to LTA and LTA by ELISA.*P < 0.05 vs 0 μg/ml sDC-SIGN concentration group. |
DC-SIGN的配体甘露聚糖和LTA、抗DC-SIGN抗体1C6和4H3均可有效阻断sDC-SIGN与金葡菌的结合(图 5), 表明sDC-SIGN能特异地与金葡菌表面的糖成分结合。
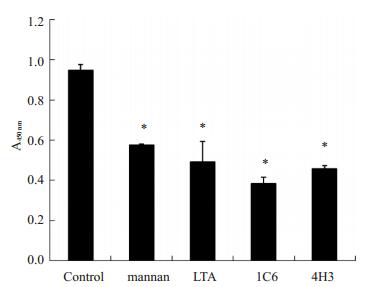
|
图 5 ELISA分析甘露聚糖、LTA、1C6、4H3对sDC-SIGN结合金葡菌的影响 Figure 5 Effect of mannan, LTA, 1C6 and 4H3 on sDC-SIGN binding to S.aureus.*P < 0.05 vs control group. |
sDC-SIGN与金葡菌的结合是Ca2+浓度依赖的, Ca2+浓度越高结合力越强(P < 0.05, 图 6)。
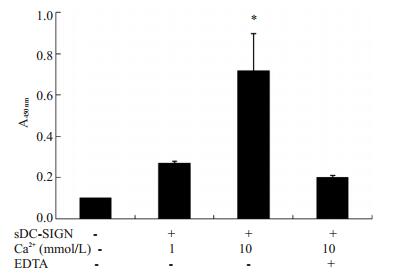
|
图 6 ELISA分析Ca2+对sDC-SIGN与金葡菌结合的影响 Figure 6 Effect of Ca2+ on sDC-SIGN binding to S.aureus.*P < 0.05 vs control or EDTA group. |
近年发现, DC-SIGN还存在另一种形式即sDC-SIGN[5-6]。然而, 除了Plazolles等[6]发现sDC-SIGN可促进CMV感染DC和本课题组发现sDC-SIGN可抑制Con A或anti-CD3/CD28活化T细胞的CD69表达、细胞增殖及细胞因子的分泌[8]外, 未见其它有关sDC-SIGN作用或其生物学意义的报道。
由于DC表面膜型DC-SIGN可识别并结合外源性配体如病原体糖结构而捕获抗原[12], 因此我们首先测试了sDC-SIGN对imDC吞噬金葡菌的影响, 发现sDC-SIGN能抑制imDC吞噬金葡菌, 然后探索了sDC-SIGN抑制DC吞噬作用的机制。发现sDC-SIGN可结合金葡菌、LTA但对LPS则否。LTA是来自金葡菌的磷壁酸, 而LPS为革兰氏阴性细菌细胞壁的主要成分, 则上述结果表明sDC-SIGN可选择性识别并结合金葡菌表面的磷壁酸。发现sDC-SIGN与金葡菌的结合可被DC-SIGN的配体甘露聚糖和LTA、抗人DC-SIGN抗体1C6和4H3有效阻断, 表明sDC-SIGN与金葡菌的结合是特异的。此外, 还发现sDC-SIGN与金葡菌的结合呈Ca2+依赖性, Ca2+浓度越高二者的结合越强, 进一步证实sDC-SIGN能够与金葡菌表面的糖成分结合。因此, 本实验结果表明, sDC-SIGN可抑制imDC对金葡菌的捕获和吞噬, 其机制是sDC-SIGN优先与金葡菌表面糖成分结合从而抑制了DC膜上DC-SIGN对金葡菌的捕获。
imDC主要负责捕获抗原, 在启动获得性免疫应答中发挥关键作用。膜型DC-SIGN识别并结合外源性配体如病原体糖结构而捕获抗原, 并与T细胞表面ICAM-3相互作用, 参与形成免疫突触, 触发初始T细胞应答[13-14]。另一方面, 某些慢性感染病原体如HIV、结核杆菌等通过膜型DC-SIGN介导内吞进入DC, 抑制DC功能并利用其作为"特洛伊木马"逃避宿主免疫系统攻击, 而且与易感细胞表面配体如ICAM-3、Lewis糖相互作用, 形成感染性突触而感染新的宿主细胞[15-16]。我们发现sDC-SIGN对imDC吞噬金葡菌具有抑制作用, 提示sDC-SIGN可能具有免疫调节意义并抑制某些病原体感染宿主细胞。然而, 这种作用的生物学意义和病理学意义尚待进一步研究。
| [1] | Svajger U, Anderluh M, Jeras M, et al. C-type lectin DC-SIGN:An adhesion, signalling and antigen-uptake molecule that guides dendritic cells in immunity[J]. Cell Signal,2010, 22 (10) : 1397-405. DOI: 10.1016/j.cellsig.2010.03.018. |
| [2] | Santiago K, Bomfim GF, Criado PR. Monocyte-Derived dendritic cells from patients with dermatophytosis restrict the growth of trichophyton rubrum and induce CD4-T cell activation[J]. PLoS One,2014, 9 (11) : e110879. DOI: 10.1371/journal.pone.0110879. |
| [3] | den Dunnen J, Gringhuis SI, Geijtenbeek TB. Innate signaling by the C-type lectin DC-SIGN dictates immune responses[J]. Cancer Immunol Immunother,2009, 58 (7) : 1149-57. DOI: 10.1007/s00262-008-0615-1. |
| [4] | Streng-Ouwehand I, Unger WW, Van Kooyk Y. C-type Lectin Receptors for Tumor Eradication:Future Directions[J]. Cancers (Basel),2011, 3 (3) : 3169-88. |
| [5] | Mummidi S, Catano G, Lam L, et al. Extensive repertoire of membrane-bound and soluble dendritic cell-specific ICAM-3-grabbing nonintegrin 1(DC-SIGN1) and DC-SIGN2 isoforms-Inter-individual variation in expression of DC-SIGN transcripts[J]. J Biol Chem,2001, 276 (35) : 33196-212. DOI: 10.1074/jbc.M009807200. |
| [6] | Plazolles N, Humbert JM, Vachot L, et al. Pivotal advance:the promotion of soluble DC-SIGN release by inflammatory signals and its enhancement of cytomegalovirus-mediated cis-infection of myeloid dendritic cells[J]. J Leukoc Biol,2011, 89 (3) : 329-42. DOI: 10.1189/jlb.0710386. |
| [7] | 刘莹, 左大明, 卢晓, 等. 人DC-SIGN全长编码区基因的克隆及其胞外段的原核表达[J]. 细胞与分子免疫学杂志,2009, 25 (5) : 396-8, 405. |
| [8] | 马静, 刘莹, 卢晓, 等. 可溶性DC-SIGN对T淋巴细胞增殖及分泌细胞因子的调节作用[J]. 细胞与分子免疫学杂志,2011, 27 (8) : 856-8. |
| [9] | 张婧, 张丽芸, 卢晓, 等. 人可溶性DC-SIGN的原核表达及鉴定[J]. 热带医学杂志,2013, 13 (6) : 701-3, 707. |
| [10] | Nagl M, Kacani L, Mullauer B, et al. Phagocytosis and killing of bacteria by professional phagocytes and dendritic cells[J]. Clin Diagn Lab Immunol,2002, 9 (6) : 1165-8. |
| [11] | Appelmelk BJ, van Die I, van Vliet SJ, et al. Cutting edge: Carbohydrate profiling identifies new pathogens that interact with dendritic cell-specific ICAM-3-grabbing nonintegrin on dendritic cells[J]. J Immunol,2003, 170 (4) : 1635-9. DOI: 10.4049/jimmunol.170.4.1635. |
| [12] | Ehlers S. DC-SIGN and mannosylated surface structures of Mycobacterium tuberculosis:a deceptive liaison[J]. Eur J Cell Biol,2010, 89 (1) : 95-101. DOI: 10.1016/j.ejcb.2009.10.004. |
| [13] | Berg LM, Gringhuis S, Geijtenbeek TB. An evolutionary perspective on C-type lectins in infection and immunity[J]. Ann N Y Acad Sci,2012, 1253 (1) : 149-58. DOI: 10.1111/j.1749-6632.2011.06392.x. |
| [14] | van den Berg LM.Gejjtenbeek TB, Gejjtenbeek TB. antivirual immune response by human langerhans cells and dendritic cells in HIV-infection[J]. Adv Exp Med Biol,2013, 762 (1) : 45-70. |
| [15] | Koethe S, Avota E, Schneider-Schaulies S. Measles virus transmission from dendritic cells to T cells:forming of synapse-like interface concentrating viral and cellular components[J]. J Viral,2012, 86 (18) : 9773-81. DOI: 10.1128/JVI.00458-12. |
| [16] | Cassol E, Cassetta L, Rizzi C, et al. Dendritic cell-specific ICAM-3 gabbing nonintegrin mediates HIV-1 infection of and transmission by M2a-polarized macrophages in vitro[J]. AIDS,2013, 27 (5) : 707-16. DOI: 10.1097/QAD.0b013e32835cfc82. |
 2015, Vol. 35
2015, Vol. 35
