2. 南方医科大学南方医院惠侨科, 广东 广州 510515
2. Huiqiao Department, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
角膜移植术后免疫排斥反应是一个多种免疫细胞和免疫分子参与的复杂的免疫应答,虽然存在免疫赦免和前房相关性免疫偏离,但排斥反应仍是角膜移植失败的主要限制因素。移植术后的免疫排斥反应是目前角膜移植手术失败的主要原因,特别是在角膜血管化、多次移植、碱烧伤等严重病变情况的患者,角膜植片的远期存活率低于35%[1]。因此,防治排斥反应仍是角膜移植中的一个重要课题。临床上,应用于抑制排斥反应的药物可以提高角膜移植的成功率与植片的长期存活率,但仍有部分患者可以耐受药物,排斥反应不能扭转,且价格昂贵,毒副作用较大,效果欠佳。因此,寻找高效低毒的免疫抑制剂是角膜移植研究的重要方向。熊果酸是一种弱酸性五环三萜类化合物,是多种天然产物的功能成分,是常见的中药成分,本身具有免疫调节等作用[2]。研究发现,对多种恶性肿瘤有明显细胞毒作用诱导分化作用及抗血管形成作用,还对多种致癌促癌物质有抵抗作用体外研究表明,可抑制肿瘤细胞增殖和血管内皮细胞形成[3],有抗菌抗糖尿病抗溃疡降血脂抗氧化增强机体免疫功能等多种生物学作用和药理活性。本实验建立大鼠同种异体角膜移植模型,术后腹腔注射熊果酸治疗,以观察移植术后角膜植片的存活时间,以及对角膜新生血管与角膜移植术后排斥反应的作用,为其临床应用提供理论和实验依据。
1 材料与方法 1.1 实验动物与材料选用雌性SD大鼠12只作为供体,Wistar大鼠48只作为受体,6~8周龄,体质量180~220g,均购于南方医科大学实验动物中心,术后Wistar大鼠单只单笼饲养。麻醉剂为3%(质量体积浓度)戊巴比妥钠注射液(按1.5 ml/kg进行麻醉),散瞳剂为复方托品酰胺,10-0尼龙线购于美国Ethicon,熊果酸购于Sigma(按20mg·kg-1·d-1进行腹腔注射)。RNA提取与逆转录试剂盒、荧光定量PCR试剂均购自日本的TaKaRa。兔抗NF-κBp65多克隆抗体、兔抗IκB-α多克隆抗体,鼠抗ICAM-1抗体购于Abcam。GAPDH内参抗体与Ⅱ抗购于北京普利莱基因技术有限公司,RIPA裂解液购于上海碧云d生物技术有限公司。
1.2 分组和手术方法采用完全随机分组设计方案,随机抽取12只未行角膜移植的Wistar大鼠作为正常对照组(A组),取12只Wistar大鼠做自体角膜移植组即(B组),取24只Wistar大鼠进行同种异体角膜移植(C组及D组);供、受体大鼠术前20 min给予复方托吡卡胺眼液充分散瞳,腹腔注射3%戊巴比妥纳1.5 ml/kg体质量麻醉,常规消毒铺巾。手术全过程在手术显微镜下进行。采用直径3.5 mm环钻取供体角膜植片,以直径3.0 mm环钻制备受体眼植床、术中注入粘弹剂保持前房深度,10-0尼龙线间断缝合8针线结不埋,自然形成前房。术毕结膜囊涂泰利必妥眼膏。术后不拆除角膜缝线。术后采用腹腔注射给药,自手术当日始,每天给药1次,连续用药12d。
1.3 观察排斥反应及其判断标准每组随机标定6只大鼠用于临床排斥评价,其余动物用于组织学检查。术后14 d内,每日手术显微镜下观察植片情况;14 d后,隔日观察1次,观察期为50d。照Larkin等[4]的评分方法,记录角膜各参数。(1)角膜混浊:0分,角膜植片完全透明;2分,角膜植片透明轻度丢失;3分,虹膜血管窥不清,但瞳孔轮廓可见;4分,瞳孔轮廓不清;(2)角膜水肿:0分,角膜植片无水肿;1分,角膜植片中度水肿;3分,伴植片增厚的显著水肿;(3)新生血管:0分,无新生血管;1分,新生血管在任何象限深入达到角膜植片半径的25%;2分,新生血管在任何象限深入达到角膜植片半径的50%;3分,新生血管在任何象限深入达到角膜植片半径的75%;4分,新生血管达到角膜植片中央。以角膜混浊、水肿和新生血管1项评分之和作为排斥反应指(rejection index, RI)时,RI≥5分时,或者混浊一项达到3时,即为发生排斥反应。术后3 d内有严重感染、前房出血,晶状体混浊,虹膜广泛前粘连,伤口裂开、晶体脱出等并发症者剔除,并及时补充例数。
1.4 组织病理学检查每组用于取材的大鼠2只术后14 d处死大鼠,取角膜,4%多聚甲醛液固定,常规酒精梯度脱水,石蜡包埋,5 μm切片,组织病理学采用苏木素-伊红(HE)染色法,镜检。
1.5 荧光定量PCR检查各组均取2只大鼠的角膜,置于1 ml Trizol的离心管中,采用Trizol一步法提取总RNA。行琼脂糖凝胶电泳检测,在Nanodrop上测定RNA浓度,以焦碳酸二乙酯(DEPC)水为空白对照,同时记录RNA浓度及其D260/D280值。用逆转录试剂盒进行逆转录反应来合成cDNA。以大鼠GAPDH为内参照。大鼠GAPDH上游引物为5'-ACCACAGTCCATGCCATCAC-3',下游引物为5'-TCCACCACCCTGTTGCTGAT-3';IL-2上游引物为5'-TGATGGACCTACAGGAGCTCCTGAG-3',下游引物为5'-GAGTCAAATCCAGAACATGCCGCA G-3';VEGF上游引物为5'-GGCCTCTGAAACCATG AACT-3',下游引物为5'-TGAACTTCACCACTT GGCAT-3';IFN-γ上游引物为5'-GGAGGAACTGGCA AAAGGATGGT-3', 下游引物为5'-TTGGGACAATCT CTTCCCCAC-3';ICAM-1上游引物为5'-GCTACATC CACACTGACGCT-3',下游引物为5'-CAGGGAATG AGTAGACCTCCA-3';NF-κBp65上游引物为5'-CCG TGGAGTACGACAACATC-3',下游引物为5'-CCTCT TCCAGCTGCTATGTG-3'。参照TAKARA公司的说明配置反应液,采用三步法进行PCR。应用7500 RT-PCR反应体系进行扩增:95℃预变性30 s,95℃变性5 s,60℃退火34 s,共40个循环,重复检测两次。
1.6 Westernblot检测各组均取2只大鼠的角膜,采用冰冻的RIPA裂解液裂解植片,PBS缓冲液洗涤,加入蛋白酶抑制剂,提取核蛋白。SDS-PAGE凝胶电泳分离蛋白,转移至PDVF膜;室温下用封闭液(5%脱脂奶粉)封闭1h;兔抗NF-κBp65多克隆抗体、兔抗IκB-α多克隆抗体(1: 4000),鼠抗ICAM-1单克隆抗体4℃孵育过夜;洗涤与封闭后,与相应的Ⅱ抗(1:10000)结合,显影、定影,曝光,化学发光法显示免疫条带。GAPDH作为内参抗体。采用凝胶成像分析系统对条带进行定量分析。
1.7 统计学方法实验数据应用SPSS 16.0统计软件进行分析处理,应用单因素方差分析比较角膜植片存活时间及排斥指数,比较组间差异采用LSD检验;绘制Kaplan-Meier生存曲线比较植片的存活率;各组新生血管评分属于重复测量资料,采用广义估计方程进行统计学分析。
2 结果 2.1 排斥反应的临床观察(图 1)
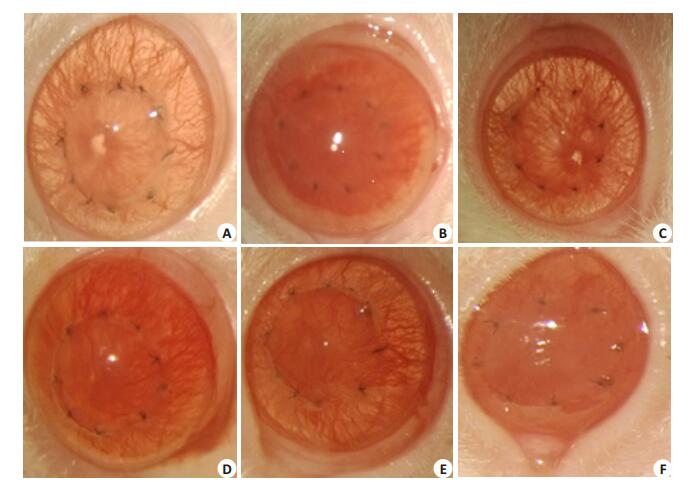
|
图 1 大鼠角膜移植术后排斥反应的临床观察 Figure 1 Corneal grafts at different time points following transplantation in different groups. A: Autograft control group (group B) at 14 days; B: Allograft control group (group C) at 14 days; C-F: Ursolic acid group (group D) at 14, 21, 28 and 37 days, respectively. |
术后7d内,手术本身与缝线刺激等可产生炎症反应,手术各组角膜植片均出现一过性的水肿,混浊,植床边缘出现少许新生血管,未出现明显排斥反应。自术后第8天开始,各组角膜植片呈现不同情况。自体角膜移植组(B组):角膜植片水肿逐渐消失,观察期内角膜植片均保持透明;同种异体角膜移植组(C组):在第8天开始时,出现严重的水肿、混浊,并伴有大量的新生血管生成。逐渐发生排斥反应,植片的平均存活时间是9.67±2.16d;熊果酸组(D组)术后第14天时,植床长满新生血管,接近缝线处,随后的观察时间内,一部分角膜植片出现水肿、混浊加重,出现排斥反应;另一部分植片呈现新生血管逐渐生长,评分可达3分,随后部分新生血管消退,观察期内继续保持透明,植片的平均存活时间是29.83±8.47d,应用单因素方差分析,比较两组角膜植片的平均存活时间,C、D组间差异有统计学意义(F=8.437,P=0.001)
2.2 病理组织学检查术后14d,正常组(图 2A)角膜结构清楚,未见异常;自体角膜移植组(图 2B)中角膜各层结构清楚,未见明显异常,仅基质层中见少量新生血管与炎性细胞浸润;同种异体角膜移植组(图 2C)角膜各层组织中可见大量淋巴细胞和单核巨噬细胞浸润,基质层中有新生血管成分,新生血管的管腔中亦可见淋巴细胞;熊果酸组(图 2D)的角膜结构基本保持正常,植片基质层仅有个别淋巴细胞浸润,植床处可见少量新生血管。
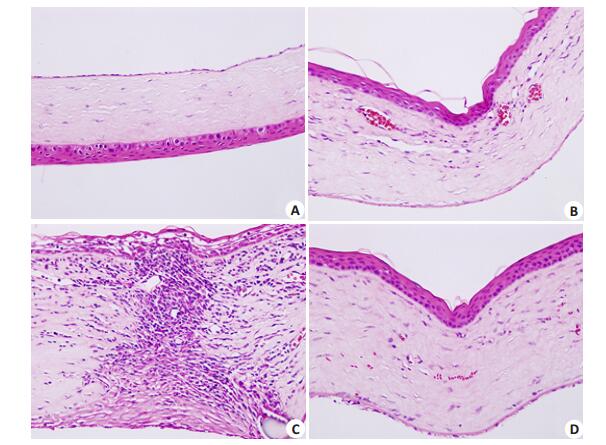
|
图 2 术后14 d各组角膜植片的病理组织切片 Figure 2 Pathological examination of the corneal grafts at 14 days after transplantation (HE staining, Original magnification: ×40). A: Normal control group; B: Autograft control group; C: Allograft control group; D: Ursolic acid group. |
术后14d,在mRNA水平上,各组角膜植片中IL-2,IFN-γ,NF-κBp65,VEGF,ICAM-1的相对含量(RQ值表示)有差异,B组、C组在角膜移植术后,IL-2,IFN-γ,NF-κBp65,VEGF,ICAM-1的含量会明显升高,D组,即熊果酸组,用药之后,相应的炎症指标明显下降。应用单因素方差分析,先进行方差齐性检验,F值依次为236.991,414.224,24.931,32.164,21.383,采用LSD检验进行两两比较,除了正常组与自体角膜移植组之间无统计学差异外(P=0.528,0.176,0.316,0.068,0.747),NF-κBp65在C组与D组之间差异无统计学意义(#P=0.068 > 0.05),其余各组之间均有统计学意义(P < 0.01,图 3)。
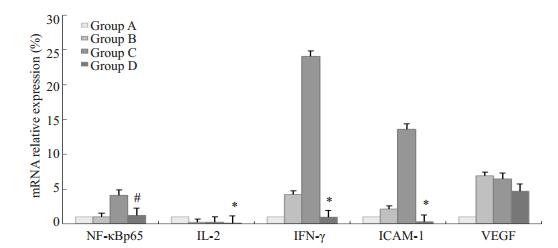
|
图 3 术后14 d各组角膜植片中的IL-2,IFN-γ,NF-κBp65,VEGF,ICAM-1 mRNA的表达变化 Figure 3 Expression of IL-2, IFN-γ, NF-κBp65, VEGF, ICAM-1 in each group grafts 14 days after transplantation. with IL-2, IFN-γ, ICAM-1, *P < 0.01 vs group C, #P=0.068 vs group C. |
术后14d,在蛋白表达水平(从左至右,依次为A组、B组、C组、D组)上,各组角膜植片中NF-κBp65,IκB-α的相对含量(用1A表示)有差异,B组、D组在角膜移植术后,NF-κBp65,IκB-α的相对含量变化趋势一致;与C组相比,D组NF-κBp65的相对含量明显下降,而IκB-α的含量升高(图 4)。
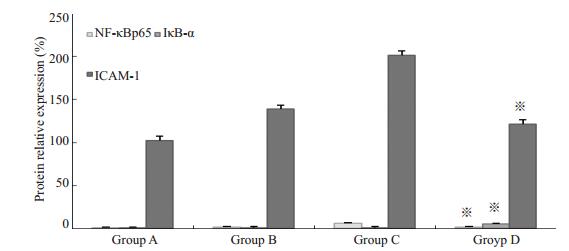
|
图 4 术后14 d各组角膜植片中的NF-κBp65、IκB-α的蛋白表达变化 Figure 4 Expression of NF-κBp65, IκB-α, and ICAM-1 in the grafts in each group at 14 days after transplantation. ※※P < 0.05 vs group C. |
角膜移植后的免疫反应是一个相当复杂的过程,移植术后新生血管是增加排斥风险的高危因素。常见的免疫抑制剂可以有效抑制排斥反应,但具有肾毒性,肝毒性等副作用。熊果酸为中药成分,来源广,药物的毒副作用较少,本实验对熊果酸进行实验研究,旨在为临床应用提供实验依据。
3.1 熊果酸对角膜移植术后排斥反应的作用机制熊果酸可能是一种潜在的免疫抑制剂,通过抑制IκB-α磷酸化和核因子NF-κBp65核转录,导致由PKC磷酸化的NF-κBp65活化抑制,即通过NF-κB信号通路介导免疫抑制的,有效地抑制T细胞的活化与增殖,降低Th1细胞因子IL-2与IFN-γ的产生[5-7]。核因子NF-κB是由Sen等[8]首次从B细胞核提取物中发现的一种能与免疫球蛋白k轻链基因的增强子κB序列特异结合的蛋白因子,主要由p50、p65两个异质二聚体构成,与抑制亚基单位IκB-α结合,存在于未活化状态的胞液中。NF-κB可上调T细胞表面B7共刺激分子与MHC-Ⅱ的表达,刺激Th1细胞因子IL-2与IFN-γ的产生,调节T细胞活化、增殖与基因转录[9-11]。IL-2与IFN-γ本身是具有T细胞生长因子特点的细胞因子。IL-2与IL-2R相互作用,或者IFN-γ自身均可以反过来促进T细胞的增殖、分化、成熟,从而促发细胞免疫应答,最终导致角膜植片的急性排斥[12-13]。所以,IL-2和IFN-γ是角膜移植排斥反应过程中的重要靶分子与免疫检测指标。
本实验发现,与同种异体角膜移植组(C组)相比,熊果酸组(D组)角膜植片的存活时间明显延长,熊果酸组(D组)角膜植片中IL-2、IFN-γ的mRNA相对含量明显下降,而NF-κBp65的mRNA相对含量差异无统计学意义。在炎症反应过程中,NF-κBp65的含量在7d时到达高峰,术后14d取材时,其含量已经逐渐降低,其mRNA水平较蛋白水平的表达更敏感。研究发现,熊果酸抑制NF-κBp65核因子转录与T细胞活性,而非通过上调CD4+CD25+Foxp3+T细胞,诱导小鼠心脏移植的宿主特异性免疫耐受[14]。熊果酸呈剂量依赖性地抑制T细胞的活化与增殖,可降低T细胞表面活性标志CD25、CD69与CD71的含量[15]。在体外实验中,通过抑制丝裂霉素诱导的ERK、JNK的磷酸化,抑制免疫调节转录因子NF-κB、NF-AT与AP-1的活化,从而有效抑制T细胞,B细胞、巨噬细胞的活化,增殖及细胞因子的分泌[16]。另外,Weaternblot分析表明,NF-κBp65的相对蛋白含量呈降低的趋势,而IκB-α磷酸化后降解较少,其相对含量增多(图 4A、B、D、E)。进一步表明,熊果酸可能通过NF-κB信号同路途径抑制T细胞活性,从而抑制大鼠角膜移植术后排斥反应的发生。
3.2 熊果酸对角膜移植术后新生血管生长的影响术后,手术创伤、缝线刺激以及同种异体抗原等因素的影响,可导致角膜植床表面和基质层中有大量新生血管长入。研究表明,新生血管是角膜移植发生排斥的主要危险因素[17]。在本实验中,熊果酸组(D组)角膜植片中ICAM-1的相对含量在蛋白水平与mRNA水平均明显下降,VEGF的mRNA相对含量亦明显下降,差异有统计学意义;熊果酸组病理组织切片的角膜结构基本保持正常,植片基质层仅有个别淋巴细胞浸润,植床处可见少量新生血管。研究发现,VEGF参与血管形成的生理过程,维持内皮细胞的活性和稳定性,在病理状态下可促进新生血管的形成。其表达可能由双重的、相互依赖的机制来调节,包括HIF-1的直接调节和以NF-κB为媒介的COX-2的表达及前列腺素E2产生的间接调节。而ICAM-1介导细胞间粘连,并传递细胞信号,参与VEGF对角膜炎症性新生血管增殖的调控[18]。在大鼠肝移植实验中,证明VEGF和ICAM-1与急性排斥反应相关的细胞因子,当阻断该分子或者其相应的配体后,能延长移植的生存率[19]。另外,熊果酸能够下调IL-1α的含量及由IL-1α诱导的ICAM-1的表观分子含量,改变与ICAM-1氮端连接的寡糖结构,并且可以降低ICAM-1转运蛋白的表达,诱导ICAM-1与高甘露醇型多聚糖在内质网中聚集,从而减少其转移至细胞表面[20]。NF-κB信号通路可以由促炎症性细胞因子IL-1α诱导激活的,且IL-1α能够诱导多种主要炎症细胞因子(ICAM-1)的表达[21]。所以,熊果酸通过抑制NF-κB信号通路的激活,调节VEGF、ICAM-1的表达含量,从而减轻角膜移植术后的炎症反应,减少角膜新生血管的形成,延长移植存活时间。
综上所述,熊果酸能够有效抑制角膜移植术后排斥反应的发生与新生血管的生成,明显延长植片存活时间。该药抗新生血管形成的作用使得抗排斥效果大大加强,在临床方面,具有巨大的研发与应用潜能。
| [1] | 王婷, 宋怀燕. 熊果酸药理作用研究进展[J]. 中华医学研究杂志,2005, 9 (5) : 1-8. |
| [2] | Schafer G, Cramer T, Suske G, et al. Oxidative stress regulates vascular endothelial growth factor-A gene transcription through Sp1-and Sp3-dependent activation of two proximal GC-rich promoter elements[J]. J Biol Chem,2003, 278 (10) : 8190-8. DOI: 10.1074/jbc.M211999200. |
| [3] | Rahul C, Santosh KS, Sharma D, et al. Potent Anti-Inflammatory activity of ursolicacid, atriterpenoidantioxidant, is mediated through suppression of NF-kB, AP-1 and NF-AT[J]. PLoS One,2012, 7 (2) : e31318. DOI: 10.1371/journal.pone.0031318. |
| [4] | Larkin DF, Calder VL, Lightman SL. Identification and characterization of cells infiltrating the graft and aqueous humour in rat corneal allograft rejection[J]. Clin Exp Immunol,1997, 107 (2) : 381-91. DOI: 10.1111/cei.1997.107.issue-2. |
| [5] | Gao N, Cheng SP, Budhraja A, et al. Ursolic acid induces apoptosis in human leukaemia cells and exhibits anti-leukaemic activity in nude mice through the PKB pathway[J]. Br J Pharmacol,2012, 165 (6, SI) : 1813-26. DOI: 10.1111/j.1476-5381.2011.01684.x. |
| [6] | Shanmugam MK, Ong TH, Kumar AP, et al. Ursolic acid inhibits the initiation, progression of prostate Cancer and prolongs the survival of TRAMP mice by modulating Pro-Inflammatory pathways[J]. PLoS One,2012, 7 (3) : e32476. DOI: 10.1371/journal.pone.0032476. |
| [7] | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J]. Cell,1986, 46 (5) : 705-16. DOI: 10.1016/0092-8674(86)90346-6. |
| [8] | Wu J, Zhang M, Jia H, et al. Protosappanina induces immunosuppression of rats heart transplantation targeting T cells in grafts via NF-kappaB pathwaynaunynschmiedebergs arch pharmacol[J]. PLoS One,2010, 381 (1) : 83-92. |
| [9] | Saijo K, Schmedt C, Su I, et al. Essential role of Src-family protein tyrosine kinases in NF-kappa B activation during B cell development[J]. Nat Immunol,2003, 4 (3) : 274-9. DOI: 10.1038/ni893. |
| [10] | Shapira S, Harb OS, Caamano J, et al. The NF-kappa B signaling pathway:immune evasion and immunoregulation during toxoplasmosis[J]. Int J Parasitol,2004, 34 (3) : 393-400. DOI: 10.1016/j.ijpara.2003.12.005. |
| [11] | Bayer AL, Pugliese A, Malek TR. The IL-2/IL-2R system:from basic science to therapeutic applications to enhance immune regulation[J]. Immunol Res,2013, 57 (1/3, SI) : 197-209. |
| [12] | Ju JM, Lee H, Oh K, et al. Kinetics of IFN-γand IL-17 production by CD4 and CD8 T cells during acute graft-versus-host disease[J]. Immunol Res,2014, 14 (2) : 89-99. |
| [13] | Liu Y, Huang X, Li Y, et al. Ursolic acid promotes robust tolerance to cardiac allografts in mice[J]. Clin Exp Immunol,2011, 164 (2) : 282-8. DOI: 10.1111/cei.2011.164.issue-2. |
| [14] | Zeng G, Chen J, Liang QH, et al. Ursolic acid inhibits T-Cell activation through modulating nuclear factor-kappa B signaling[J]. Chin J Integr Med,2012, 18 (1) : 34-9. DOI: 10.1007/s11655-011-0858-0. |
| [15] | Checker R1, Sandur SK, Sharma D, et al. Potent anti-inflammatory activity of ursolicacid, atriterpenoidantioxidant, is mediated through suppression of NF-κB, AP-1 and NF-AT[J]. PLoS One,2012, 7 (2) : e31318. DOI: 10.1371/journal.pone.0031318. |
| [16] | Gebhardt BM, Shi WY. Experimental corneal allograft rejection[J]. Immunol Res,2002, 25 (1) : 1-26. DOI: 10.1385/IR:25:1. |
| [17] | Penn JS, Madan A, Caldwell RB, et al. Vascular endothelial growth factor in eye disease[J]. Prog Retin Eye Res,2008, 27 (4) : 331-71. DOI: 10.1016/j.preteyeres.2008.05.001. |
| [18] | Ma T, Liu H, Chen W, et al. Implanted adipose-derived stem cells attenuate small-for-size liver graft injury by secretion of VEGF in rats[J]. Am J Transplant,2012, 12 (3) : 620-9. DOI: 10.1111/j.1600-6143.2011.03870.x. |
| [19] | Yang YT, Jun CD, Liu JH, et al. Structural basis for dimerization of ICAM-1 on the cell surface[J]. Mol Cell,2004, 14 (2) : 269-76. DOI: 10.1016/S1097-2765(04)00204-7. |
 2015, Vol. 35
2015, Vol. 35
