膜性肾病是一种器官特异性自身免疫性疾病,是引起特发性肾病综合征最常见的病因之一[1-2]。膜性肾病作为病理诊断,是以肾小球基底膜上皮细胞下弥漫的免疫复合物沉积伴基底膜弥漫增厚为特点[2],30%~50%膜性肾病最终进展至终末期肾脏病[3-4]。根据2011年瑞金医院的统计,在年龄大于60岁以上的人群中,膜性肾病是原发性肾小球疾病中最常见的疾病,约占原发性肾小球疾病的39.64% [5]。然而关于膜性肾病的发病机制目前尚不清楚。在过去的半个世纪中,人们在膜性肾病的疾病发病机制方面做了许多研究,包括Heymann's肾炎动物模型[6]、中性肽链内切酶[7]等。2009年,Beck等[1]发现M-型磷脂酶A2受体(PLA2R1)是特发性膜性肾病(IMN)的靶抗原。其后PLA2R1受到了肾脏病界越来越多的关注。然而关于肾组织PLA2R1的研究在国内鲜有报道[8-9]。我们选用本科室肾活检诊断为IMN及其他肾小球疾病患者,应用间接免疫荧光法检测肾组织中PLA2R1抗原的阳性率,探讨其与IMN的关系。
1 对象与方法 1.1 研究对象选取南方医科大学第三附属医院2010年5月~2014年5月经肾活检证实的成人IMN、继发性膜性肾病及其他肾小球疾病患者共108例,包括IMN41例(男性27例,女性14例,平均49.08±14.23岁),乙型肝炎病毒相关性膜性肾病(HBV-MN)2例(男性2例,年龄在35~54岁),V型狼疮肾炎(LN)8例(男性1例,女性7例,平均33.90±15.03岁),IgA肾病(IgAN)27例(男性10例,女性17例,平均40.00±12.20岁),微小病变性肾病(MCD)19例(男性12例,女性7例,平均34.63±14.75岁),轻度系膜增生性肾小球肾炎(MsPGN)5例(男性4例,女性1例,平均50.8±14.58岁),局灶节段性肾小球硬化(FSGS)6例(男性5例,女性1例,平均37.00±19.83岁)。IMN的诊断是根据经肾活检病理检查诊断为膜性肾病,并排除由狼疮肾炎、HBV-MN、肿瘤等其他因素所致的继发性膜性肾病[1]。本研究所选取采用的所有病例临床上均未长期使用激素和免疫抑制剂治疗,所有肾活检组织的采集均经患者知情同意。
1.2 标本采集及方法B型超声引导下行肾组织穿刺,肾活检组织分割后,分别行光镜、免疫荧光、电镜检测。采用直接免疫荧光法常规进行IgG、IgA、IgM、C3、C1q、C4染色。光镜下行PAS、PASM、MASSON、HE染色。肾穿刺组织送电镜。采用石蜡包埋组织或者肾穿当日新鲜冰冻肾组织应用间接免疫荧光法,检测IMN、继发性膜性肾病及其他肾小球疾病肾组织PLA2R1抗原。新鲜冰冻切片:切3~4 μm厚冰冻切片,经丙酮固定;5% BSA室温下封闭30 min;一抗兔抗人PLA2R1多克隆抗体(Sigma)稀释至1:500,孵育约1.5 h;PBS冲洗3次,甩干后加鼠抗兔IgG二抗(CWIBO)孵育50 min,PBS冲洗3次,应用缓冲甘油封片。荧光显微镜下观察,奥林巴斯激光扫描共聚焦显微镜下拍摄。石蜡切片:经烤片,脱蜡,38℃水浴箱1:20蛋白酶K消化30 min,5% BSA室温下封闭,余加抗体步骤同冰冻切片。根据荧光强度划分为阴性、+、++、+++。阴性对照:每种疾病都用PBS代替一抗做阴性对照,只有加入PBS阴性并且加入一抗阳性者,才判断为阳性。
1.3 临床资料收集收集患者年龄、性别、血肌酐、24 h尿蛋白定量、血清白蛋白。根据患者肾脏组织光镜及电镜病理改变,对41例IMN患者进行Ⅰ~Ⅴ期病理分期。
1.4 统计学处理采用SPSS 19.0软件对数据进行分析,计数资料应用率表示,连续性计量资料应用中位数与四分位数间距表示。计数资料之间的比较采用卡方检验,两组独立样本的计量资料之间的比较用Mann-W hitney U非参数检验,多组独立样本计量资料之间的比较用Kruskal-Walis H检验。双侧P < 0.05表示差异有统计学意义。
2 结果 2.1 不同病理类型患者的一般资料不同病理类型患者年龄、性别、血肌酐、血清白蛋白、24 h尿蛋白量之间差异有统计学意义(表 1,P < 0.05),说明不同病理类型对肾脏的损伤是不一致的,而且发病年龄、性别都不一致。
| 表 1 基于不同病理类型患者的临床特征 Table 1 Clinical characteristics of the patients with different pathological patterns |
膜性肾病中PLA2R1抗原阳性患者与PLA2R1抗原阴性患者的年龄、性别、血肌酐、血清白蛋白及24 h尿蛋白定量之间差异无统计学意义(表 2,P < 0.05)
| 表 2 膜性肾病PLA2R1阳性患者与阴性患者临床资料比较 Table 2 Clinical characteristics of IMN patients with and without PLA2R1 expression in glomerular immune deposits |
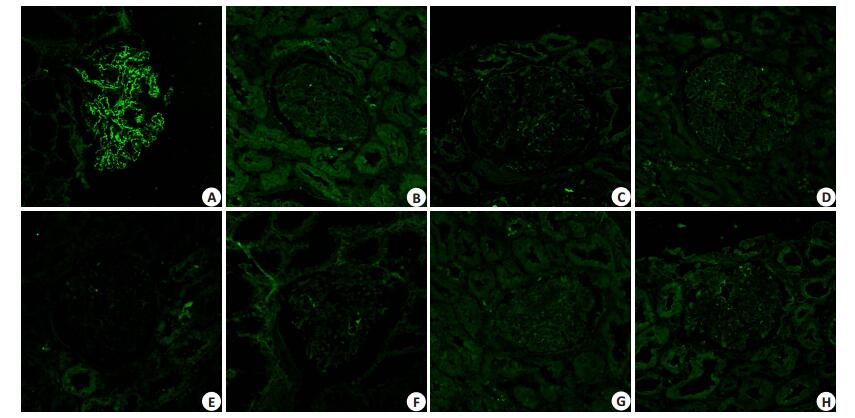
在41例IMN中,35例有PLA2R1抗原的沉积;PLA2R1是沿着肾小球毛细血管袢呈细颗粒状沉积(图 1)。6例IMN患者肾组织中并未发现PLA2R1的沉积。新鲜冰冻组织和石蜡固包埋组织PLA2R1阳性率无统计学差异(P=0.757)。在乙型肝炎病毒相关性膜性肾病、V型狼疮肾炎及其他肾小球疾病中均未发现PLA2R1抗原的沉积。
|
图 1 间接免疫荧光法分析PLA2R1在不同患者肾脏中的沉积 Figure 1 Indirect immunofluorescence assay for detecting PLA2R1 in renal biopsy specimens of different patients (Original magnification: × 400). A: IMN; B: HBV-MN; C: lupus-MN; D: IMN; E: FSGS; F: IgAN; G: MCD; H: MsPGN. |
我们在国内应用肾组织间接免疫荧光法,在41例IMN患者肾组织中检测PLA2R1抗原。研究结果显示成人IMN患者肾组织中PLA2R1抗原阳性率为85.37%,而且沿肾小球毛细血管畔呈细颗粒状沉积。我们进一步探讨了PLA2R1抗原与膜性肾病患者临床特征的关系,发现PLA2R1抗原阳性患者与阴性患者在年龄、性别、血肌酐、血清白蛋白及24 h尿蛋白定量之间差异均无统计学意义。
PLA2R1属于甘露醇受体家族,是一种相对分子质量为180000的I型跨膜糖蛋白,存在于人正常足细胞中[1, 10]。在2009年Beck等[1]提出PLA2R1为IMN的靶抗原,他们在70%的IMN患者血清中发现抗PLA2R1抗体。Debiec等[11]对42例IMN患者血清及肾组织PLA2R进行分析,发现其阳性率分别为57%和74%,并且有3例患者血清抗PLA2R抗体阳性,在肾组织中并未发现PLA2R抗原的沉积。提示血清抗PLA2R抗体与肾组织PLA2R抗原阳性不一致,血清抗PLA2R抗体阴性并不能排除PLA2R相关性膜性肾病。国内周广宇等[9]应用Westernblot法对20例IMN患者血清分析,发现75%患者血清中可检出抗PLA2R抗体。Qin等[8]对60例IMN患者检测其血清抗PLA2R抗体,发现其中有49例患者为阳性,阳性率为81.6%。我们在中国IMN病人肾组织中研究PLA2R1抗原表达情况。研究表明通过对肾组织PLA2R1抗原的染色,发现肾组织阳性率高于国内外文献报道的血清学阳性率[1, 8-9]。与国外研究相比,在IMN患者肾组织中PLA2R1抗原阳性率高于文献报道的肾组织PLA2R1阳性率[11-13],提示种族差异,其PLA2R1的表达可能有一定差异。
Larsen等[13]通过对80例继发性膜性肾病患者进行检测,分别在丙型肝炎相关性膜性肾病、肿瘤相关性膜性肾病、类肉瘤相关性膜性肾病、干燥综合征中患者肾组织中检测到PLA2R1抗原。Ronco等[14]对既往报道血清学抗PLA2R抗体患者分析,在V型狼疮肾炎及乙型病毒性肝炎相关性膜性肾病患者抗PLA2R抗体阳性率分别为4.4%和17%。Qin等[8]对20例V型狼疮肾炎、16例乙型肝炎病毒相关性膜性肾病及10例肿瘤相关性膜性肾病患者检测血清抗PLA2R抗体,其阳性率分别为5%、6.3%、30%。在继发性膜性肾病中我们仅仅分析了2例乙型病毒性肝炎相关性膜性肾病与8例V型狼疮肾炎。在这10例继发性膜性肾病中并没有发现PLA2R1抗原的沉积。分析其原因可能与继发性膜性肾病的样本量少有关,在以后的研究中有必要扩大样本量继续研究。
PLA2R作为表达于正常人足细胞上的一种跨膜蛋白,早在10年前人们就发现PLA2R在肺组织及中性粒细胞中也有表达[15-16]。然而,至今我们并不清楚正常人PLA2R的功能,以及血清抗PLA2R抗体是否会干扰正常肾组织的功能[2]。PLA2R在正常肾组织及膜性肾病及正常人肺组织及中性粒细胞中表达,为何在IgA肾病等原发性肾小球肾炎中未发现其表达,这一问题有待解决。关于PLA2R的作用及其抗原阳性与临床的关系以及PLA2R抗原沉积是否会加重IMN仍未明确,并且各家报道不一。Hofstra等[17]证实血清抗PLA2R抗体的水平与疾病的严重程度、缓解及复发是相关的,并且可以用来检测疾病的活动。后来甚至有人提出尝试着应用检测血清抗PLA2R抗体滴度代替有创性肾活检检查以诊断IMN[2]。然而我们通过对肾活检时患者的临床资料进行分析发现,肾组织PLA2R1抗原阳性与阴性患者在血肌酐、血清白蛋白、24 h尿蛋白定量均无统计学差异。我们的结果与Svobodova等[12]报道的结果一致。PLA2R1抗原阳性对于临床的意义在接下来的工作中有必要继续研究。
综上所述,在成人IMN患者肾组织中应用间接免疫荧光法证实PLA2R1抗原的阳性率为85.37%,PLA2R1阳性与阴性患者在临床表现上无统计学差异。
| [1] | Beck LH, Bonegio RG, Lambeau G, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J]. N Engl J Med,2009, 361 (1) : 11-21. DOI: 10.1056/NEJMoa0810457. |
| [2] | Beck LH, Salant DJ. Membranous nephropathy:recent travels and new roads ahead[J]. Kidney Int,2010, 77 (9) : 765-70. DOI: 10.1038/ki.2010.34. |
| [3] | Segal PE, Choi MJ. Recent advances and prognosis in idiopathic membranous nephropathy[J]. Adv Chronic Kidney Dis,2012, 19 (2) : 114-9. DOI: 10.1053/j.ackd.2012.01.007. |
| [4] | Glassock RJ. Diagnosis and natural course of membranous nephropathy[J]. Semin Nephrol,2003, 23 (4) : 324-32. DOI: 10.1016/S0270-9295(03)00049-4. |
| [5] | Pan X, Xu J, Ren H, et al. Changing spectrum of biopsy-proven primary glomerular diseases over the past 15 years:a single-center study in China[J]. Contrib Nephrol,2013, 181 : 22-30. DOI: 10.1159/000348638. |
| [6] | Heymann W, Hackel DB, Harwood S, et al. Production of nephrotic syndrome in rats by Freund's adjuvants and rat kidney suspensions[J]. Proc Soc Exp Biol Med,1959, 100 (4) : 660-4. DOI: 10.3181/00379727-100-24736. |
| [7] | Debiec H, Guigonis V, Mougenot B, et al. Antenatal membranous glomerulonephritis due to anti-neutral endopeptidase antibodies[J]. N Engl J Med,2002, 346 (26) : 2053-60. DOI: 10.1056/NEJMoa012895. |
| [8] | Qin W, Beck LH, Zeng C, et al. Anti-phospholipase A2 receptor antibody in membranous nephropathy[J]. J Am Soc Nephrol,2011, 22 (6) : 1137-43. DOI: 10.1681/ASN.2010090967. |
| [9] | 周广宇, 金玲, 于晶, 等. 成人膜性肾病患者血清抗PLA2R抗体与病情的相关性[J]. 中华肾脏病杂志,2012, 28 (2) : 111-4. |
| [10] | Hanasaki K, Arita H. Phospholipase a2 receptor:a regulator of biological functions of secretory phospholipase a2[J]. Prostaglandins Other Lipid Mediat,2002, 68-69 : 71-82. DOI: 10.1016/S0090-6980(02)00022-9. |
| [11] | Debiec H, Ronco P. PLA2R autoantibodies and PLA2R glomerular deposits in membranous nephropathy[J]. N Engl J Med,2011, 364 (7) : 689-90. DOI: 10.1056/NEJMc1011678. |
| [12] | Svobodova B, Honsova E, Ronco P, et al. Kidney biopsy is a sensitive tool for retrospective diagnosis of PLA2R-related membranous nephropathy[J]. Nephrol Dial Transplant,2013, 28 (7) : 1839-44. DOI: 10.1093/ndt/gfs439. |
| [13] | Larsen CP, Messias NC, Silva FG, et al. Determination of primary versus secondary membranous glomerulopathy utilizing phospholipase A2 receptor staining in renal biopsies[J]. Mod Pathol,2013, 26 (5) : 709-15. DOI: 10.1038/modpathol.2012.207. |
| [14] | Ronco P, Debiec H. Pathogenesis of membranous nephropathy: recent advances and future challenges[J]. Nat Rev Nephrol,2012, 8 (4) : 203-13. DOI: 10.1038/nrneph.2012.35. |
| [15] | Granata F, Petraroli A, Boilard E, et al. Activation of cytokine production by secreted phospholipase A2 in human lung macrophages expressing the M-type receptor[J]. J Immunol,2005, 174 (1) : 464-74. DOI: 10.4049/jimmunol.174.1.464. |
| [16] | Silliman CC, Moore EE, Zallen G, et al. Presence of the M-type sPLA (2) receptor on neutrophils and its role in elastase release and adhesion[J]. Am J Physiol Cell Physiol,2002, 283 (4) : C1102-13. DOI: 10.1152/ajpcell.00608.2001. |
| [17] | Hofstra JM, Beck LH, Beck DM, et al. Anti-phospholipase A2 receptor antibodies correlate with clinical status in idiopathic membranous nephropathy[J]. Clin J Am Soc Nephrol,2011, 6 (6) : 1286-91. DOI: 10.2215/CJN.07210810. |
 2015, Vol. 35
2015, Vol. 35
