2. 暨南大学发育与再生生物学系, 广东 广州 510632
2. Department of Developmental and Regenerative Biology, Jinan University, Guangzhou 510632, China
乳动物卵透明带(zonapellucida, ZP)是覆盖于卵母细胞及着床前受精卵外的一层糖蛋白基质。小鼠卵透明带和人类的相似,由ZP1、ZP2、ZP3三种糖蛋白组成。
传统观点认为,ZP3是第一精子受体和顶体反应的诱导物,ZP2是第二精子受体参与精卵识别过程,能与顶体反应后的精子结合。因此,早期研究主要集中在ZP3。但是,近几年的研究实验显示ZP2在精卵识别起到很关键的作用。重组人ZP239-154肽段则可抑制人精子与透明带结合[1],小鼠ZP2的35~637肽段能够造成其免疫不育[2]。用重组人ZP2肽段免疫猕猴和狒狒,均导致明显的免疫不育效果[3]。用在E.coli中表达的重组帽猴ZP蛋白(包括ZP1和ZP2)免疫雌性帽猴,也导致生育率明显降低[4]。重组mZP2121-140肽段诱发的抗体能与小鼠卵巢透明带特异结合并降低小鼠的繁殖力[5],说明ZP2在受精过程中其着重要的作用。
Dean等进一步将人类的ZP1、ZP2、ZP3或ZP4基因导入小鼠,分别得到产生含人ZP1、ZP2、ZP3或ZP4的小鼠透明带嵌合体[1]。这种用人的特定ZP蛋白取代小鼠自身ZP蛋白的转基因小鼠实验显示,人类精子只结合嵌入人ZP2的转基因小鼠的透明带,而且,嵌合人ZP2的透明带在受精后仍能保持与精子结合[6]。定点突变消除小鼠ZP2的切割位点,该ZP2突变的透明带在受精后能保持与精子的结合[7]。说明小鼠ZP2在精卵结合中起关键作用。
近年来的研究突显ZP2的重要,有待深入研究。我们近年的研究发现,与许多其它动物的透明带相似,小鼠卵泡的颗粒细胞也参与ZP2的发生[8-9]。
抗体是研究透明带生化特性和功能的重要工具,通过基因工程表达透明带蛋白是制备抗体简便有效的途径,但国内实验室主要探讨表达生产ZP3[10-14],很少研究ZP2。目前还没有报道国内其它实验表达ZP2蛋白,更没有制备抗体。为了对ZP2的功能进行更深入的研究,制备ZP2抗体很必要和迫切。
1 材料与方法 1.1 抗原的制备参见文献[15]方法利用Rosetta-gami(DE3)pLysS菌株体外表达重组小鼠ZP2肽段mZP2201-515,取重组质粒mZP2转化菌和Rosetta宿主菌的超声裂解上清进行SDS-PAGE电泳分离目的蛋白。通过染色对照,从凝胶上切下目的蛋白所在位置的胶条,对照菌裂解上清电泳分离后在对应位置切下胶条,称重,在冰上研钵内研磨直至凝胶为均匀的细小颗粒,再按质量体积比1:1加入PBS和等体积的弗氏佐剂乳化。首次免疫使用弗式完全佐剂,强化免疫用弗式不完全佐剂。
1.2 免疫方法分别用目的蛋白胶和对照胶的乳化抗原通过皮下多点注射途径免疫新西兰雄兔(实验组和对照组)。首次免疫剂量含重组抗原大约lmg。2周后强化免疫,以后每隔1周强化免疫1次,共4次,每次剂量约含重组抗原0.5mg。每次免疫前都从耳缘静脉采血,分离血清,-20℃保存备用。停止免疫1周后心脏采血分离血清。
1.3 ELISA检测抗血清及其效价以分离的重组蛋白为包被抗原包被ELISA板,重组蛋白调整浓度至5 μg/孔。ELISA检测兔血清时,实验组和阴性对照组抗血清分别按1:5000稀释,二抗用1 :10000稀释的羊抗兔IgG-HRP(武汉博士德公司)。以D490值为Y轴,以免疫采血次数为X轴来绘制抗重组 抗原的IgG抗体反应曲线。
取ELISA检测反应强度最强的末次兔血清按1: 5000~1:160000稀释6个不同的倍数梯度作为一抗,按1:10000稀释羊抗兔IgG-HRP作为二抗,测定D490值。
1.4 免疫组化检测抗血清特异性将兔抗ZP2血清依次稀释1:100、1:500、1:1000、1 :2000、1:5000、1:100006个倍数,分别覆盖于小鼠卵巢切片上,对照组切片加对照兔血清,放入湿盒中在37℃放置5h。洗涤后继续孵育CY3标记的羊抗兔IgG(Sigma)。在荧光显微镜下观察卵巢切片的染色情况。
1.5 孕酮诱导精子顶体反应将获能后的小鼠精子分成两组,对照组加入DMSO,实验组加入终浓度为25 μmol/L的孕酮(广州明兴制药厂),诱导顶体反应1 h。用PBS清洗精子后涂片。用PNA-FITC(Sigma)和Hochest(Sigma)同时对精子的顶体以及精子核进行双标记。在荧光显微镜下观察精子的着色情况。
1.6 精卵结合实验用PMSG(宁波第二激素厂)和HCG(丽珠药业)对昆明小鼠促排卵,卵母细胞分成两组,对照组卵转移到含对照兔血清的微滴中,实验组卵转移到含有兔抗mZP2抗体的培养微滴中,血清稀释200倍,CO2培养箱中孵育1 h后,将两组卵母细胞分别移入新的M2培养液中以洗去卵子上残余的抗体。分别加入诱导顶体反应后的精子悬液各20 μl,放入CO2培养箱中精卵结合1 h。在体视镜下将卵子移入新的M2培养液滴中洗去游离的精子。将每个卵子(含其上结合的精子)分开放入一小滴PH2.0的乳酸溶液消化透明带。在10×20倍镜下计数从卵子上脱落下来的精子,即为卵子结合的精子数。
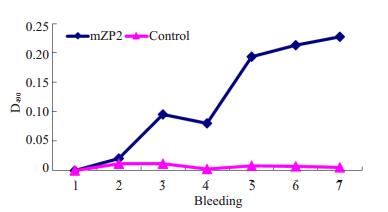
2 结果与分析 2.1 免疫兔的抗体滴度取通过ELISA检测结果显示,7次所采的实验组和对照组兔血清,随免疫次数的增加,实验组抗体反应强度不断上升,第4次免疫后反应强度显著提高。对照组兔血清的免疫反应没有明显变化(图 1)。
|
图 1 ELISA检测免疫动物的抗体反应 Figure 1 Detection of antibody response by ELISA. |
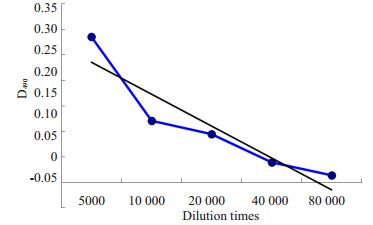
取反应强度最强的末次免疫兔血清来检测抗血清效价,抗血清分别按1:5000,1:10000,1:20000,1: 40000,1:80000,1:160000六个不同的倍数梯度稀释,通过间接ELISA检测相应的D值如图 2。显示即抗体滴度达到20000。
|
图 2 ELISA检测抗血清效价图 Figure 2 Titration of the antiserum by ELISA. |
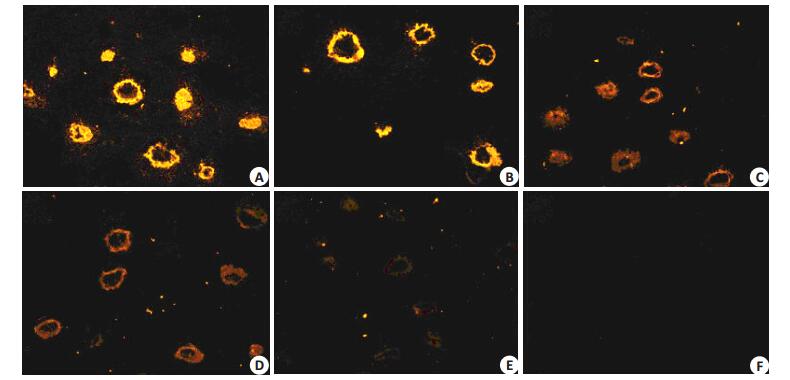
用1:100、1:500、1:1000、1:2000、1:50001:10000 6个稀释度的兔抗mZP2抗血清分别孵育小鼠卵巢组织切片,而后加入CY3标记二抗,免疫荧光实验结果显示,实验兔抗血清特异地结合小鼠卵巢组织切片上的透明带成分,并且随着血清稀释倍数的增加,荧光着色程度逐渐减弱,抗体稀释5000倍时仍有荧光显色(图 3A~E),普通兔血清没有与卵巢组织发生特异反应(图 3F)。显示免疫兔血清产生了能特异结合卵巢透明带的抗mZP2抗体。
|
图 3 小鼠卵巢石蜡切片与不同稀释倍数的抗血清的免疫荧光反应 Figure 3 Immuno-fluorescence assay of mouse ovarian sections reacted with anti-ZP2 antisera at dilutions of 1:100 (A), 1:500 (B), 1:1000 (C), 1:2000 (D), and 1:5000 (E) and with control rabbit serum diluted at 1:100 (F). |
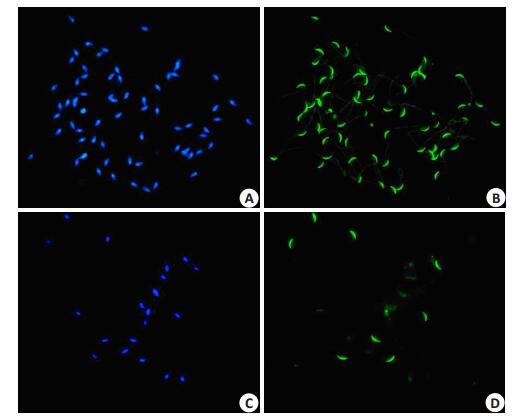
如图 4所示,精子标本经PNA-FITC和Hochest双染色后,兰色荧光显示精子核,绿色荧光显示呈弯月形的精子顶体。未经孕酮诱导的对照组,大部分精子可显示兰色精子核和对应位置的绿色顶体,顶体区域绿色荧光呈弯月形(图 4A,B)。用孕酮处理后,许多兰色精子头缺少对应的绿色荧光,或者绿色荧光变浅,表明精子顶体发生顶体反应(图 4C, D)。初步统计,用孕酮诱导过顶体反应之后的精子AR率可达39%,明显比对照组精子的顶体反应率高(P < 0.001)。
|
图 4 PNA-FITC和Hochest双标记小鼠精子的免疫荧光 Figure 4 Fluorescenes of sperm double-labeled by PNA-FITC and Hochest. A, B: Control sperm labeled by blue fluorescence (A) and green fluorescence (B); C, D: Progesterone-treated sperm labeled by blue fluorescence (C) & green fluorescence (D). |
用孕酮诱导顶体反应后的精子分别与对照兔血清和兔抗mZP2抗血清孵育后的卵子共培养后,两组卵子结合精子的数目也有明显差异(图 5)。用对照血清处理的卵子结合AR精子数为每个卵子143.8±6.126(n=32),用实验组抗血清处理的卵子结合AR精子数为每个卵子80.9±3.461(n=28),结合的AR精子数明显减少(P < 0.05,表 1)。说明抗ZP2抗体减少卵子结合AR精子数。
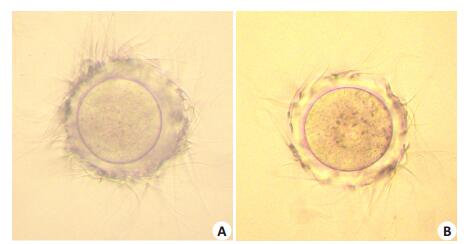
|
图 5 抗ZP2抗血清处理对精卵结合的影响 Figure 5 Binding assay of sperms with oocytes treated with control rabbit serum (A) or with anti-mZP2 antiserum (B). |
本文选取了300多个氨基酸的小鼠mZP2201-515肽段免疫新西兰雄兔制备抗体,初步研究其免疫原性,经ELISA检测,抗体滴度一直随着免疫次数的增加不断上升,抗血清的抗体滴度达到20000。
兔抗mZP2抗血清分别孵育小鼠卵巢组织切片,卵巢的透明带区出现了特异性的荧光,荧光强度随血清稀释倍数增加而减弱,对照的普通血清则没有出现荧光反应,说明抗血清含与卵透明带特异结合的抗体。提示表达的ZP2重组蛋白有免疫原性,已诱发产生了抗ZP2抗体,获得满意的免疫效果,为下一步ZP2的功能研究打下了基础。
经典理论认为,ZP2是第二精子受体,能与顶体反应后的精子结合[16]。我们的预实验也显示,该抗血清孵育小鼠卵细胞后,对精卵结合没有明显影响。但用孕酮诱导顶体反应后的精子分别与对照兔血清和兔抗mZP2抗血清孵育后的卵子共培养后两组结合AR精子数出现了明显差异,孵育抗ZP2抗体组的卵子平均每个卵子结合AR精子明显少于孵育对照血清的卵子平均每个卵子结合AR精子数(表 1,图 5),说明抗ZP2抗体减少卵子结合顶体反应后精子的数量。
但是,抗血清孵育卵子后,没能完成阻止诱导顶体反应后的精子与卵子结合,也即孵育抗ZP2抗体后的卵子仍能结合相当数量的精子,有悖于ZP2次级精子受体的特性。可能有两方面的原因,一是用孕酮诱导精子顶体反应的效率不是很高[17],还有很大一部分精子未发生顶体反应,这部分精子可能不受抗ZP2为抗体的影响继续与卵子结合;二是与精子结合的位点不完全在ZP2的多肽链上,还可能有糖基参与结合精子[18],因此这部分位点不能被抗ZP2肽抗体阻断,继续与精子结合。但是,总的看来,抗ZP2抗血清孵育的卵子结合诱导顶体反应后的精子数有明显减少,几个批次的结果显示差异有统计学意义。说明抗血清有抗ZP2抗体的特性,重组ZP2蛋白诱发了抗ZP2抗体,可以用于后续的进一步研究。
| [1] | Baibakov B, Boggs NA, Yauger B, et al. Human sperm bind to the N-terminal domain of ZP2 in humanized zonae pellucidae in transgenic mice[J]. J Cell Biol,2012, 197 (7) : 897-905. DOI: 10.1083/jcb.201203062. |
| [2] | Lea IA, Widgren EE, O'rand MG. Analysis of recombinant mouse zona pellucida protein 2(ZP2) constructs for immunocontraception[J]. Vaccine,2002, 20 (11/12) : 1515-23. |
| [3] | Martinez ML, Harris JD. Effectiveness of zona pellucida protein ZPB as an immunocontraceptive antigen[J]. J Reprod Fertil,2000, 120 (1) : 19-32. |
| [4] | Govind CK, Srivastava N, Gupta SK. Evaluation of the immunocontraceptive potential of Escherichia coli expressed recombinant non-human Primate zona pellucida glycoproteins in homologous animal model[J]. Vaccine,2002, 21 (1/2) : 78-88. |
| [5] | Sun W, Lou YH, Dean J, et al. A contraceptive peptide vaccine targeting sulfated glycoprotein ZP2 of the mouse zona pellucida[J]. Biol Reprod,1999, 60 (4) : 900-7. DOI: 10.1095/biolreprod60.4.900. |
| [6] | Rankin TL, Coleman JS, Epifano O, et al. Fertility and taxon-specific sperm binding persist after replacement of mouse sperm receptors with human homologs[J]. Dev Cell,2003, 5 (1) : 33-43. DOI: 10.1016/S1534-5807(03)00195-3. |
| [7] | Gahlay G, Gauthier L, Baibakov B, et al. Gamete recognition in mice depends on the cleavage status of an egg's zona pellucida protein[J]. Science,2010, 329 (5988) : 216-9. DOI: 10.1126/science.1188178. |
| [8] | Xie Y, Yu Y, Nie C, et al. Mouse granulosa cells contribute more to the mRNA synthesis of mZP2 than oocyte does[J]. Cell Biochem Funct,2010, 28 (8) : 661-7. DOI: 10.1002/cbf.v28:8. |
| [9] | 谢妍, 乜春城, 曹佐武. 小鼠ZP2 mRNA在卵泡颗粒细胞层的表达[J]. 暨南大学学报:自然科学与医学版,2010, 31 (2) : 116-9. |
| [10] | 徐放, 谢杏美, 孔明惠, 等. 重组人卵ZP3肽段在毕赤酵母中的表达[J]. 暨南大学学报:自然科学与医学版,2010, 31 (6) : 533-8. |
| [11] | 徐万祥, 何亚萍, 洪爱真, 等. 人卵透明带蛋白huZP3a22-176和huZP33b177-348肽段在大肠杆菌中的表达及其纯化[J]. 生殖与避孕,2004, 24 (3) : 143-8. |
| [12] | 宋力雯, 汪玉宝, 倪崖, 等. 人卵透明带蛋白ZP3a和ZP3b肽段的免疫原性及其抗血清体外抑制人精子-半透明带结合[J]. 生理学报,2005, 57 (6) : 682-8. |
| [13] | 王焱冰, 李轶杰, 张富春. 草原兔尾鼠卵透明带3融合蛋白抗原的制备及免疫反应性[J]. 中国生物制品学杂志,2007, 20 (4) : 244-7, 251. |
| [14] | 郭焱, 曲晓波, 金宁一. 重组人卵透明带蛋白3的制备及其免疫学活性分析[J]. 中国免疫学杂志,2009, 25 (12) : 1119-21. |
| [15] | 乜春城, 禹艳红, 谢妍, 等. 小鼠ZP2肽的基因克隆和原核表达载体的构建[J]. 暨南大学学报:自然科学与医学版,2011, 32 (4) : 374-8. |
| [16] | Bleil J GJ, Wassarman P. Identification of a secondary sperm receptor in the mouse egg zona pellucida:role in maintenance of binding of acrosome-reacted sperm to eggs[J]. Dev Biol,1988, 128 (2) : 376-85. DOI: 10.1016/0012-1606(88)90299-0. |
| [17] | Melendrez CS, Meizel S, Berger T. Comparison of the ability of progesterone and heat solubilized porcine zona pellucida to initiate the porcine sperm acrosome reaction in vitro[J]. Mol Reprod Dev,1994, 39 (4) : 433-8. DOI: 10.1002/(ISSN)1098-2795. |
| [18] | Pang PC, Chiu PC, Lee CL, et al. Human sperm binding is mediated by the sialyl-Lewis (x) oligosaccharide on the zona pellucida[J]. Science,2011, 333 (650) : 1761-4. |
 2015, Vol. 35
2015, Vol. 35
