2. 南方医科大学肿瘤研究所,广东 广州 510515
2. Cancer Research Institute, Southern Medical University, Guangzhou 510515, China
结肠癌是西欧、北美等发达国家最常见的恶性肿瘤,在过去30多年的时间里,结肠癌发病率呈上升趋势。结肠癌多见于中老年人,30~69岁占绝大多数,男性多于女性,发病率占胃肠道肿瘤的第3位,主要为腺癌、黏液腺癌、未分化癌。结肠癌的发病与社会环境、生活方式(尤其是饮食习惯、缺乏体力活动)、遗传因素有关。年龄、结直肠息肉史、溃疡性结肠炎及胆囊切除史也是结肠癌的高危因素[1]。
硫利达嗪(Thioridazine)是哌啶类治疗精神疾病的药物,可以通过靶向大脑中的多巴胺受体,来治疗精神障碍所致焦虑和紧张,广泛应用于精神分裂症、躁狂症的治疗[2]。据报道,Thioridazine选择性靶向白血病肿瘤干细胞,但对正常造血干细胞没有影响,可能是拮抗白血病肿瘤干细胞的多巴胺受体[3-4]。PDCD4作为肿瘤抑制和凋亡基因,定位于染色体10q24,PDCD4蛋白由469个氨基酸组成,包含N-末端结构域、C-末端结构域和2个保守的α螺旋MA-3结构域[5]。PDCD4基因通过调控BCL2和c-MYC介导的PI3K/AKT和JNK/C-Jun途径抑制鼻咽癌细胞增殖[6]。PDCD4基因参与细胞凋亡调控,发挥抑制肿瘤细胞增殖、侵袭和转移作用。然而,PDCD4基因在肿瘤发生中的详细作用机制尚不清楚[5]。
近年来文献报道Thioridazine对多种肿瘤细胞有杀伤作用[7-10],但对结肠癌细胞及PDCD4基因的影响尚未见报道。本研究以SW480细胞作为研究对象,观察Thioridazine对结肠癌细胞凋亡的影响,同时检测BCL2、CCND1、CASPASE3 mRNA及AKT、p-AKT和PDCD4蛋白的变化,进一步阐明其可能的作用机制。
1 材料与方法 1.1 试剂HyClone RPMI 1640培养基,胎牛血清(Fetal bovine serum,FBS)均购自General Electric公司,人抗兔AKT、p-AKT(Ser 473)购自Cell Signaling公司,PDCD4抗体、GAPDH抗体和HRP标记的羊抗兔二抗购自Proteintech公司,细胞周期检测试剂盒和Annexin V-FITC凋亡检测试剂盒购自BestBio公司,PrimeScripTMRT-PCR和SYBR® TaqTM II试剂盒购自Takara公司。Thioridazine和其他化学药物购自Sigma公司。
1.2 细胞培养人结肠癌SW480细胞由南方医科大学肿瘤研究所保存。细胞接种于10% FBS的RPMI 1640培养基,5% CO2、37 ℃适当湿度的细胞培养箱中培养。取对数生长期细胞用于实验。
1.3 细胞活力测定MTT测定Thioridazine处理后细胞存活率。将SW480细胞接种于含10% FBS的RPMI 1640培养基,细胞以2.5×103 cells/well密度接种于96孔培养板。铺板24 h后,不同浓度的Thioridazine(0、5、10、15、20、25和30 μmol/L)加入到各孔中,继续培养24 h。然后取20 μl MTT溶液(Sigma,5 mg/ml)加入到每个孔中。37 ℃培养4 h,小心吸取上清,再加入150 μl DMSO振荡器振荡摇匀10 min,酶标仪490 nm测吸光度A值(A490)。计算细胞存活率(%)=(实验组A490-空白组A490/阴性对照组A490-空白组A490)×100%,重复3次。
1.4 细胞凋亡检测Thioridazine作用24 h后,吸去培养液,用PBS清洗2次,加入40 g/L的多聚甲醛液固定10 min后,吸去固定液,以PBS清洗1次,加入5 mg/L的Hoechst33342,染色10 min,用PBS清洗3次后,自然干燥,在尼康TE2000倒置荧光显微镜下以340 nm激发光观察细胞凋亡形态并随机拍照。实验重复3次。
消化、离心收集SW480细胞,用冷PBS洗涤细胞2次。用400 μl 1×Binding Buffer悬浮细胞,浓度约为1× 106/ml。在细胞悬浮液中加入5 μl Annexin V-FITC,轻轻混匀后于2~8 ℃避光条件下孵育15 min。加入10 μl PI后轻轻混匀于2~8 ℃避光条件下孵育5 min,流式细胞仪(BD Biosciences公司)分析。
1.5 细胞周期分析SW480细胞3 × 105/ml密度铺板,Thioridazine(20 μmol/L)处理24 h后,将约1 ×106细胞移入离心管中,1000 r/min离心5 min,弃去上清后,用PBS溶液清洗1次,在离心管中留约0.5 ml PBS,加入75%冰乙醇2 ml混匀固定,4 ℃过夜。检测时,离心去乙醇,PBS清洗1次,在离心管中留1 ml PBS,加入Rnase 5 μ(l 10 mg/ml),37 ℃放置30 min,加入PI(100 μg/ml)染液5 μl,室温避光染色15 min,流式细胞仪检测细胞周期时相和凋亡情况,每个实验重复3次。
1.6 RT-qPCR实验使用TRIzol(Invitrogen,Life Technologies,USA)裂解各组细胞,提取总RNA。参照Takara逆转录试剂盒配置20 μl反应液,Biometra梯度PCR仪扩增:37 ℃、15 min,85 ℃、5 s,反转录合成cDNA。采用SYBR®Premix Ex TaqTM Ⅱ试剂盒,Agilent Mx3005PTM(Agilent Technologies,Inc.)荧光定量PCR仪进行扩增,条件为95 ℃、5 s,60 ℃、0.5 min,45个循环(引物序列如表 1)。
| 表 1 引物序列 Table 1 Sequences of the PCR primers |
Thioridazine处理SW480细胞24 h后,PBS洗涤2次,加入适量RIPA强裂解液(Leagene Biotech公司)和相关磷酸酶、蛋白酶抑制剂(南京凯基公司),冰浴30 min,刮取总蛋白,4 ℃超声后,12 000 r/min离心15 min取上清,BCA法测定蛋白浓度。10% SDS-聚丙烯酰胺凝胶电泳,湿转至PVDF膜,3% BSA封闭,一抗4 ℃过夜孵育,TBST洗膜3次,5 min/次,孵育二抗,洗膜后ECL发光液(Cwbio公司)曝光,ChemiDocTMXRS+成像仪(Bio-Rad公司)检测并保存结果。Image Lab software 3.0.1软件扫描所得条带,计算目的蛋白与GAPDH的灰度比值。
1.8 统计分析使用SPSS 20.0软件进行统计分析,t检验用于两个独立组的比较,单因素方差分析来确定不同群体之间的统计学意义,P < 0.05为有统计学差异。
2 结果 2.1 Thioridazine对细胞活性的影响Thioridazine(0、5、10、20、25、30 µmol/L)处理SW480细胞24 h后,Thioridazine抑制SW480癌细胞的细胞增殖效果见表 2。随着浓度的不断增加,SW480细胞的存活率明显降低,5 µmol/L浓度时细胞存活率为(81.831±11.427)%,SW480细胞增殖受到抑制。20 µmol/L浓度时细胞存活率为(56.388±10.280)%,与空白对照组[(100.042±3.563)%]相比,具有显著性差异(P < 0.05)。采用20 µmol/L浓度进行后续的试验分析。
| 表 2 MTT实验结果 Table 2 MTT assay for evaluating the effect of thioridazine exposure on SW480 cell viability (Mean±SD, n=3) |
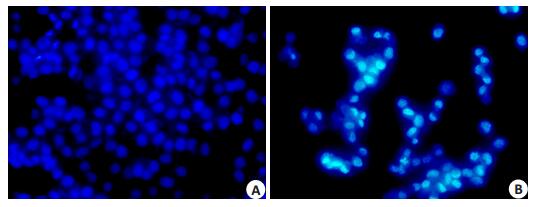
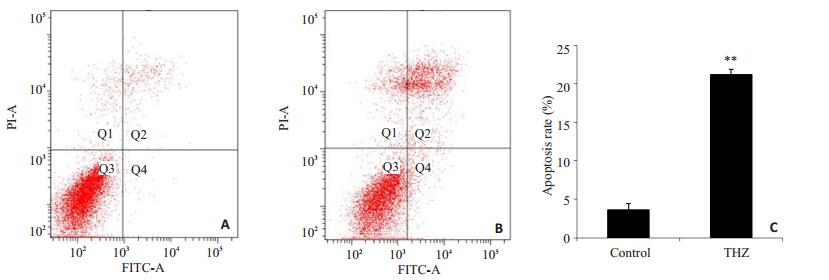
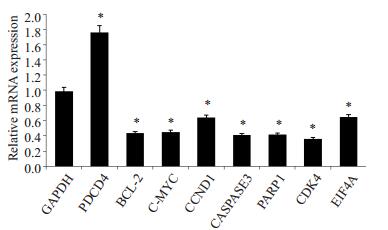
Thioridazine 20 µmol/L处理24 h后,处理组与对照组相比,细胞收缩变圆,数目明显减少。Hoechst33342细胞核染色结果显示,部分细胞出现核固缩、染色质凝集和核碎片化等典型的细胞凋亡特征,而对照组细胞核膜完整,核呈圆形或椭圆形,染色质分布均匀,细胞核为蓝色均匀淡染,未见凋亡细胞(图 1)。流式细胞仪采用AnnexinV-FITC/PI分析细胞凋亡,如图 2,Thioridazine 20 µmol/L处理24 h后,SW480细胞早期凋亡比例为(3.63±1.38)%,晚期凋亡比例为(21.17±1.93)%,具有明显差异(P < 0.01)。荧光定量结果显示CASASE3 mRNA表达水平降低(图 3),以上结果表明Thioridazine可诱导SW480细胞凋亡。
|
图 1 SW480细胞形态学变化 Figure 1 Morphology of SW480 cells under inverted microscope (Original magnification: ×400). A: Control group; B: Thioridazine (20 μmol/L, 24 h). |
|
图 2 Thioridazine 20 µmol/L作用24 h对SW480细胞凋亡率的影响 Figure 2 Apoptotic rate of SW480 cells incubated with 20 μmol/L of thioridazine for 24 h. A: Control group; B: Cells treated with 20 μmol/L thioridazine for 24 h. C: Data statistics of A and B. **P < 0.01 vs control group. |
|
图 3 荧光定量PCR检测相关基因mRNA表达情况 Figure 3 Relative mRNA expression detected by fluorescent real-time PCR in SW480 cells. *P < 0.05, **P < 0.01 vs control group. |
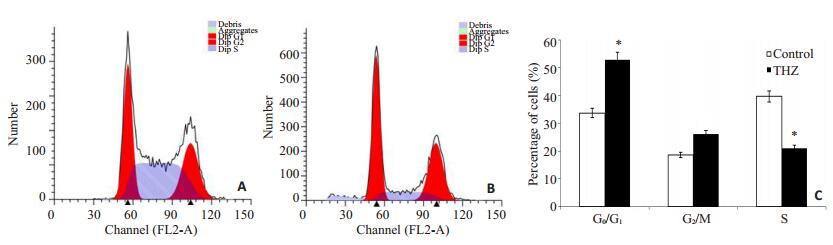
Thioridazine可诱导SW480细胞发生G0/G1期阻滞(图 4),SW480细胞用Thioridazine处理后G0/G1期细胞为(52.893±8.175)%,与对照组的(33.670±2.879)%相比,细胞数目显著升高。荧光定量结果显示CCND1 mRNA表达水平降低(图 3)。这些结果表明,Thioridazine影响DNA复制而导致细胞周期阻滞于G0/ G1期,随后诱导细胞凋亡。
|
图 4 20 µmol/L Thioridazine作用24 h对SW480细胞周期的影响 Figure 4 Cell cycle changes of SW480 cells incubated with 20 μmol/L of thioridazine for 24 h. A: Control group; B: Cells treated with 20 μmol/L thioridazine for 24 h; C: Data statistics of A and B. *P < 0.05 vs control group. |
PCR结果显示20 µmol/L Thioridazine处理SW480细胞24 h后,PDCD4基因高表达,c-MYC、BCL2、CCND1、CASPASE3、PARP1、CDK4和EIF4A基因表达水平降低(P < 0.05,图 3)。
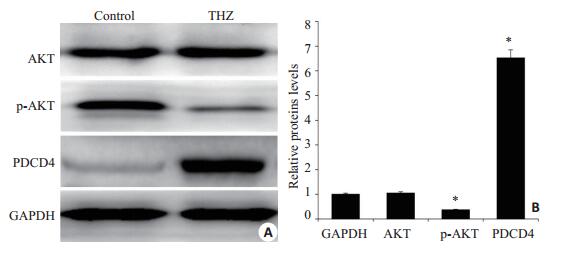
2.5 Western blot结果Thioridazine(20 µmol/L,24 h)处理SW480细胞,PDCD4蛋白明显高表达,AKT蛋白表达没有发生明显变化,但是p-AKT蛋白在给药组表达水平明显降低(P < 0.05,图 5)。
|
图 5 Thioridazine作用后SW480细胞AKT、p-AKT和PDCD4蛋白表达水平变化 Figure 5 Expression AKT, p-AKT and PDCD4 in SW480 cells after thioridazine treatment. A: The bands of Western bloting; B: Ratio of the expression of AKT, p-AKT and PDCD4. *P < 0.05, **P < 0.01 vs control group. |
Thioridazine已被报道具有抗增殖活性的肿瘤细胞包括人卵巢癌细胞[7]、人神经母细胞瘤[8]、人肝癌HepG2细胞[9]、人乳腺癌癌细胞[10-11]、人宫颈癌和子宫内膜癌的细胞[12]、DLBCL细胞系[13]、人肾癌Caki细胞[14]、人胃癌NCI-N87和AGS细胞[15]等。一系列相关的研究表明,Thioridazine可能通过抑制PI3K/AKT信号通路发挥其抗肿瘤的作用。
PI3K/AKT信号通路在人类肿瘤的生理功能中起关键作用,涉及细胞生长、存活到促进血管生成的众多过程[16-17]。Thioridazine能够抑制PI3K/AKT信号通路[12],PDCD4基因位于PI3K/AKT信号通路的下游,因此我们决定研究Thioridazine对SW480细胞PI3K/AKT信号通路及PDCD4的影响。荧光定量与免疫印迹分析表明Thioridazine诱导PDCD4 mRNA、蛋白水平表达升高,抑制AKT蛋白的磷酸化。AKT抑制天冬氨酸特异性半胱氨酸蛋白酶家族成员的活化,而抑制AKT磷酸化可直接抑制CASPASE3,从而诱导细胞凋亡。这是首次在结肠癌细胞中证明了Thioridazine能够调控PDCD4基因高表达,是诱导SW480细胞凋亡的通路之一,说明Thioridazine诱导肿瘤细胞凋亡存在新的机制。
Thioridazine通过G0/G1期细胞周期阻滞,从而抑制SW480细胞增殖和诱导细胞凋亡。细胞周期蛋白CCND1的水平对细胞周期G1/S的转换至关重要,GSK3β通过磷酸化作用促进泛素介导的CCND1的降解,抑制AKT磷酸化可以激活GSK3β激酶从而促进CCND1的降解[18]。在肿瘤细胞中PDCD4诱导p21高表达,导致CDK4降低,我们观察到Thioridazine显著抑制CDK4的表达,从而抑制细胞增殖[12]。活化的AKT通过磷酸化作用激活下游靶蛋白c-MYC和BCL2,进而调节细胞的增殖。Thioridazine能够抑制p-AKT,导致PI3K/AKT信号通路下游的PDCD4高表达。而PDCD4又能通过抑制c-MYC和BCL2 mRNA的表达,抑制细胞的增殖[6],这与荧光定量PCR的分析结果一致。有研究表明,PDCD4可能在转录、翻译和信号转导途径中通过抑制转录阻遏基因EIF4A,从而调节蛋白质的合成,最终抑制了细胞的增殖,诱导肿瘤细胞的凋亡[19-20]。荧光定量PCR结果显示,Thioridazine处理SW480细胞后,与对照组相比EIF4A mRNA表达水平降低。可见,Thioridazine能够抑制PI3K/AKT信号通路,以及调控下游多个相关基因,细胞周期阻滞在G0/G1期,从而抑制SW480细胞增殖,诱导细胞凋亡。
PDCD4在肿瘤中显著下调,与患者不良预后相关。已经有应用Thioridazine成功治疗的宫颈癌患者病例报告[21],Thioridazine的抗癌作用通过小鼠模型已经在体内得证实[22]。本文研究揭示了Thioridazine诱导细胞凋亡一种新机制,鉴于抑制miR-21的表达可使PDCD4表达水平升高[23],因此我们猜测Thioridazine抑制SW480细胞生长机制可能与miR-21的表达水平降低相关,这还需要进一步的研究证明。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin,2011, 61 (2) : 69-90. DOI: 10.3322/caac.v61:2. |
| [2] | Weingarten JC, Thompson TL. The effect of thioridazine on prolactinoma growth in a schizophrenic man: case report[J]. Gen Hosp Psychiatry,1985, 7 (4) : 364-6. DOI: 10.1016/0163-8343(85)90053-2. |
| [3] | Sachlos E, Risueño RM, Laronde S, et al. Identification of drugs including a dopamine receptor antagonist that selectively target cancer stem cells[J]. Cell,2012, 149 (6) : 1284-97. DOI: 10.1016/j.cell.2012.03.049. |
| [4] | Ke XY, Lin Ng VW, Gao SJ, et al. Co-delivery of thioridazine and doxorubicin using polymeric micelles for targeting both cancer cells and cancer stem cells[J]. Biomaterials,2014, 35 (3) : 1096-108. DOI: 10.1016/j.biomaterials.2013.10.049. |
| [5] | Lankat-Buttgereit B, Göke R. The tumour suppressor Pdcd4: recent advances in the elucidation of function and regulation[J]. Biol Cell,2009, 101 (6) : 309-17. DOI: 10.1042/BC20080191. |
| [6] | Zhen Y, Liu Z, Yang H, et al. Tumor suppressor PDCD4 modulates miR-184-mediated direct suppression of C-MYC and BCL2 blocking cell growth and survival in nasopharyngeal carcinoma[J]. Cell Death Dis,2013, 4 : e872. DOI: 10.1038/cddis.2013.376. |
| [7] | Rho SB, Kim BR, Kang S. A gene signature-based approach identifies thioridazine as an inhibitor of phosphatidylinositol-3'-kinase (PI3K)/AKT pathway in ovarian cancer cells[J]. Gynecol Oncol,2011, 120 (1) : 121-7. DOI: 10.1016/j.ygyno.2010.10.003. |
| [8] | Gil-Ad I, Shtaif B, Levkovitz Y, et al. Characterization of phenothiazine-induced apoptosis in neuroblastoma and glioma cell lines: clinical relevance and possible application for brain-derived tumors[J]. J Mol Neurosci,2004, 22 (3) : 189-98. DOI: 10.1385/JMN:22:3. |
| [9] | Hamid R, Rotshteyn Y, Rabadi L, et al. Comparison of alamar blue and MTT assays for high through-put screening[J]. Toxicol In Vitro,2004, 18 (5) : 703-10. DOI: 10.1016/j.tiv.2004.03.012. |
| [10] | Strobl JS, Kirkwood KL, Lantz TK, et al. Inhibition of human breast cancer cell proliferation in tissue culture by the neuroleptic agents pimozide and thioridazine[J]. Cancer Res,1990, 50 (17) : 5399-405. |
| [11] | Strobl JS, Peterson VA. Tamoxifen-resistant human breast cancer cell growth: inhibition by thioridazine, pimozide and the calmodulin antagonist, W-13[J]. J Pharmacol Exp Ther,1992, 263 (1) : 186-93. |
| [12] | Kang S, Dong SM, Kim BR, et al. Thioridazine induces apoptosis by targeting the PI3K/Akt/mTOR pathway in cervical and endometrial cancer cells[J]. Apoptosis,2012, 17 (9) : 989-97. DOI: 10.1007/s10495-012-0717-2. |
| [13] | Nagel D, Spranger S, Vincendeau M, et al. Pharmacologic inhibition of MALT1 protease by phenothiazines as a therapeutic approach for the treatment of aggressive ABC-DLBCL[J]. Cancer Cell,2012, 22 (6) : 825-37. DOI: 10.1016/j.ccr.2012.11.002. |
| [14] | Min KJ, Seo BR, Bae YC, et al. Antipsychotic agent thioridazine sensitizes renal carcinoma Caki cells to TRAIL-induced apoptosis through reactive Oxygen species-mediated inhibition of Akt signaling and downregulation of Mcl-1 and c-FLIP (L)[J]. Cell Death Dis,2014, 5 : e1063. DOI: 10.1038/cddis.2014.35. |
| [15] | Mu J, Xu H, Yang Y, et al. Thioridazine, an antipsychotic drug, elicits potent antitumor effects in gastric cancer[J]. Oncol Rep,2014, 31 (5) : 2107-14. |
| [16] | Porta C, Paglino C, Mosca A. Targeting PI3K/Akt/mTOR signaling in cancer[J]. Front Oncol,2014, 4 : 64. |
| [17] | Vara Já, Casado E, De Castro J, et al. PI3K/Akt signalling pathway and cancer[J]. Cancer Treat Rev,2004, 30 (2) : 193-204. DOI: 10.1016/j.ctrv.2003.07.007. |
| [18] | Liang J, Slingerland JM. Multiple roles of the PI3K/PKB (Akt) pathway in cell cycle progression[J]. Cell Cycle,2003, 2 (4) : 339-45. |
| [19] | Suzuki C, Garces RG, Edmonds KA, et al. PDCD4 inhibits translation initiation by binding to eIF4A using both its Ma3 domains[J]. Proc Natl Acad Sci USA,2008, 105 (9) : 3274-9. DOI: 10.1073/pnas.0712235105. |
| [20] | Chang JH, Cho YH, Sohn SY, et al. Crystal structure of the eIF4A-PDCD4 complex[J]. Proc Natl Acad Sci USA,2009, 106 (9) : 3148-53. DOI: 10.1073/pnas.0808275106. |
| [21] | Hercbergs A. Thioridazine: a radiation enhancer in advanced cervical cancer?[J]. Lancet,1988, 2 (8613) : 737. |
| [22] | Gil-Ad I, Shtaif B, Levkovitz Y, et al. Phenothiazines induce apoptosis in a B16 mouse melanoma cell line and attenuate in vivo melanoma tumor growth[J]. Oncol Rep,2006, 15 (1) : 107-12. |
| [23] | Allgayer H. Pdcd4, a colon cancer prognostic that is regulated by a microRNA[J]. Crit Rev Oncol Hematol,2010, 73 (3) : 185-91. DOI: 10.1016/j.critrevonc.2009.09.001. |
 2015, Vol. 35
2015, Vol. 35
