2. 蚌埠医学院第一附属医院检验科, 安徽 蚌埠 233000
2. Department of Laboratory, First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, China
慢性肾脏疾病和糖尿病已经成为全球的公共卫生问题,其国内的患病率已经达到9.4%和9.7%,糖尿病又是慢性肾脏疾病首要病因[1],糖尿病患者中糖尿病肾病(diabetic nephropathy, DN)发病率约为20%~40%,是糖尿病的常见并发症和死亡原因。DN的发病机制复杂,其确切机制尚未明确,目前的研究结果提示代谢紊乱、血流动力学改变、炎性反应机制、细胞因子、氧化应激、遗传因素等多种因素参与了DN的发病[2]。近年来研究提示缺氧在糖尿病肾病发病中占有重要作用,糖尿病大鼠肾组织缺氧诱导因子-lα(hypoxia inducible factor-1α, HIF-1α)表达增加,可通过调控如内皮素-1(endothelin-1, ET-1)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等多种靶基因的转录[3],从而参与糖尿病肾病发生发展。雷公藤是我国的一种传统中药,目前雷公藤的有效成分雷公藤多苷具有很好的控制蛋白尿的作用,作为免疫抑制剂已用于治疗多种原发性及继发性肾小球疾病,雷公藤多苷降低蛋白尿是通过抑制免疫、抗炎症反应、诱导系膜细胞凋亡、保护足细胞等[4],已有研究将其用于糖尿病肾病的临床治疗,证实其免疫抑制及抗炎作用有助拮抗炎症反应在糖尿病肾病发生过程中的不良作用[5]。经文献检索,雷公藤多苷对糖尿病大鼠肾组织HIF-1α及其下游因子ET-1表达的影响研究报道较少。本研究通过链脲佐菌素(STZ)诱导建立糖尿病大鼠模型,观察糖尿病大鼠肾脏组织中HIF-lα及ET-1的表达情况及雷公藤多苷干预后的影响,为雷公藤多苷临床治疗糖尿病肾病提供理论依据。
1 材料与方法 1.1 实验动物雄性SD大鼠60只,8周龄,体质量180~220 g,由蚌埠医学院实验动物中心提供(许可证号:SYXK(皖2012-002),在蚌埠医学院实验动物中心屏障设施内饲养。
1.2 主要仪器多功能暗箱式紫外透射仪:ZF-90型,上海顾村电光仪器厂;荧光定量PCR仪:Applied Biosystems StepOne;GIS凝胶成像分析系统:Tanon GIS-3500;冷冻高速离心机:Eppendorf-5810R,德国;全自动生化分析仪:日本OLYMPUS 5800型;光学显微镜:OLYMPUS显微镜(BX40)。
1.3 主要试剂及药物雷公藤多苷购自上海复旦复华有限公司(国药准字:Z31020415),厄贝沙坦购自赛诺菲(杭州)制药有限公司(国药准字:J20080061),用前以生理盐水配制混悬液;小鼠抗大鼠HIF-lα多克隆抗体购自美国Santa Cruz Biotechnology,兔抗大鼠ET-1多克隆抗体购自北京博奥森生物技术有限公司;STZ:美国Sigma公司;免疫组化试剂盒购自福州迈新生物技术开发有限公司;Western blot相关试剂和RIPA裂解液及BCA蛋白浓度测定试剂盒:江苏碧云天生物研究所公司;引物合成:上海生工生物工程有限公司。逆转录及实时荧光定量试剂盒(SYBR®Premix Ex TaqTM):宝生物工程(大连)有限公司。
1.4 糖尿病模型建立实验动物适应性喂养1周,随机分为2组,其中对照组10只,糖尿病模型组50只。动物模型的建立[6]:糖尿病模型组大鼠给予腹腔注射单剂量链脲佐菌素55 mg/kg体质量,临用前溶于0.1 mol/L低温柠檬酸缓冲液中(pH 4.5);对照组给予腹腔注射同等体积的柠檬酸缓冲液,72 h后取尾静脉取血测定血糖,血糖≥16.7 mmol/L确定为糖尿病大鼠模型成功。50只大鼠中共有48只造模成功。随机将这48只大鼠分为糖尿病组、雷公藤多苷低剂量组8 mg/kg/d、雷公藤多苷高剂量组16 mg/kg/d、厄贝沙坦组50 mg/kg/d各12只。实验观察过程中,动物自由饮水、进食,禁用胰岛素及其他降糖药物。
1.5 标本采集及生化指标检测造模前后及实验期间采用尾静脉采血测量大鼠血糖,雷公藤多苷及厄贝沙坦干预8周后处死大鼠。处死前收集24 h尿,测24 h尿蛋白,全自动生化分析仪测血糖(BG)、血肌酐(Scr)、血尿素氮(BUN)。取左侧肾脏,称量肾脏重量,计算肾重/体重,右侧肾组织部分-70 ℃冻存以备实时荧光定量PCR及Western-blot检测;部分甲醛固定并石蜡包埋切片,以备HE染色病理组织学检查及免疫组织化学染色检查。
1.6 病理组织学观察右侧肾脏组织行HE染色,HE染色切片高倍镜(× 400)每个标本随机选择6个肾小球,显微摄影系统摄取图像,采用Image J图像分析软件测量肾小球面积,6个肾小球面积平均值为此标本平均肾小球面积(mean glomerular area, MGA),并根据公式[7]:平均肾小球体积(mean glomerular volume, MGV)=1.25·[MGA] 3/2,计算平均肾小球体积。免疫组织化学步骤按照SP法试剂盒说明书操作。每个标本随机取6个肾小球视野,光学显微镜下观察肾组织结构形态改变及免疫组化染色结果,采取病理图像分析系统随机测定每样本6个视野(× 400)的灰度值,取其均值,灰度值与HIF 1a及ET-1的蛋白表达成反比。
1.7 实时荧光定量PCR检测肾组织HIF-1α及ET-1mRNA表达采用Trizol一步法提取肾组织总RNA,分光光度计检测总RNA浓度,然后按反转录试剂盒操作要求将逆转录成cDNA。引物设计依据Genebank采用Primer 5.0软件,以β-actin基因序列为内参照物,由上海生工生物工程有限公司合成。HIF-lα引物上游:5'-AAGTCTAGGGATGCAGCACG -3',引物下游:5'-AGATGGGAGCTCACGTTGTG-3',扩增产物长度101 bp;ET-1引物上游:5'-AGTACCATGCAGAAAGG CGT-3';引物下游:5'-CTGATGGCCTCCAACCTTCT-3',扩增产物长度122 bp。内参β-actin引物上游:5'-CACCCGCGAGTACAACCTTC-3',下游:5'-CCCA TACCCACCATCACACC-3',扩增产物长度207 bp。PCR扩增采用20 μl反应体系,反应条件采用两步法:第一阶段(预变性):95 ℃ 30 s,1个循环;第2阶段(PCR反应):95 ℃ 5 s,60 ℃ 30 s,40个循环,每次循环后收集荧光信号生成扩增曲线,反应结束后生成溶解曲线。采用2-△△CT法对数据进行相对定量分析。
1.8 肾组织HIF-1α及ET-1的Western blot分析取100 mg右肾皮质,用RIPA组织裂解液按试剂盒说明提取总蛋白,用BCA法进行蛋白定量并标化,每孔蛋白上样量为100 μg,β-actin作为内参照蛋白。样品加变性缓冲液煮沸10 min。SDS-PAGE凝胶电泳,然后转至PVDF膜。5%脱脂奶粉室温封闭2 h,分别加入一抗HIF-1α、ET-1、β-actin,4 ℃过夜孵育,TBST漂洗10 min× 3次,加入辣根过氧化物酶(HRP)标记的二抗,37 ℃孵育2 h,TBST漂洗10 min×3次,ECL光化学法进行显色。采用凝胶成像系统分析蛋白条带,蛋白的相对含量以目的蛋白吸光度与β-actin条带吸光度的比值表示。
1.9 统计学处理应用SPSS 17.0统计软件对实验数据进行分析,数据以均数±标准差表示,多组间比较采用One-way ANOVA分析,两两比较采用t检验。双变量相关性分析采用Pearson检验。
2 结果 2.1 各组大鼠一般情况及生化指标的比较实验结束时糖尿病对照组、雷公藤多苷低剂量组、厄贝沙坦组各死亡2只大鼠,雷公藤多苷高剂量组死亡1只,实验过程中死亡动物不纳入结果统计。造模后大鼠出现明显多饮、多食及多尿症状,模型组血糖高于正常对照组(P < 0.01),糖尿病组及各治疗组之间血糖无统计学差异;造模8周后各组24 h尿蛋白定量、血肌酐、尿素氮均高于对照组(P < 0.05或P < 0.01),药物干预8周后,各治疗组24 h尿蛋白定量、血肌酐、尿素氮明显低于糖尿病组(P < 0.01),雷公藤多苷高剂量组效果较显著。大鼠各项生化指标的比较见表 1。
| 表 1 各组大鼠生化指标比较 Table 1 Comparison of the biochemical parameters in each group (Mean±SD) |
成模8周糖尿病组肾重/体质量明显高于正常对照组(均P < 0.01),而各干预组肾重/体质量低于糖尿病组但仍高于正常对照组(P < 0.05或P < 0.01)。肾组织HE染色光镜观察及病理图像分析显示,对照组肾小球结构完整,未见肾小球肥大,肾小球基底膜及系膜基质未见明显异常改变,无炎症细胞浸润;糖尿病组表现出明显得肾小球体积增大,系膜细胞增多,基质重度增生,弥漫性分布,部分肾小球大量炎症细胞浸润,并可见肾小管上皮细胞空泡状变性;而各药物治疗组与DM组比较,肾小球体积减小,系膜细胞数减少,系膜基质轻度增生,雷公藤多苷高剂量治疗组病变改善更显著。见表 2及图 1。
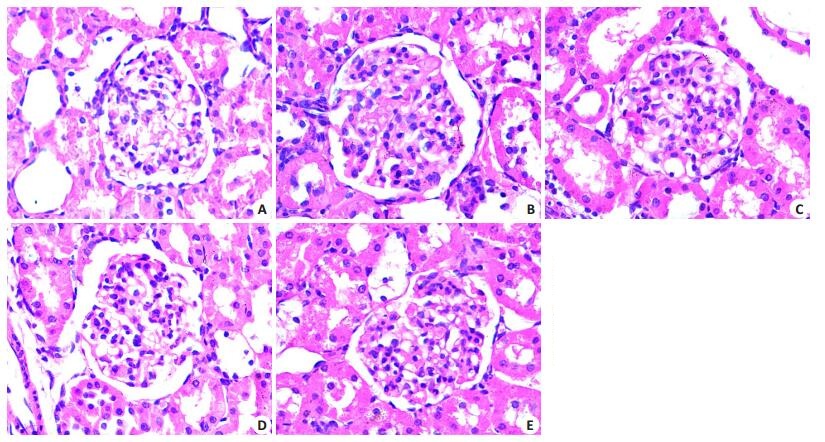
|
图 1 各组大鼠肾组织病理形态学改变 Figure 1 Renal tissue pathology in each group (HE staining, original magnification: × 400). A: Control group; B: DM group; C: Low-dose TG group; D: High-dose TG group; E: Irbesartan group. |
| 表 2 各组大鼠肾脏指数、MGA、MGV及免疫组化结果比较 Table 2 Kidney weight/body weight, MGA, MGV, HIF-1α and ET-1 protein expression detected by immunohistochemistry in the renal tissue in each group (Mean±SD) |
对照组大鼠肾组织有少量HIF-1α及ET-1表达,糖尿病组大鼠HIF-1α及ET-1表达量明显增加,主要表达在肾小管及集合管上皮细胞胞浆,肾小球少量表达,各治疗组HIF-1α及ET-1表达较糖尿病对照组明显减少(P < 0.01),雷公藤多苷与厄贝沙坦具有相似的效应,雷公藤多苷高剂量组效果显著(图 2、3及表 2)。
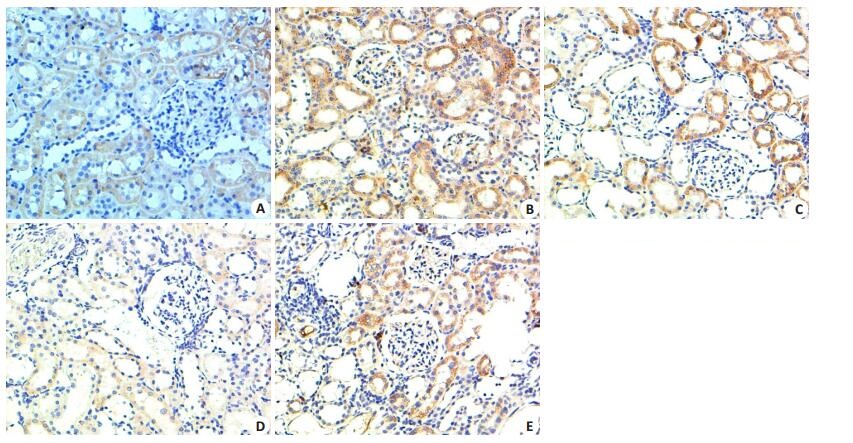
|
图 2 免疫组化法检测各组大鼠肾组织HIF-1α的表达 Figure 2 HIF-1α expression in the kidney tissue in each group detected by immunohistochemistry (Original magnification:× 200). A: Control group; B: DM group; C: Low-dose TG group; D: High-dose TG group; E: Irbesartan group. |
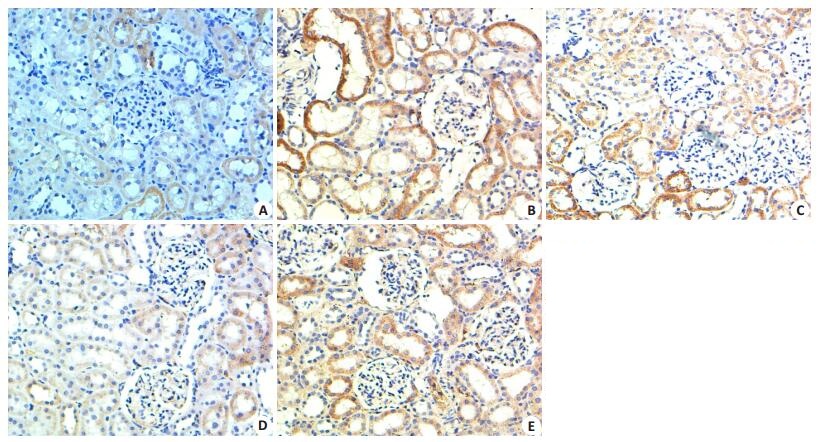
|
图 3 免疫组化法检测各组大鼠肾组织ET-1的表达 Figure 3 ET-1 expression in the kidney tissue in each group detected by immunohistochemistry (Original magnification: × 200). A: Control group; B: DM group; C: Low-dose TG group; D: High-dose TG group; E: Irbesartan group. |
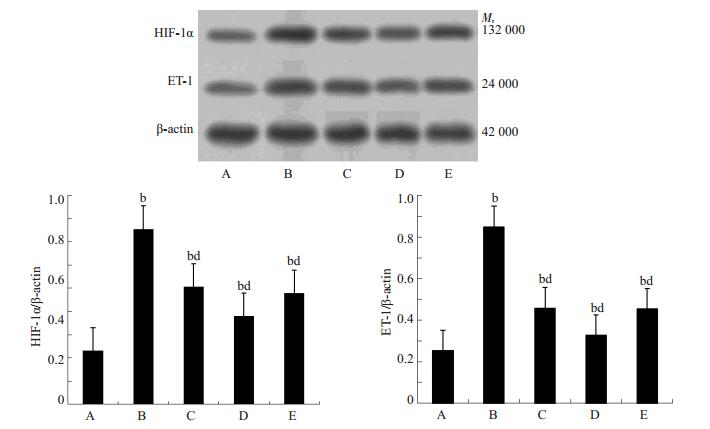
与对照组比较,糖尿病组HIF-1α、ET-1 mRNA及蛋白表达明显升高(P < 0.05或P < 0.01);与糖尿病组比较,各治疗组HIF-1α、ET-1 mRNA及蛋白表达明显降低(P < 0.01),雷公藤多苷高剂量组降低显著(图 4、5)。
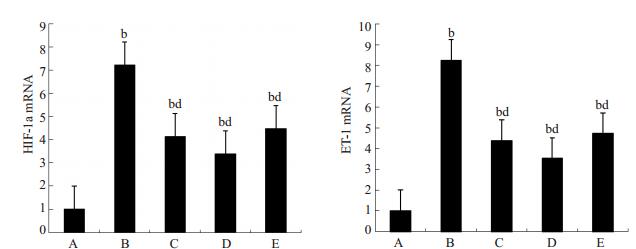
|
图 4 各组大鼠肾组织HIF-1α及ET-1 mRNA表达情况 Figure 4 HIF-1α and ET-1 mRNA expression in the kidney tissue in each group. A: Control group; B: DM group; C: Low-dose TG group; D: High-dose TG group; E: Irbesartan group. bP < 0.01 vs control group, dP < 0.01 vs DM group. |
|
图 5 各组大鼠肾组织HIF-1α及ET-1蛋白表达情况 Figure 5 HIF-1α and ET-1 protein expression in the kidney tissue in each group. A: Control group; B: DM group; C: Low-dose TG group; D: High-dose TG group; E: Irbesartan group. bP < 0.01 vs control group; dP < 0.01 vs DM group. |
相关性分析显示HIF-1α与ET-1 mRNA及蛋白表达呈显著直线正相关,相关系数分别为r=0.939(P < 0.01),r=0.940(P < 0.01),HIF-1α、ET-1 mRNA及蛋白表达与24Upro、KW/BW、MGA、MGV呈显著正相关(表 3)。
| 表 3 HIF-1α及ET-1表达与24 h Upro、KW/BW、MGA、MGV相关性分析 Table 3 Correlation analysis of HIF-1α and ET-1 expression with 24 h Upro, KW/ BW, MGA, MGV |
随着生活水平提高及生活方式的转变,中国2型糖尿病(type 2 diabetes mellitus, T2DM)患病率显著上升,已成为主要的公共健康问题之一[8]。糖尿病肾病是糖尿病患者最常见而严重的并发症,是导致终末期肾病(ESRD)的主要原因,近年来患病率逐渐上升。DN的特点为肾小球肥大、基底膜增厚、肾小球滤过屏障受损、肾小球基质增生,晚期发生肾小球硬化、肾小管间质纤维化、进展性蛋白尿及肾衰竭。金波等研究资料表明本世纪初DN在同期肾活检患者中的比例较上世纪末增长1.68倍[9],DN是我国慢性肾脏病第二位病因,也是导致慢性肾衰竭的常见病因。DN的具体发生机制尚不完全清楚,近年来研究表明许多因素涉及DN的发生机制,包括蛋白尿、遗传、种族、细胞信号转导异常、炎症反应及缺氧、缺血等[10]。
近年来,有研究提出“慢性缺氧”是慢性肾脏病进展至终末期肾病的最终共同通路[11]。糖尿病肾病是糖尿病表现在肾脏局部的微血管病变,慢性缺氧和微血管病变在进展性肾脏疾病中的重要性日渐受到重视,主要集中在微血管病变和小管间质慢性缺氧损伤及纤维化的关系上,微血管内皮细胞的损伤和修复。HIF-1α是一类介导缺氧适应性反应的转录因子,能激活许多缺氧反应性基因的表达,ET-1作为HIF-1α重要靶基因之一,在病理状态下介导肾脏损伤的途径除了其具有强大的血管收缩作用外,还通过参与肾小管上皮细胞转分化促进肾间质纤维化[12]。袁明霞等研究发现,糖尿病肾病大鼠肾组织HIF-1α表达上调,糖尿病肾组织存在慢性缺氧[13]。Rosenberger等发现糖尿病肾病大鼠早期即出现局部缺氧及缺氧适应性反应,伴有HIF-1α及其目的基因表达增加[14],从而促进糖尿病肾病的发生发展。HIF-1α在早期糖尿病大鼠肾脏中表达上调,其表达变化与糖尿病大鼠肾脏病变发生发展相关。细胞凋亡也参与了早期DN的发生发展,HIF-1α可诱导细胞凋亡增加,从而促进DN的发展[15]。本实验通过STZ诱导糖尿病大鼠,成模8周后糖尿病组大鼠血糖增高,尿量增加,尿蛋白定量大于30 mg/24 h,具有糖尿病肾病的特征,免疫组化及实时荧光定量PCR、Western blot检测显示肾组织HIF-1α及ET-1表达增加,HIF-1α表达与ET-1表达呈正相关,此外,HIF-1α及ET-1的表达与肾重指数、肾小球体积、肾小球面积、尿蛋白定量呈正相关,表明早期糖尿病肾病存在缺氧,HIF-1α可通过调节ET-1的表达参与糖尿病肾病的病理生理过程。
雷公藤是我国的一种传统中药,具有抗炎,调节免疫的作用。雷公藤的有效成分雷公藤多苷现已广泛用于治疗原发性肾小球肾炎及免疫相关性肾炎,疗效确切。部分用于糖尿病肾病临床研究证实其特有的免疫抑制及抗炎症作用可拮抗炎症反应在糖尿病肾病发生发展过程中的不良效应,雷公藤多苷能够有效降低糖尿病肾病患者尿蛋白,延缓肾功能进展,疗效优于ARB,且不良反应少,耐受良好,是治疗DN的有效药物[5]。同时作者研究在DN发展过程中,血清转化生长因子-βl、Gremlin促进肾间质纤维化,骨形态发生蛋白-7可抑制肾间质纤维化,雷公藤多苷能够减少尿蛋白的排泄,保护肾小管,抑制转化生子因子-β1、Gremlin上升及骨形态发生蛋白-7下降趋势,改善DN患者肾间质纤维化[16]。动物实验证实雷公藤多苷能减少糖尿病肾病大鼠尿蛋白排泄量,抑制肾脏肥大并减轻其纤维化程度,明显改善肾脏功能[17]。作者前期研究发现,雷公藤多苷对糖尿病肾病具有保护作用,与改善氧化应激状态及MCP-1的表达有关,不同剂量雷公藤多苷对糖尿病肾病的干预效果不同,双倍剂量的雷公藤多苷效果更显著[18]。本研究通过雷公藤多苷干预糖尿病大鼠,8周后雷公藤多苷干预组肾组织HIF-1α及其下游因子ET-1表达降低,平均肾小球面积及平均肾小球体积、肾组织病理学改善,尿蛋白定量均较糖尿病组明显好转。
综上所述,雷公藤多苷对糖尿病大鼠肾脏病变具有保护作用,部分作用机制与下调HIF-1α及其下游因子ET-1的表达有关,为雷公藤多苷治疗糖尿病肾病提供理论依据。
| [1] | 严晋华, 夏旋, 朱延华, 等. 复方血栓通胶囊对糖尿病肾病大鼠肾脏保护作用的机制初探[J]. 中华医学杂志,2012, 92 (30) : 2099-103. |
| [2] | Duran-Salgado MB, Rubio-Guerra AF. Diabetic nephropathy and inflammation[J]. World J Diabetes,2014, 5 (3) : 393-8. DOI: 10.4239/wjd.v5.i3.393. |
| [3] | Xu X, Chen P, Zheng Q, et al. Effect of pioglitazone on diabetic nephropathy and expression of HIF-1α and VEGF in the renal tissues of type 2 diabetic rats[J]. Diabetes Res Clin Pract,2011, 93 (1) : 63-9. DOI: 10.1016/j.diabres.2011.03.019. |
| [4] | 盛梅笑, 孙伟, 邢昌赢, 等. 益肾清利颗粒联合低剂量雷公藤多苷片治疗慢性原发性肾小球疾病肾虚湿热证疗效观察[J]. 中国中西医结合杂志,2013, 33 (12) : 1636-41. |
| [5] | 葛永纯, 谢红浪, 李世军, 等. 雷公藤多苷治疗糖尿病肾病的前瞻性随机对照临床试验[J]. 肾脏病与透析肾移植杂志,2010, 19 (6) : 501-7. |
| [6] | 唐杰龙, 沈洁, 刘帅, 等. 厄贝沙坦对糖尿病大鼠早期肾脏组织结构影响的剂量相关性初探[J]. 南方医科大学学报,2010, 30 (5) : 1066-8. |
| [7] | Ota T, Takamura T, Ando H, et al. Preventive effect of cerivastatin on diabetic nephropathy through suppression of glomerular macrophage recruitment in a rat model[J]. Diabetologia,2003, 46 (6) : 843-51. DOI: 10.1007/s00125-003-1099-3. |
| [8] | Yang WY, Lu JM, Weng JP, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med,2010, 362 (12) : 1090-101. DOI: 10.1056/NEJMoa0908292. |
| [9] | 金波, 刘志红, 葛永纯, 等. 肾活检患者中糖尿病肾病流行病学特点的变迁[J]. 肾脏病与透析肾移植杂志,2009, 18 (2) : 133-9. |
| [10] | Fernández Fernández B, Elewa U, Sánchez-Niño MD, et al. 2012 update on diabetic kidney disease: the expanding spectrum, novel pathogenic insights and recent clinical trials[J]. Minerva Med,2012, 103 (4) : 219-34. |
| [11] | Nangaku M. Chronic hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure[J]. J Am Soc Nephrol,2006, 17 (1) : 17-25. |
| [12] | 唐琳, 李慧, 张娜娜, 等. 缺氧诱导因子1α调控内皮素1表达在高糖诱导肾小管上皮细胞转分化中的作用[J]. 中华肾脏病杂志,2013, 29 (5) : 375-7. |
| [13] | 袁明霞, 唐荣, 周巧玲, 等. 冬虫夏草对糖尿病肾病大鼠肾组织HIF-1α及VEGF表达的影响[J]. 中南大学学报:医学版,2013, 38 (5) : 448-57. |
| [14] | Rosenberg C, Khamaisi M, Abassi Z, et al. Adaptation to hypoxia in the diabetic rat kidney[J]. Kidney Int,2008, 73 (1) : 34-42. DOI: 10.1038/sj.ki.5002567. |
| [15] | 颜晓勇, 陆清竹, 吴蔚桦, 等. 早期糖尿病大鼠肾脏中HIF-1α表达和细胞凋亡的研究[J]. 天津医药,2011, 39 (10) : 951-4. |
| [16] | 张燕, 吴永贵. 雷公藤多苷对糖尿病肾病患者血清TGF-β1、BMP-7、Gremlin的影响[J]. 安徽医学,2012, 33 (12) : 1616-9. |
| [17] | 常景芝, 王琛, 沈永杰, 等. 雷公藤多苷对糖尿病大鼠肾脏病变影响的实验研究[J]. 时珍国医国药,2012, 23 (12) : 3043-4. |
| [18] | 张继强, 陈卫东, 张海峰, 等. 不同剂量雷公藤多苷对早期糖尿病肾病大鼠肾脏MDA、SOD及MCP-1表达的影响[J]. 中华肾脏病杂志,2013, 29 (7) : 534-5. |
 2015, Vol. 35
2015, Vol. 35