甲状旁腺素(parathyroid hormone, PTH)是目前应用于临床的唯一促骨形成药物[1]。它可以有效增加骨量,治疗骨质疏松及骨质疏松性骨折、关节假体松动以及二磷酸盐长期使用引起的非典型骨折等[2-6]。PTH作用于Ⅰ型PTH受体(PTHR1)可激活多条信号转导途径:(1)Gs/cAMP/PKA信号转导通路,目前认为是PTH作用于骨组织的主要机制[7-8];(2)PLC/PKC通路[9];(3)非PLC依赖PKC激活途径(PTH/nonPLC/PKC)[10];(4)β-arrestin通路等[11-12]。我们的前期研究揭示,PTH经nonPLC/PKC通路,能够促进受力区松质骨合成,促进新骨形成,具有一定通路选择性的PTH模拟肽具有较PTH更好的促骨合成特性和改善骨微结构的功能[8]。并且发现N端的第29-34位氨基酸为激活nonPLC/PKC信号通路的关键区域[8, 13-14]。但是该区域的生物学功能不清楚。GR(1-28)和GR(1-34)是PTH的两个信号选择性模拟肽,前者被认为是cAMP/PKA特异性刺激分子,后者兼具cAMP/PKA和非PLC依赖的PKC激活功能。我们曾经尝试比较GR(1-28)和GR(1-34)引起成骨细胞基因表达谱的差异分析PTH(29-34)蛋白结构域的功能,未能获得确实的结果,其原因可能与cAMP/ PKA功能显著掩盖其他信号的功能有关。本实验在前述基因表达谱分析的基础上,使用拮抗因子屏蔽cAMP/ PKA信号途径,筛选和核实nonPLC/PKC信号通路的效应基因,以期获得满意的靶基因,助于分析PTH(29-34)的相关功能。
1 材料和方法 1.1 实验动物及主要试剂、仪器新生2~3日龄C57BL乳鼠10只,体质量2.0~2.5 g,雌雄不限,购自南方医科大学实验动物中心。
模拟肽PTH(1-34), GR(1-28)和GR(1-34)由广州特立生物科技有限公司合成;MC3T3-E1细胞购自上海细胞库;Ⅰ、Ⅱ型胶原酶、RP-cAMP购自美国Sigma公司;Go6983购于美国Selleck公司;α-MEM培养基、FBS、青-链霉素双抗购自美国GIBCO公司;Trizol、RT-PCR试剂盒、SYBR®Premix Ex TaqTM(Perfect Real Time)试剂盒购自日本Takara公司;ALP染色试剂盒购自上海碧云天生物技术有限公司;相关引物购自上海英潍捷基贸易有限公司;显微镜为日本Olympus公司IX71倒置相差显微镜;细胞培养箱为美国Galaxy公司;美国ABI7500实时定量荧光PCR仪。
1.2 方法 1.2.1 乳鼠成骨细胞分离培养及鉴定取2~3 d C57BL乳鼠10只,75%乙醇浸泡消毒,在α-MEM培养基中漂洗后;无菌条件下剪下头部,用镊子撕开头皮,剪下颅骨,放入α-MEM培养基中。用镊子和剪刀仔细去除颅骨上残余的结缔组织和周围硬化骨,置入6孔板中,加入少许α-MEM培养基;将组织剪成0.5 mm×0.5 mm×0.5 mm大小,加入2 mL 0.1%胶原酶(Ⅰ、Ⅱ型胶原酶比例为1: 3),37 ℃以150 r/min震荡消化20 min,如此5次重复消化,丢弃第1次消化后上清液,于冰上收集剩余4次上清液,加入5 ml含10% FBS的α-MEM培养基,1200×g离心5 min;弃上清,加入4 ml 10% FBS(含100 U/ml青霉素和100 μg/mL链霉素),吹打混匀,接种于细胞培养瓶[15-16],置于37 ℃、5% CO2培养箱中培养。3 d后换液,7 d后细胞长满培养瓶底部,PBS漂洗3遍,0.25%胰蛋白酶消化,以1 ×105/cm2接种于6孔板。倒置相差显微镜观察原代及传1代后细胞的形态学变化。
取部分接种于6孔板中的原代细胞进行鉴定:① ALP染色:成骨诱导培养液(10% FBS、50 μg/ml维生素C、100 mmol/L β-甘油磷酸钠)培养14 d时,取部分细胞PBS冲洗3遍,按照ALP染色试剂盒说明行ALP染色,阳性细胞质为蓝色;②茜素红染色:成骨诱导培养液培养,每3 d换液,28 d时以PBS冲洗3遍,4%多聚甲醛固定,0.1%茜素红37 ℃孵育30 min,观察红色钙结节的形成。
1.2.2 原代成骨细胞分组及模拟肽干预取接种于6孔板的第1代细胞,待细胞长满后,将10% FBS换为1% FBS维持培养12 h,然后随机分为4组:PTH(1-34)组加入10 nmol/L PTH(1-34);GR(1-28)和GR(1-34)组加入10 nmol/L RP-cAMP(cAMP阻断剂)1.5 h后分别加入100 nmol/L GR(1-28)和10 nmol/L GR(1-34);空白对照组加入等体积的0.1% TFA(PTH模拟肽溶解于0.1% TFA)[8, 10, 16]。每组重复3次。
1.2.3 基因芯片检测原代培养成骨细胞经信号选择性PTH模拟肽作用4 h后,采用Trizol法提取4组细胞总RNA。质检合格后各组RNA行小鼠全基因组表达谱芯片(Affymetrix)分析,4张芯片的信号数据进行归一化处理后,进行统计学分析。
1.2.4 MC3T3-E1细胞培养及模拟肽干预小鼠成骨前细胞MC3T3-E1培养于含10%胎牛血清、双抗(青霉素100 U/ml+链霉素100 μg/ml)的α-MEM培养液,置于37 ℃、5% CO2饱和湿度培养箱培养。以1×105个/cm2接种于6孔板。
待接种于6孔板的MC3T3-E1细胞长满后,将10% FBS换为1%FBS维持培养12 h,然后随机分为4组:GR(1-34)+PKCi组同时加入10 nmol/L RP-cAMP和100 nmol/L Go6983(PKC抑制剂,PKCi)1.5 h后加入10 nmol/L GR(1-34);GR(1-28)和GR(1-34)组加入10 nmol/L RP-cAMP 1.5 h后分别加入100 nmol/L GR(1-28)和10 nmol/L GR(1-34);空白对照组加入等体积的0.1% TFA[15]。每组重复3次。
1.2.5 RT-PCR检测根据全基因组表达谱芯片结果筛选出与PTH的nonPLC/PKC信号通路相关性最高的若干基因,根据目的基因在PubMed中的已知序列,利用Primer5设计软件,由上海英潍捷基贸易公司合成引物(表 1)。
| 表 1 引物序列表 Table 1 Sequences of the PCR primers |
原代成骨细胞及MC3T3-E1细胞各组经信号选择性PTH模拟肽作用4 h后,Trizol法分别提取各组总RNA,按照说明书用RT-PCR试剂盒反转录为cDNA,使用ABI7500实时荧光定量PCR仪进行SYBR实时定量PCR反应,采用2-ΔΔCt法计算mRNA相对表达量。
1.3 统计学分析所有数据采用SPSS 13.0统计软件包进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用LSD检验;检验水准α=0.05。
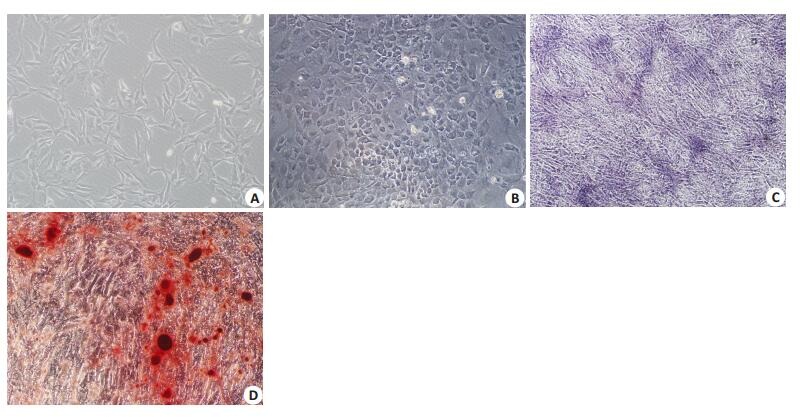
2 结果 2.1 原代成骨细胞形态学观察及鉴定倒置相差显微镜下观察原代细胞,大多数细胞成梭形、三角形或多边形(图 1A)。传代后细胞形态较均一,呈梭形或多边形。待细胞长满后,见细胞排列紧密,呈铺路石状(图 1B)。成骨诱导培养14 d,细胞呈复层生长,行ALP染色,镜下显示胞质中出现蓝色颗粒(图 1C)。培养28 d行茜素红染色,镜下显示出现阳性矿化结节(图 1D)。
|
图 1 成骨细胞形态学观察及鉴定 Figure 1 Morphological observation and identification of the osteoblasts (Original magnification: ×200). A: Primary osteoblasts at 7 days; B: Osteoblasts at 5 days after the first passage; C: ALP staining of the osteoblasts at 14 days; D: Alizarin red staining of the osteoblasts at 28 days. |
基因芯片结果显示,GR(1-28)和GR(1-34)组在约2万6千个基因中,有549个基因表达量存在较显著差异(差异在2倍以上)(表 2),经过进一步分析,我们挑选出了与PTH的nonPLC/PKC信号通路相关性最高的56个基因(表 3),作为RT-PCR筛选验证的基因对象。
| 表 2 实验组与空白对照组的表达差异基因 Table 2 Number of differentially expressed genes between the treated and control cells |
| 表 3 筛选基因对象 Table 3 Differentially expressed genes identified and verified |
同时,我们根据各组间的差异表达基因,进行了相关通路分析,得到了依据相关系数排序的最可能与PTH的nonPLC/PKC信号转导途径相关的14条信号通路(表 4)。
| 表 4 与 PTH的nonPLC/PKC信号转导途径相关的表达差异基因相关通路分析 Table 4 Pathway analysis of the differentially expressed genes related to non-PLC/PKC signaling pathway of PTH |
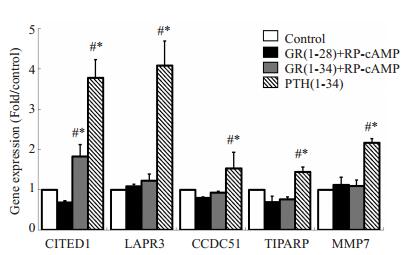
原代成骨细胞4组经模拟肽作用4 h后,筛选的56个基因中,CITED1的表达量PTH(1-34)组明显高于其他各组,且GR(1-34)组显著高于GR(1-28)组,PTH(1-34)与GR(1-34)组均显著高于空白对照组(图 2)。LAPR3、CCDC51、TIPARP、MMP7等某些基因的表达量PTH(1-34)组显著高于其他各组,这些基因可能受PTH的其他信号通路的调控(图 2)。
|
图 2 原代成骨细胞的RT-PCR检测结果 Figure 2 RT-PCR results of primary osteoblasts. The expression of CITED1 in GR (1-34) + RP-cAMP group was significantly higher than that in control group and GR (1-28) + RP-cAMP group (P < 0.05), but lower than that in PTH (1-34) group (P < 0.05). The expression of LAPR3, CCDC51, TIPARP, and MMP7 was higher in PTH (1-34) group than in the other groups (P < 0.05). *P < 0.05 vs control group; #P < 0.05 vs GR (1-28) group. |
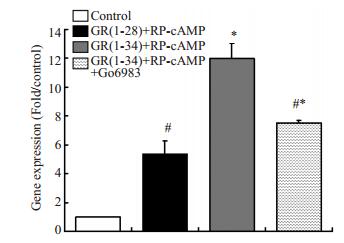
MC3T3-E1细胞经各组模拟肽刺激后,CITED1表达量GR(1-34)组仍显著高于GR(1-28)组,与原代成骨细胞实验结果一致,且在加入PKC抑制剂(Go6983)后,CITED1表达量明显下降(图 3),证实CITED1表达量的升高由nonPLC/PKC通道激活引起,不依赖PLC及PKA的激活。
|
图 3 MC3T3-E1的RT-PCR验证结果 Figure 3 RT-PCR results of MC3T3-E1 cells. The results of RT-PCR of MC3T3-E1 cells were consist with those in primary osteoblasts. The expression of CITED1 was significantly decreased after intervention with Go6983. *P < 0.05 vs GR (1-28) group; #P < 0.05 vs GR (1-34) +RP-cAMP group. |
PTH是体内重要的骨钙代谢调节激素,也是目前应用于临床的唯一促骨形成药物,人体中天然的PTH由84个氨基酸构成[PTH(1-84)],与Ⅰ型PTH受体(PTHR1)结合。N端的34个氨基酸残基[PTH(1-34)]具有与PTH(1-84)相同的PTHR1结合和激活功能。大量研究表明,PTH对骨组织的作用是双向的,即间断小剂量促进骨形成,连续大剂量促进骨吸收。PTH对骨组织的作用主要通过与成骨细胞表面的PTHR1结合,激活PTHR1及其下游的多个信号途径实现的[17]。正如前言中所介绍,PTHR1被激活后具有不同的信号转导功能,其中Gs/cAMP/PKA信号转导通路,现被认为是PTH作用于骨组织代谢的主要机制[7-8]。目前认为,PTHR1受体至少通过两种途径激活PKC,其一为激活PLC,PLC催化磷脂酰肌醇4, 5-二磷酸(PIP2)分子水解成磷酸肌醇(IP)和二酰基甘油(DAG),引起胞内钙离子的释放,进而激活PKC,此途径为PKC激活的经典途径。另一途径为不依赖PLC的PKC激活途径(nonPLC/PKC),其具体信号特征及骨代谢功能并不清楚。Jouishomme等[13-14]报道PTH(29-34)(不激活cAMP/PKA和PLC)激活ROS17/2.8细胞膜PKC,而PTH(1-34)(可激活cAMP/PKA)没有如此作用,提示PTH/nonPLC/PKC信号通路的存在。我们的前期研究也揭示,甲状旁腺激素29-34位蛋白结构域(PTH(29-34))介导PTH/nonPLC/PKC信号通路的激活[8],PTH经nonPLC/PKC通路,提升松质骨骨量,改善骨小梁微结构[9, 18]。有nonPLC/PKC信号途径选择功能的PTH模拟肽能显著促进脊柱融合[19]。但是nonPLC/ PKC通路的具体信号中介分子仍不清楚,其对于骨代谢的作用机制仍需要深入研究。本实验中我们利用原代培养的乳鼠成骨细胞分别加入信号选择性甲状旁腺素模拟肽PTH(1-34),GR(1-28)和GR(1-34),随后行小鼠全基因组表达谱芯片分析,筛选出可能的nonPLC/PKC通路的功能基因,经RT-PCR筛选并核实,发现CITED1是nonPLC/PKC通路的效应基因之一。并经MC3T3-E1细胞证实nonPLC/PKC通路的激活能够使得成骨细胞CITED1表达量显著升高,该途径不依赖PLC和PKA信号的激活。
为了研究PTH/nonPLC/PKC通路对成骨细胞的作用,排除其他信号通路对于实验结果的影响,一方面,我们设计了两种信号选择性甲状旁腺素模拟肽GR(1-28)和GR(1-34)。研究证实,改变PTH的N端氨基酸残基能改变PTH的信号转导特征,如Ser1变成Gly1使PTH(1-34)大幅度(1000倍以上)失去激活PLC信号的特性[10, 20-21];Glu19变成Arg19能够补偿29-34氨基酸残基缺失引起的受体结合力减弱[8, 16, 22];而PTH(29-34)区域是介导PTH/nonPLC/PKC通路的关键区域[8],因此GR(1-28)可激活Gs/cAMP/PKA通路,而失去了激活PLC和nonPLC/PKC的能力,GR(1-34)可激活Gs/cAMP/ PKA及nonPLC/PKC通路,而不能激活PLC。另一方面,由于nonPLC/PKC通路的分子机制并不清楚,而Gs/ cAMP/PKA信号转导通路被认为是主要作用通路,不能排除cAMP/PKA参与介导nonPLC/PKC通路的可能。所以我们在加入G1R19(1-28)和G1R19(1-34)前1.5h加入Gs/cAMP/PKA通路阻滞剂(RP-cAMP),抑制此条通路的激活,排除其对nonPLC/PKC通路作用的影响。
本实验中我们发现PTH的nonPLC/PKC通路的激活能够使得成骨细胞CITED1的表达量明显升高,且该途径不依赖PLC和PKA信号的激活。目前CITED1的研究领域主要集中于甲状腺癌、黑色素瘤、肾母细胞瘤及肾脏等器官发育方面,其对于骨代谢影响的研究较少。CITED1原称黑色素特异基因1(MSG1),为核蛋白[23],定位于X染色体[24]。CITED家族包括4种核蛋白:CITED1,CITED2,CITED3,CITED4,CITED家族基因与DNA结合区域相结合后,可启动转录。CITED家族都含有一高度保守序列,CR2区域,且具有强转录激活活性,然而,CITED家族本身无的DNA结合区域。而不含DNA结合区域的转录激活因子与特定序列的DNA结合蛋白相互作用后,可促进共转录因子CITED1的转录激活。CITED1与CBP/P300形成复合物后,在Smad4的介导下,可促进TGF的表达,热休克蛋白HSP70可竞争性地与CITED1结合抑制该过程[25-26]。我们之前的研究发现,CITED1在成骨细胞中表达,PTH间断使用可使其表达量显著增高,cAMP/PKA通路的激活可能起主要作用,PKC通路的激活也参与其中。成骨细胞在CITED1敲除后增值能力没有改变但体外分化成骨能力增强[15, 27]。我们本次实验结果显示,成骨细胞受PTH(1-34)刺激后,CITED1的表达量明显升高,当抑制cAMP/PKA通路后,其表达量明显下降(图 2),表明cAMP/PKA通路激活可增强成骨细胞CITED1的表达,与前期的研究结果相一致。且我们发现nonPLC/PKC通路的激活能够使得成骨细胞CITED1表达量显著升高,对之前的研究进行了补充,一方面,更加深入的研究了成骨细胞中调控CITED1表达的信号转导机制,另一方面,揭示了PTH的nonPLC/PKC通路的部分功能,至少其通过调节CITED1的表达参与骨组织代谢的过程,而之前尚未有研究证实此通路的骨代谢功能。另外,在阻断cAMP/PKA通路后GR(1-28)亦可增强成骨细胞CITED1的表达(图 3),其具体机制仍不清楚,需进一步研究,但也由此表明成骨细胞CITED1的表达受多条信号转导通路的共同调节。Yang等[15]提出CITED1可能是PTH充当成骨作用的负反馈抑制剂,进一步研究表明,CITED1可能为cAMP/PKA信号通路的特异性抑制剂,抑制成骨细胞的成骨作用及PTH的成骨作用。结合我们本次的实验结果,我们提出这样的假设,nonPLC/PKC通路的激活可能对cAMP/PKA信号通路有负反馈抑制作用。这两条信号转导通路之间的相互作用仍需要进一步的研究。另外CITED1参与众多恶性肿瘤的发生、发展过程,其与骨组织肿瘤的关系有待于进一步的发掘。
总之,CITED1具有调节骨组织代谢的作用,并参与PTH对骨代谢的调节。然而,CITED1调节的分子机制仍不清楚,其与信号转导通路的关系仍需要进一步研究。我们的研究首次发现了CITED1与nonPLC/PKC通路的关系十分密切,nonPLC/PKC通路的激活能够使得成骨细胞CITED1的表达量显著增高,且CITED1可能受多条信号通路的共同调节。这为下一步研究PTH的nonPLC/PKC通路的分子机制和功能,设计和研究新的基于PTH结构的效果更好的成骨药物提供了理论支持。
| [1] | Deal C. Potential new drug targets for osteoporosis[J]. Nat Clin Pract Rheumatol,2009, 5 (1) : 20-7. DOI: 10.1038/ncprheum0977. |
| [2] | Pennisi A, Ling W, Li X, et al. Consequences of daily administered parathyroid hormone on myeloma growth, bone disease, and molecular profiling of whole myelomatous bone[J]. PLoS One,2010, 5 (12) : e15233. DOI: 10.1371/journal.pone.0015233. |
| [3] | Kraenzlin ME, Meier C. Parathyroid hormone analogues in the treatment of osteoporosis[J]. Nat Rev Endocrinol,2011, 7 (11) : 647-56. DOI: 10.1038/nrendo.2011.108. |
| [4] | Tseng YY, Su CH, Lui TN, et al. Prospective comparison of the therapeutic effect of teriparatide with that of combined vertebroplasty with antiresorptive agents for the treatment of new-onset adjacent vertebral compression fracture after percutaneous vertebroplasty[J]. Osteoporos Int,2012, 23 (5) : 1613-22. DOI: 10.1007/s00198-011-1730-y. |
| [5] | Oteo-Alvaro A, Matas JA, Alonso-Farto JC. Teriparatide (rh {[} 1-34] PTH) improved osteointegration of a hemiarthroplasty with signs of aseptic loosening[J]. Orthopedics,2011, 34 (9) : E574-7. |
| [6] | Zati A, Sarti D, Malaguti MC, et al. Teriparatide in the treatment of a loose hip prosthesis[J]. J Rheumatol,2011, 38 (4) : 778-80. |
| [7] | Wang J, Gilchrist A, Stern PH. Antagonist minigenes identify genes regulated by parathyroid hormone through G protein-selective and G protein co-regulated mechanisms in osteoblastic cells[J]. Cell Signal,2011, 23 (2) : 380-8. DOI: 10.1016/j.cellsig.2010.10.008. |
| [8] | Yang D, Guo J, Divieti P, et al. Parathyroid hormone activates PKC-delta and regulates osteoblastic differentiation via a PLC-independent pathway[J]. Bone,2006, 38 (4) : 485-96. DOI: 10.1016/j.bone.2005.10.009. |
| [9] | Guo J, Liu M, Yang D, et al. Phospholipase C signaling via the parathyroid hormone (PTH)/PTH-related peptide receptor is essential for normal bone responses to PTH[J]. Endocrinology,2010, 151 (8) : 3502-13. DOI: 10.1210/en.2009-1494. |
| [10] | Yang D, Singh R, Divieti P, et al. Contributions of parathyroid hormone (PTH)/PTH-related peptide receptor signaling pathways to the anabolic effect of PTH on bone[J]. Bone,2007, 40 (6) : 1453-61. DOI: 10.1016/j.bone.2007.02.001. |
| [11] | Klenk C, Vetter T, Zürn A, et al. Formation of a ternary complex among NHERF1, beta-arrestin, and parathyroid hormone receptor[J]. J Biol Chem,2010, 285 (39) : 30355-62. DOI: 10.1074/jbc.M110.114900. |
| [12] | Datta NS, Abou-Samra AB. PTH and PTHrP signaling in osteoblasts[J]. Cell Signal,2009, 21 (8) : 1245-54. DOI: 10.1016/j.cellsig.2009.02.012. |
| [13] | Jouishomme H, Whitfield JF, Gagnon L, et al. Further definition of the protein kinase C activation domain of the parathyroid hormone[J]. J Bone Miner Res,1994, 9 (6) : 943-9. |
| [14] | Jouishomme H, Whitfield JF, Chakravarthy B, et al. The protein kinase-C activation domain of the parathyroid hormone[J]. Endocrinology,1992, 130 (1) : 53-60. |
| [15] | Yang DH, Guo J, Divieti P, et al. CBP/p300-interacting protein CITED1 modulates parathyroid hormone regulation of osteoblastic differentiation[J]. Endocrinology,2008, 149 (4) : 1728-35. DOI: 10.1210/en.2007-0826. |
| [16] | 冯瑞强, 江建明, 李俊青, 等. 信号选择性甲状旁腺素模拟肽成骨效应的Wnt信号通路研究[J]. 中国修复重建外科杂志,2012 (4) : 472-6. |
| [17] | Gensure RC, Gardella TJ, Jüppner H. Parathyroid hormone and parathyroid hormone-related peptide, and their receptors[J]. Biochem Biophys Res Commun,2005, 328 (3) : 666-78. DOI: 10.1016/j.bbrc.2004.11.069. |
| [18] | 李俊青, 江建明, 冯瑞强, 等. 蛋白激酶C激活的荧光共振能量转移分析[J]. 南方医科大学学报,2011, 31 (11) : 1867-70. |
| [19] | Vilardaga JP, Romero G, Friedman PA. Molecular basis of parathyroid hormone receptor signaling and trafficking: a family B GPCR paradigm[J]. Cell Mol Life Sci,2011, 68 (1) : 1-13. DOI: 10.1007/s00018-010-0465-9. |
| [20] | Kondo H, Guo J, Bringhurst FR. Cyclic adenosine monophosphate/ protein kinase A mediates parathyroid hormone/parathyroid hormone-related protein receptor regulation of osteoclastogenesis and expression of RANKL and osteoprotegerin mRNAs by marrow stromal cells[J]. J Bone Miner Res,2002, 17 (9) : 1667-79. DOI: 10.1359/jbmr.2002.17.9.1667. |
| [21] | Cupp ME, Nayak SK, Adem AS, et al. Parathyroid hormone (PTH) and PTH-Related peptide domains contributing to activation of different PTH Receptor-Mediated signaling pathways[J]. J Pharmacol Exp Ther,2013, 345 (3) : 404-18. DOI: 10.1124/jpet.112.199752. |
| [22] | Takasu H, Gardella TJ, Luck MD, et al. Amino-terminal modifications of human parathyroid hormone (PTH) selectively alter phospholipase C signaling via the type 1 PTH receptor: implications for design of signal-specific PTH ligands[J]. Biochemistry,1999, 38 (41) : 13453-60. DOI: 10.1021/bi990437n. |
| [23] | Shioda T, Fenner MH, Isselbacher KJ. msg1, a novel melanocytespecific gene, encodes a nuclear protein and is associated with pigmentation[J]. Proc Natl Acad Sci USA,1996, 93 (22) : 12298-303. DOI: 10.1073/pnas.93.22.12298. |
| [24] | Fenner MH, Parrish JE, Boyd Y, et al. MSG1(melanocyte-specific gene 1): mapping to chromosome Xq13.1, genomic organization, and promoter analysis[J]. Genomics,1998, 51 (3) : 401-7. DOI: 10.1006/geno.1998.5383. |
| [25] | Yahata T, De Caestecker MP, Lechleider RJ, et al. The MSG1 non-DNA-binding transactivator binds to the p300/CBP coactivators, enhancing their functional Link to the Smad transcription factors[J]. J Biol Chem,2000, 275 (12) : 8825-34. DOI: 10.1074/jbc.275.12.8825. |
| [26] | Shioda T, Lechleider RJ, Dunwoodie SL, et al. Transcriptional activating activity of Smad4: roles of SMAD heterooligomerization and enhancement by an associating transactivator[J]. Proc Natl Acad Sci U S A,1998, 95 (17) : 9785-90. DOI: 10.1073/pnas.95.17.9785. |
| [27] | 林振, 袁亮, 孟越, 等. CITED163-84氨基酸片段是影响其细胞定位与成骨作用的关键区域[J]. 南方医科大学学报,2013, 33 (3) : 326-31. |
 2015, Vol. 35
2015, Vol. 35
