2. 广州市红十字会医院肿瘤科,广东 广州 510220
2. Department of Oncology, Guangzhou Red Cross Hospital, Guangzhou 510220, China
肺癌是发病率及病死率较高的恶性肿瘤,2008年全球新发肺癌病例数高达161万,占所有新发癌症患者的12.7%,位居首位[1]。2012年,因肺癌死亡占所有癌症死亡的比例为:女性26%,男性29%[2]。非小细胞肺癌(NSCLC)约占肺癌总发生率的85%,通常诊断时约85%已是晚期[3]。对晚期NSCLC,联合铂类的一线标准化疗方案有效率仅30%左右,5年生存率低于5%,中位生存时间8~10个月[4]。两药含铂方案化疗在疗效方面已经到达平台期,增加化疗药物剂量只能导致毒性的增加,而不能改善生存[5]。小分子靶向药物如吉非替尼和厄洛替尼的问世,给晚期NSCLC的治疗带来了新的突破。吉非替尼和厄洛替尼都是表皮生长因子受体(EGFR)的小分子酪氨酸激酶抑制剂,它们可以进入通过与ATP竞争结合受体酪氨酸激酶的催化区抑制该信号通路,从而达到抑制癌细胞增殖、促进肿瘤细胞凋亡的目的,最终控制肿瘤的生长、延长患者的生存时间。然而,它们的疗效是与EGFR基因是否有敏感位点突变有关的,有敏感突变的患者疗效好,而野生型的患者疗效差,这一结论被多个临床实验证实[8-9, 11]。但在EGFR基因敏感突变的晚期NSCLC患者中,吉非替尼和厄洛替尼之间哪一个疗效更好、更能使患者临床获益呢?这个问题一直没有答案,本文旨在对这个问题进行初步探讨。
1 研究方法 1.1 入选标准将2010年7月~2013年12月间在广州市胸科医院接受治疗的晚期非小细胞肺癌(NSCLC)患者按下列入选标准纳为研究对象。入选标准为:①分期为ⅢB~Ⅳ期(2009年AJCC分期第7版)的晚期NSCLC初治患者;②按RECIST疗效评价标准,有可评价病灶;③ EGFR基因检测为敏感突变型;④年龄为20~80岁;⑤心电图、血常规及肝肾功能等血生化检查基本正常;⑥ ECOG评分为0~2分。患者退组标准为:疾病进展(PD);出现严重3/4级不良反应,患者不能耐受;患者强烈要求退组或失访等其他原因不能完成治疗计划者。
1.2 治疗方法将入组患者随机分成两组,A组接受吉非替尼治疗,250 mg,1次/d,空腹口服,直至疾病进展。B组接受厄洛替尼治疗,150 mg,1次/d,餐前1 h口服,直至疾病进展。
1.3 毒副反应及疗效评价标准毒副反应根据国际常见不良反应标准第3版评价分级。临床疗效评价参照实体瘤治疗疗效评价标准(RECIST 1.1)进行评价。主要观察指标为中位无进展生存期时间(PFS),次要观察指标为总有效率(ORR)和疾病控制率(DCR)等。
1.4 统计学方法采用SPSS 13.0统计软件对研究数据用χ2检验和生存分析等统计方法分析,并用Kaplan-Meier法绘制生存曲线,检验水准为α=0.05。
2 结果 2.1 基线特征2010年7月至2013年12月间,按照入组标准,共入组ⅢB期~Ⅳ期的晚期NSCLC患者50例,其中男性20例,女性30例,平均年龄62.5岁。将患者随机分为两组,一组接受吉非替尼治疗(n=27),另一组接受厄洛替尼治疗(n=23),直至疾病进展。所有入组患者均为EGFR基因敏感突变的晚期NSCLC患者,用χ2检验对两组患者的性别、年龄、ECOG评分、分期、EGFR基因突变位点等基线特征进行比较,两组具有良好的均衡性(P>0.05,表 1)。
| 表 1 两组患者的基线特征 Table 1 Baseline characteristics of the two groups |
吉非替尼组共入组晚期NSCLC患者27例,厄洛替尼组入组23例。其中吉非替尼组CR 1例、PR 14例、SD 8例、PD4例;厄洛替尼组CR 2例、PR 12例、SD 6例、PD 3例。吉非替尼组和厄洛替尼组的总有效率ORR(CR+PR)分别为:55.6%和60.9%;疾病控制率DCR(CR+PR+SD)分别为:85.2%和87.0%。两组之间的有效率和疾病控制率均无显著性差异,前者P=0.711,后者P=0.861。
2.3 远期疗效吉非替尼组和厄洛替尼组的PFS分别为8.0个月(95% CI为6.1~9.9)和8.5个月(95% CI为6.9~13.1)(图 1)。厄洛替尼组的生存曲线在吉非替尼组的上方,在PFS方面略显优势,但两组之间无统计学差异(P=0.293)。在所有入组患者中,EGFR基因突变类型有:19号外显子缺失突变型、21号外显子L858R错义突变型,分别为27例、23例。其中19号外显子缺失突变型患者的PFS为10.0个月,而21号外显子L858R错义突变型患者的PFS为9.0个月,两组之间PFS无统计学差异(P=0.072,图 2)。EGFR基因19号外显子缺失突变的患者在吉非替尼组和在厄洛替尼组的PFS分别为6.5个月和13.0个月,厄洛替尼组显示出优势,但两组之间差异仍无统计学意义(P=0.149,图 3)。而在21号外显子L858R错义突变患者中,吉非替尼组的PFS为8.0个月,厄洛替尼组的PFS为9.0个月,两组之间亦无统计学差异(P=0.583,图 4)。
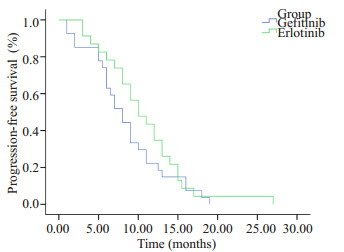
|
图 1 吉非替尼组与厄洛替尼组疗效比较 Figure 1 Kaplan-Meier survival analysis of NSCLC patients treated with Gefitinib (n=27, PFS=8.0 m) and Erlotinb (n=23, PFS=8.5 m)(P=0.293, log rank). |
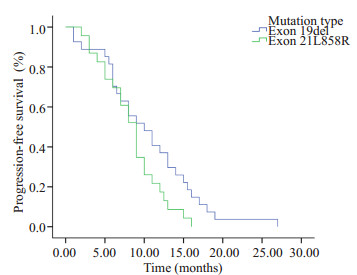
|
图 2 EGFR不同突变位点对EGFR-TKI疗效的影响 Figure 2 Kaplan-Meier survival analysis of NSCLC patients with Exon 19 del (n=27, PFS=10.0 m) and Exon 21L858R (n=23, PFS=9.0 m) (P=0.072, log rank). |
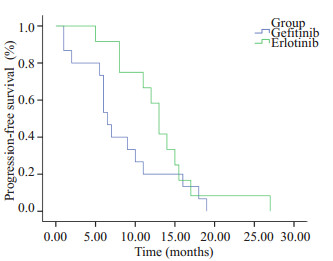
|
图 3 吉非替尼和厄洛替尼在EGFR基因19号外显子缺失突变患者中的疗效比较 Figure 3 Kaplan-Meier survival analysis of EGFR exon 19del NSCLC patients (n=27) treated with Gefitninb (n=15, PFS=6.5 m) and Erlotinb (n=12, PFS=10.0 m)(P=0.149, log rank). |
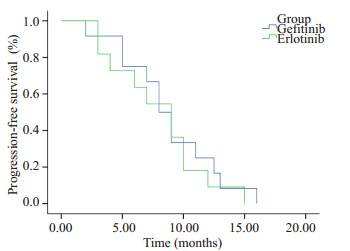
|
图 4 吉非替尼和厄洛替尼在EGFR基因21号外显子L858R错义突变患者中的疗效比较 Figure 4 Kaplan-Meier survival analysis of EGFR exon 21 L858R NSCLC patients (n=23) treated with Gefitninb (n=12, PFS=8.0 m) and Erlotinb (n=11, PFS=9.0 m) (P=0.583, log rank). |
两组均为1/2级皮疹和腹泻,未见3/4级不良反应,没有患者因不良反应而减量或退组。吉非替尼组皮疹发生率为17/27(63.0%),腹泻的发生率为4/27(14.8%);厄洛替尼组皮疹发生率为16/23(69.6%),腹泻发生率为3/23(13.0%)。
3 讨论不管是发达国家,还是发展中国家,肺癌在男性肿瘤死因中高居首位[6]。晚期NSCLC患者的治疗手段有限,在过去主要是以顺铂/卡铂联合第3代化疗药物的两药联合化疗方案为主,但作为一线化疗方案它们的有效率仅为30%~40%,且具有明显的骨髓抑制、恶心、呕吐等毒副反应[7]。EGFR基因的小分子酪氨酸激酶抑制剂(EGFR-TKI)如吉非替尼和厄洛替尼的问世,给晚期NSCLC的治疗带来了新的突破。在过去的10年间,大量的国际多中心临床研究如IPASS研究、OPTIMAL研究等[[8-9]均证实了EGFR-TKI在晚期NSCLC患者中疗效,吉非替尼和厄洛替尼均可以提高患者的ORR和DCR,延长患者的PFS,且不良反应小,患者耐受性好。确定了两种药物在晚期NSCLC患者中的一线治疗地位。但这种疗效并不是在所有晚期NSCLC患者中都可以看到,而是在选择人群中更为明显。Rosell等[10]从2005年4月~2008年11月对西班牙2105例肺癌患者进行了EGFR突变筛查,发现350例患者存在EGFR突变(16.6%),突变更常见于女性患者(69.7%)、非吸烟的患者(66.6%)和腺癌患者(80.9%)(P < 0.001)。217例接受厄洛替尼治疗的患者无进展生存期为14个月,中位生存期长达27个月。因此,在为晚期NSCLC患者选择治疗方案之前,进行肿瘤EGFR突变状态检测具有一定的意义。Fukuoka等[8]研究结果表明只有EGFR基因突变的患者才能取得临床获益,而野生型患者是不能从EGFR-TKI治疗中获益的。TRIBUTE研究亚组分析得到了相同的结果:EGFR突变状态与疗效有关[11]。所以本研究入组的也是EGFR基因敏感突变的患者,结果显示:吉非替尼组和厄洛替尼组的总有效率ORR(CR+ PR)分别为:55.6%和60.9%;疾病控制率DCR(CR+ PR+SD)分别为:85.2%和87.0%;PFS分别为8.0个月(95% CI为6.1~9.9)和8.5个月(95% CI为6.9~13.1),与以往的临床研究结果基本一致。
在EGFR基因敏感突变的晚期NSCLC患者中,吉非替尼与厄洛替尼的疗效有没有差异呢?厄洛替尼Ⅰ期临床试验的结果提示患者最大耐受剂量为150 mg/d[12],推荐剂量为150 mg/d,吉非替尼的Ⅰ期临床试验中最大耐受剂量为700~1000 mg/d,而推荐剂量为250 mg/d[13]。所以很多人认为临床上使用的厄洛替尼的剂量是其最大耐受剂量,而吉非替尼则不是,那么厄洛替尼的疗效是否会优于吉非替尼呢?Kim等[14]的回顾性研究中纳入了342例NSCLC患者,分别接受吉非替尼及厄洛替尼治疗,两组在性别、病理类型、吸烟状况等方面有较好的配对,结果发现吉非替尼及厄洛替尼组的有效率、疾病控制率、中位生存均无明显差异。另外一项Ⅱ期研究中,96例NSCLC患者被随机分到吉非替尼治疗组与厄洛替尼组,结果也显示两组的RR及PFS差异无统计学意义[15]。但此两项研究都是两药在化疗失败后患者中的疗效对比,而本文是在一线治疗中对两药进行对比,对比的结果显示两组之间的有效率和疾病控制率均无显著性差异。虽然厄洛替尼组的生存曲线在吉非替尼组的上方,在PFS方面略显优势,但两组之间无统计学差异(P=0.293)。
EGFR基因最常见的基因突变为19号外显子的缺失突变和21号外显子的L858R错义突变,约占NSCLC患者EGFR总突变的85%以上[16]。目前关于两种不同的敏感突变患者接受EGFR-TKI治疗后的疗效差异的研究较少,本文对此进行了初步探讨,结果显示在所有入组患者中,19号外显子缺失突变型患者接受EGFR-TKI治疗的PFS为10.0个月,而21号外显子L858R错义突变型患者的PFS为9.0个月,两组之间PFS无统计学差异(P=0.072)。而EGFR基因19号外显子缺失突变的患者接受吉非替尼治疗的PFS为6.5个月,接受厄洛替尼治疗的PFS为13.0个月,虽然统计学上无差异(P=0.149),但厄洛替尼组的PFS有延长趋势。而在21号外显子L858R错义突变患者中,吉非替尼组的PFS为8.0个月,厄洛替尼组的PFS为9.0个月,两组之间亦无显著性差异(P=0.583)。
综上所述,吉非替尼和厄洛替尼均是EGFR基因敏感突变晚期NSCLCL患者有效的一线治疗方案,在一线治疗中,两种药物的疗效无统计学差异,但厄洛替尼略显优势。无论19号外显子的缺失突变还是21号外显子的L858R错义突变均可以从EGFR-TKI治疗中获益,突变位点的不同不能导致EGFR-TKI的疗效差异。另外,吉非替尼和厄洛替尼在两种不同突变位点的晚期NSCLC患者中疗效无差异(P>0.05),但对于19外显子缺失突变的晚期NSCLC患者接受厄洛替尼治疗似乎略优于接受吉非替尼治疗。
| [1] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer,2010, 127 (12) : 2893-917. DOI: 10.1002/ijc.v127:12. |
| [2] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin,2012, 62 (1) : 10-29. DOI: 10.3322/caac.20138. |
| [3] | Herbst RS, Heymach JV, Lippman SM. Lung cancer[J]. N Engl J Med,2008, 360 : 1367-80. |
| [4] | Feld R, Sridhar SS, Shepherd FA, et al. Use of the epidermal growth factor receptor inhibitors gefitinib and erlotinib in the treatment of non-small cell lung cancer: A systematic review[J]. J Thorac Oncol,2006, 1 (4) : 367-76. DOI: 10.1016/S1556-0864(15)31597-5. |
| [5] | Figlin RA, Crowley JJ, Jacobs EL, et al. Evaluation of cisplatin, Carboplatin, and etoposide in metastatic non-small-cell lung carcinoma: A phase II study of the southwest Oncology Group[J]. Cancer,1996, 78 (5) : 998-1003. DOI: 10.1002/(ISSN)1097-0142. |
| [6] | Vanderwalde A, Pal SK, Reckamp KL. Management of non-small-cell lung cancer in the older adult[J]. Maturitas,2011, 68 (4) : 311-21. DOI: 10.1016/j.maturitas.2011.01.008. |
| [7] | Stinchcombe TE, Socinski MA. Current treatments for advanced stage non-small cell lung cancer[J]. Proc Am Thorac Soc,2009, 6 (2) : 233-41. DOI: 10.1513/pats.200809-110LC. |
| [8] | Fukuoka M, Wu Y, Thongprasert S, et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS)[J]. J Clin oncol,2011, 29 (21) : 2866-74. DOI: 10.1200/JCO.2010.33.4235. |
| [9] | Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutationpositive non-small-cell lung cancer (OPTIMAL, CTONG-0802) : a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol,2011, 12 (8) : 735-42. DOI: 10.1016/S1470-2045(11)70184-X. |
| [10] | Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med,2009, 361 (10) : U38-958. |
| [11] | Gandara DR, Gumerlock PH. Epidermal growth factor receptor tyrosine kinase inhibitors plus chemotherapy: case closed or is the jury still out[J]. J Clin Oncol,2005, 23 (25) : 5856-8. DOI: 10.1200/JCO.2005.05.030. |
| [12] | Hidalgo M, Siu LL, Nemunaitis J, et al. Phase I and pharmacologic study of OSI-774, an epidermal growth factor receptor tyrosine kinase inhibitor, in patients with advanced solid malignancies[J]. J Clin Oncol,2001, 19 (13) : 3267-79. |
| [13] | Ranson M, Hammond LA, Ferry D, et al. ZD1839, a selective oral epidermal growth factor receptor-tyrosine kinase inhibitor, is well tolerated and active in patients with solid, malignant tumors: results of a phase I trial[J]. J Clin Oncol,2002, 20 (9) : 2240-50. DOI: 10.1200/JCO.2002.10.112. |
| [14] | Kim ST, Lee J, Kim JH, et al. Comparison of gefitinib versus erlotinib in patients with nonsmall cell lung cancer who failed previous chemotherapy[J]. Cancer,2010, 116 (12) : 3025-33. DOI: 10.1002/cncr.v116:12. |
| [15] | Ahn J, Kim S, Ahn M, et al. Randomized phase II study of gefitinib versus erlotinib in patients with advanced non-small cell lung cancer who failed previous chemotherapy[J]. Lung Cancer,2012, 75 (1) : 82-8. DOI: 10.1016/j.lungcan.2011.05.022. |
| [16] | Janne PA, Engelman JA, Johnson BE. Epidermal growth factor receptor mutations in non-small-cell lung cancer: implications for treatment and tumor biology[J]. J Clin Oncol,2005, 23 : 3227-34. DOI: 10.1200/JCO.2005.09.985. |
 2015, Vol. 35
2015, Vol. 35