2. 重庆医科大学附属第二医院核医学科,重庆 400010
2. Department of Nuclear Medicine, Second Affiliated Hospital of Chongqing Medical University, Chonging 400010, China
三基序蛋白(tripartite-motif protein, TRIM)家族具有RBCC多结构域:RING、B-box和coiled-coil,作为E3连接酶[1],可以通过结合底物蛋白,让其发生泛素化/类泛素化降解或修饰,从而达到调控生物功能过程。目前研究表明TRIM家族具有抗病毒作用,并积极参与细胞增殖、分化、凋亡和肿瘤发生发展等过程的调节[2]。TRIM25则通过泛素化或类泛素化调控生物功能过程,参加到肿瘤的进程中[3]。
M2型丙酮酸激酶(pyruvate kinase M2, PKM2)是糖酵解的限速酶,低氧环境下PKM2的高表达可帮助肿瘤细胞通过三羧酸循环和氧化磷酸化获得大量能量。因此PKM2对肿瘤的生长增殖有重要作用,但具体机制仍不清楚,同时有研究指出PKM2可能与E3连接酶蛋白相互连接发生作用参与到泛素化过程中[4]。
Qin等[5]已通过泛素化亲和提取试剂盒在非小细胞肺癌细胞株A549和耐顺铂株A549/CDDP细胞发现TRIM25、PKM2蛋白是有明显差异,但是在临床NSCLC病人中TRIM25和PKM2蛋白表达具体相关性是不清楚的。因此在研究中检测了TRIM25、PKM2在60例非小细胞肺癌病人及20例癌旁正常组织(>5 cm)中的免疫荧光定位;同时用Western blotting测定10例NSCLC病人新鲜组织中两种蛋白的表达,有利于探讨临床中两种蛋白与NSCLC的关系,以期为肿瘤的发生、发展、治疗提供理论依据。
1 材料与方法 1.1 样品来源收集重庆医科大学附一院2011年5月~2012年2月间手术切除的60例NSCLC标本(经病理证实),其中28例腺癌,32例鳞癌;32例男性,28例女性;年龄38~75岁,中位年龄60.8岁;5例高分化癌,41例中分化癌,14例低分化癌;根据2009年世界肺癌大会的肺癌临床分期标准,16例Ⅰ期,10例Ⅱ期,34例Ⅲ期;37例转移,23例无转移;34例有吸烟史,26例无吸烟史。进行免疫荧光组织化学实验,实验组为肿瘤组织,腺癌、鳞癌各取10例肿瘤旁边正常组织为对照组,经固定后石蜡包埋,4 μm厚切片。
同时从2012年5月~7月临床特征(年龄、性别、吸烟史、分化程度、TNM分期、肿瘤转移)相近中,各收集5例NSCLC腺癌、鳞癌新鲜组织,并取其癌旁正常组织(>5 cm)作为对照,用Western blotting方法检测TRIM25、PKM2蛋白表达。
1.2 主要试剂TRIM25兔抗人单克隆抗体购自Sigma Aldrich公司,PKM2鼠抗人多克隆抗体购自Santa Cruz公司,驴抗山羊荧光二抗、山羊抗兔荧光二抗购自上海碧云天生物技术有限公司,DAB显色剂、辣根过氧化物酶标记山羊抗小鼠IgG和小鼠抗兔IgG购自北京中衫金桥公司。
1.3 方法 1.3.1 免疫荧光组织化学(1)主要步骤:把标本石蜡切片脱蜡后使用3%的过氧化氢去离子水封闭10 min,再用0.01 mol/L的柠檬酸盐缓冲液(pH=6.0)热修复,自然冷却后用山羊血清封闭30 min,然后滴加TRIM25单克隆抗体(1:300),在水槽上4 ℃过夜,复温1 h后滴加山羊抗兔荧光二抗(1:200),在37 ℃孵育1 h,50%甘油封片,在荧光显微镜下观察(×400)。
同时平行试验中PKM2多克隆抗体(1:100)取代TRIM25单克隆抗体,滴加驴抗山羊荧光二抗(1:200);空白对照用PBS代替一抗;同时对切片做HE染色。
(2)结果判断:采用双盲法,判断NSCLC和正常组织TRIM25、PKM2蛋白的表达情况。在高倍镜(×400)下,随机读取每张切片的6个视野,每个视野中记数以荧光反应强为先的100个细胞。依照荧光阳性亮度强弱程度可分成:弱阳性1分;中等阳性2分;强阳性3分。依照阳性细胞数量,可分为:弱阳性(+,总数25%以下阳性细胞);中等阳性(++,总数25%~49%之间阳性细胞);强阳性(+++,总数50%以上阳性细胞)。采用综合计量方法,计算公式为:(+)%×1 +(++)%×2+(+++)%×3;总数值 < 1.0者为(+),1.0-1.5者为(++),>1.5者为(+++)。积分>1.0者为阳性表达, < 1.0者为阴性表达。
(3)统计学分析:对所得数据采用SPSS 18.0统计软件进行检验,样本数据的比较使用卡方检验,同时对两个蛋白表达做关联性分析。以Ρ < 0.05为差异有统计学意义。
1.3.2 Western blot实验(1)提取总蛋白:将取得的肺癌或旁边正常新鲜组织于4 ℃ 0.9%生理盐水中洗净、称量、研磨组织,按每100 mg组织加入0.5 ml的RIPA裂解液,反应30 min后在4 ℃下13 000 r/min离心30 min,取上清加入PMSF调至终浓度为1%,取少量蛋白提取液,使用紫外分光仪测定蛋白含量,标本储存于-80 ℃备用;(2)Western blot检测:将含80 μg蛋白质样品液与上样缓冲液混合,煮沸5 min,凝胶电泳分离蛋白,半干转法将蛋白质转至PVDF膜,室温下用5%脱脂奶粉封闭4 h,加入兔抗人TRIM25多克隆一抗(1:200),4 ℃过夜,加小鼠抗兔二抗(1:100),震动下孵育2 h,ECL显影,使用Quantity One 4.5软件进行光密度分析。
同时平行试验中PKM2多克隆抗体(1:200)取代TRIM25单克隆抗体,滴加山羊抗小鼠二抗(1:100),同时都以兔抗鼠β-actin抗体对照实验。
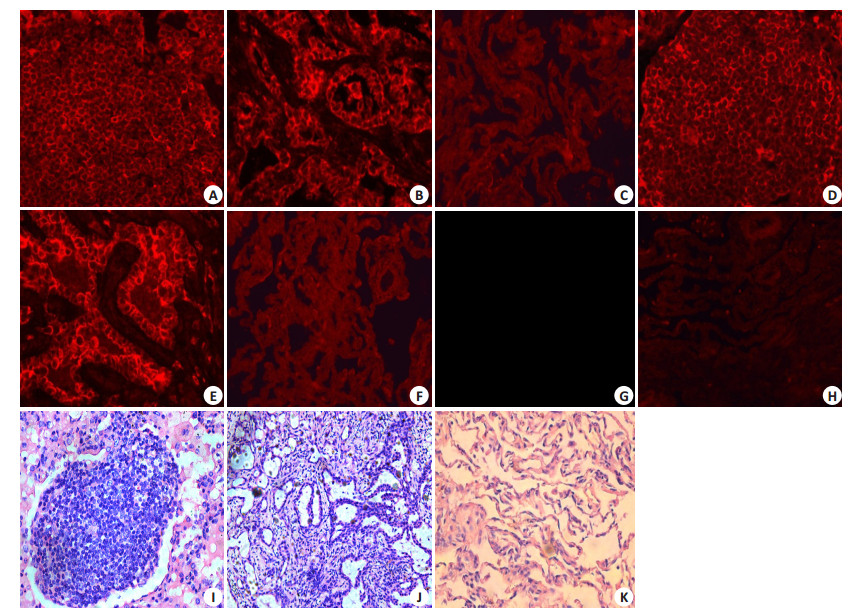
2 结果 2.1 免疫荧光结果 2.1.1 TRIM 25在NSCLC中的表达及与临床病理因素的关系TRIM25在60例NSCLC中阳性率为45%(27/ 60),而癌旁组织中仅为10%(2/20),差异具有统计学意义(Ρ=0.005)。TRIM25在鳞癌中表达率高于腺癌,差异具有显著性(Ρ=0.017)。TRIM 25表达与NSCLC组织分级、TNM分期及淋巴结转移呈正相关性(Ρ < 0.05),与患者的性别、年龄、吸烟史无关(Ρ > 0.05,图 1,表 1)。
|
图 1 对NSCLC和正常组织中TRIM25和PKM2蛋白表达的免疫荧光染色和HE染色 Figure 1 Immunofluorescence assay and HE staining of TRIM25 and PKM2 protein in NSCLC and normal lung tissues (Original magnification: ×400). A: TRIM25 expression in lung squamous cell carcinoma; B: TRIM25 expression in lung adenocarcinoma; C: TRIM25 expression in normal lung tissue; D: PKM2 expression in lung squamous cell carcinoma; E: PKM2 expression in lung adenocarcinoma; F: PKM2 expression in normal lung tissue; G, H: Negative control of TRIM25 and PKM2 in lung tissue; I, J, K: HE staining of lung squamous cell carcinoma, lung adenocarcinoma, and normal lung tissue. |
PKM2蛋白在60例NSCLC中阳性率为73.3%(44/60),与非癌变肺组织表达阳性率30%(6/20)相比,有显著差异(Ρ=0.001)。PKM2在鳞癌中表达高于腺癌,差异具有统计学意义(Ρ=0.008)。NSCLC中PKM2蛋白的表达阳性率与组织分化、TNM分期、淋巴结转移、性别、年龄、吸烟史无明显相关性(Ρ > 0.05,图 1,表 1)。
| 表 1 TRIM25和PKM2蛋白在NSCLC中表达情况 Table 1 TRIM25 and PKM2 protein expressions in non-small cell lung cancer |
在NSCLC腺癌、鳞癌中对TRIM25、PKM2蛋白通过关联性分析,发现两者存在关联性(χ2=4.972,Ρ=0.026,表 2)。
| 表 2 TRIM25和PKM2蛋白在NSCLC中相关性 Table 2 Correlation between TRIM25 and PKM2 proteins in non-small cell lung cancer |
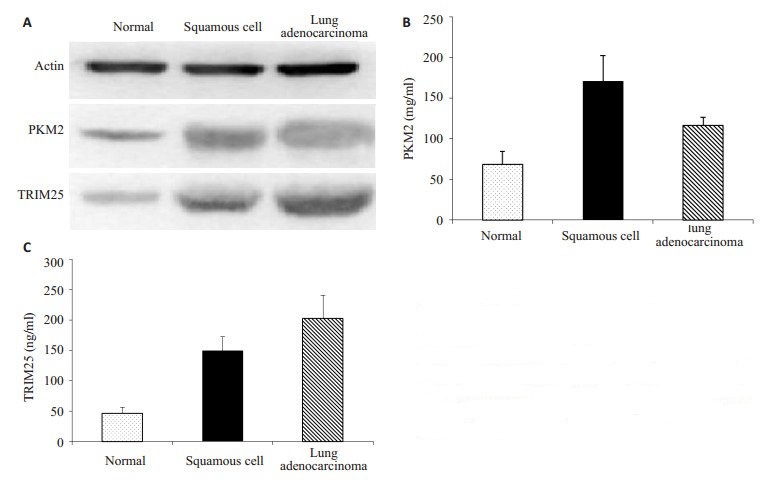
PKM2、TRIM25蛋白在NSCLC中表达均高于正常肺组织;用Quantity One 4.5分析数据,PKM2、TRIM25蛋白在腺癌中表达高于鳞癌;TRIM25蛋白升高幅度大于PKM2表达,在癌症细胞中TRIM25高表达时PKM2表达有所降低(图 2)。
|
图 2 使用Western blot方法对TRIM25和PKM2蛋白表达的分析结果 Figure 2 Western blotting of TRIM25 and PKM2 protein expressions in different lung tissues. A: Western blotting of TRIM25 and PKM2 protein expression in lung adenocarcinoma, squamous cell and normal tissue; Quantitative analysis of PKM2 (B) and TRIM25 (C) protein expressions. |
有些TRIM蛋白发挥双重的作用,既可以作为癌基因又作为抑癌基因[6-7]。TRIM25在其中具有代表性,它不仅作为免疫细胞感应器,同时它也作为癌基因促进乳腺癌的发生发展[2],TRIM25可通过泛素化或类泛素化控制细胞周期抑制剂14-3-3δ调节细胞增殖[3, 8]。但TRIM25在其他肿瘤中是否也发挥相应作用、具体机制又是什么,这些都是目前研究的热点和难点。
本实验通过免疫荧光组织化学和WB实验均发现NSCLC组织中TRIM 25蛋白表达明显上调,说明其可能在NSCLC发生发展中起重要作用。TRIM25蛋白表达与NSCLC的组织分型、TNM分期、淋巴转移密切相关,提示TRIM25蛋白在临床上的不同NSCLC病理分型中表达存在区别,这些差异关联到病人的预后效果,为今后NSCLC诊疗研究提供了新的思路。
3.2 在NSCLC中PKM2的表达及意义在肿瘤中PKM2通过协同低氧诱导因子1α,能够促进需氧糖酵解和肿瘤血管生成[9],PKM2有可能成为肿瘤预后判断[10]。本研究显示,在NSCLC组织中PKM2蛋白的表达显著高于非癌变肺组织,证实PKM2蛋白高表达可能促进NSCLC的生长;PKM2蛋白在NSCLC的腺癌和鳞癌中表达量的差异具有统计学意义,与目前国内外的研究结果相同,同时这些结果可能成为非小细胞肺癌研究提供依据。
3.3 TRIM25与PKM2蛋白的相关性上文阐述TRIM25作为泛素化E3连接酶,可通过泛素化或类泛素化参加到生物过程,同时类泛素化修饰可能会发生在PKM2蛋白上,XIA QIN等通过实验提示TRIM25、PKM2在肺癌细胞株A549耐药中可能同时发挥作用[11]。这些研究表明TRIM25、PKM2蛋白可能同时参与到泛素化或类泛素化,因此TRIM25、PKM2蛋白是否可能通过泛素化或类泛素化作用相互在肺癌中发生发展中发挥作用。本研究中免疫荧光组织化学证实在NSCLC组织中TRIM25、PKM2表达明显高于正常肺组织,它们存在相关性;同时WB试验也测得在NSCLC组织中TRIM25、PKM2蛋白表达明显升高,当TRIM25表达升高时PKM2表达有增长放缓的趋势。
综上所述在NSCLC组织中TRIM25、PKM2蛋白均高表达,当TRIM25表达增高时PKM2的表达增加量明显有放缓的趋势现象,本课题组在对A549/DDP细胞株中进行沉默TRIM25基因时PKM2有表达增加,说明TRIM25、PKM2可能在特定的外部环境刺激下可激活它们发生相互作用。此外值得注意的是泛素化或类泛素化也与抗肿瘤药物出现多耐药的现象相关[12],PKM2可能参与到多耐药的发生之中[13],这为我们下一步研究提供新的思路,同时也为目前肿瘤耐药研究提供新的途径。
| [1] | Mcnab FW, Rajsbaum R, Stoye JP. Tripartite-motif proteins and innate immune regulation[J]. Curr Opin Immunol,2011, 23 (1) : 46-56. DOI: 10.1016/j.coi.2010.10.021. |
| [2] | Rajsbaum FM. Jonathan P StoyeAnne O'garra. Tripartite-motif proteins and innate immune regulation[J]. Curr Opin Immunol, 2011, 23(1): 46-56. https://www.ncbi.nlm.nih.gov/pubmed/21131187 |
| [3] | Nakamura Y, Oshima K, Naoi Y, et al. 14-3-3 sigma expression is associated with poor pathological complete response to neoadjuvant chemotherapy in human breast cancers[J]. Breast Cancer Res Treat,2012, 134 (1) : 229-36. DOI: 10.1007/s10549-012-1976-x. |
| [4] | Chaneton B, Gottlieb E. Rocking cell metabolism: revised functions of the key glycolytic regulator PKM2 in cancer[J]. Trends Biochem Sci,2012, 37 (8) : 309-16. DOI: 10.1016/j.tibs.2012.04.003. |
| [5] | Qin X, Chen S, Qiu Z, et al. Proteomic analysis of ubiquitinationassociated proteins in a cisplatin-resistant human lung adenocarcinoma cell line[J]. Int J Mol Med,2012, 29 (5) : 791-800. |
| [6] | Oh YT, Yue P, Zhou W, et al. Oncogenic Ras and B-Raf proteins positively regulate death receptor 5 expression through coactivation of ERK and JNK signaling[J]. J Biol Chem,2012, 287 (1) : 257-67. DOI: 10.1074/jbc.M111.304006. |
| [7] | Herquel B, Ouararhni K, Khetchoumian K, et al. Transcription cofactors TRIM24, TRIM28, and TRIM33 associate to form regulatory complexes that suppress murine hepatocellular carcinoma[J]. Proc Natl Acad Sci USA,2011, 108 (20) : 8212-7. DOI: 10.1073/pnas.1101544108. |
| [8] | Ketscher L, Basters A, Prinz M, et al. mHERC6 is the essential ISG15 E3 ligase in the murine system[J]. Biochem Biophys Res Commun,2012, 417 (1) : 135-40. DOI: 10.1016/j.bbrc.2011.11.071. |
| [9] | Irene C, Aki M, Colmenares SU, et al. Double-strand breaks in heterochromatin move outside of a dynamic HP1 a domain to complete recombinational repair[J]. Cell,2011, 144 (5) : 732-44. DOI: 10.1016/j.cell.2011.02.012. |
| [10] | Fatela-Cantillo D, Fernandez-Suarez A, Marin Moreno MA, et al. Prognostic value of plasmatic tumor M2 pyruvate kinase and carcinoembryonic antigen in the survival of colorectal cancer patients[J]. Tumor Biol,2012, 33 (3, SI) : 825-32. DOI: 10.1007/s13277-011-0304-0. |
| [11] | 秦霞, 邱宗荫, 邱峰, 等. 人肺腺癌耐药细胞株A549/CDDP中相关泛素化蛋白质研究[J]. 第三军医大学学报,2012, 5 (9) : 866-9. |
| [12] | Martinez-Balibrea E, Plasencia C, Ginés A, et al. Aproteomic approach links decreased pyruvate kinase M2 expression to ox aliplatin resistance in patients with colorectal cancer and in human cell lines[J]. Mol Cancer Ther,2009, 8 (4) : 771-8. DOI: 10.1158/1535-7163.MCT-08-0882. |
| [13] | Desai SD, Li TK, Rodriguez-Bauman A, et al. Ubiquitin/26S proteasome-mediated degradation of topoisomerase I as a resustabce mechanismto camptothecin in tumor cells[J]. Cancer Res,2001, 61 (15) : 5926-32. |
 2015, Vol. 35
2015, Vol. 35
