2. 河北联合大学研究生学院,河北 唐山 063000
2. Graduate School, Hebei United University, Tangshan 063000, China
宫颈癌是女性最常见的恶性肿瘤之一,早期治疗效果较好。宫颈癌发生转移及浸润后很难彻底根治,是导致患者死亡的主要原因,目前其转移和浸润的分子机制未明。Furin属蛋白前体转化酶家族成员,可以水解前体蛋白产生活性蛋白成分,其异常表达与肿瘤的发生、转移和血管生成关系密切[1-4]。Furin分子的底物是膜性Ⅰ型金属蛋白酶(MT1-MMP)的前体蛋白,MT1-MMP可通过降解基底膜和多种细胞外基质成分从而促进肿瘤细胞的增殖和转移[5-6]。Furin参与宫颈癌生长和转移的相关研究比较少见。我们以HeLa细胞株及致瘤裸鼠为模型,使用Furin抑制剂对宫颈癌细胞生长转移效应进行研究,可进一步理解宫颈癌发生转移和侵袭的分子机制,并为开发针对性的靶点药物提供思路。
1 材料与方法 1.1 材料人宫颈癌细胞株HeLa细胞(协和细胞库);BALB/ cA-nu裸鼠,由河北联合大学实验动物中心提供,4~6周龄;体质量:18~20 g;饲养于SPF级环境中。重组表达质粒pcDNA3.0-V5-α1-PDX由本实验中心构建。山羊抗兔和山羊抗鼠二抗(Sigma美国);BCA蛋白质定量试剂盒(Pierce美国);MTT(Sigma美国);β-actin、Furin、V5-Probe (G-14)抗体(Santa Cruz Biotechnology美国);Furin抑制剂α1-PDX(Portland美国);Furin特异性底物Cbz-Arg-Ser-Lys-Arg-AMC(Bachem瑞士);MTT(Sigma美国)。RPMI 1640细胞培养基、小牛血清、胰蛋白酶等(Gibco美国)。
1.2 方法 1.2.1 细胞培养及转染在5% CO2,37 ℃的培养箱中,HeLa细胞用含有10%FBS的RPMI 1640培养基对进行培养分为两组。细胞处于生长对数期时脂质体介导转染pcDNA3.0载体和2 μg包含α1-PDX的质粒。转染6 h后,更换为含10%FBS的基本培养基。为了进行后续实验使用200 μg/ml G418选择建立稳定转染细胞系。
1.2.2 MTT细胞增殖抑制瞬时转染空质粒pcDNA3.0 和α1-PDX质粒后将HeLa细胞接种于96孔细胞培养板,继续培养细胞12、24、36、48 h,加入200 μl MTT工作液(0.5 mg/ml)孵育2 h进行常规MTT检测,于酶标仪570 nm读取吸光度值。细胞增殖抑制率=(1-实验组A570值/对照组A570值)×100%。
1.2.3 细胞迁移及侵袭实验采用Boyden小室法检测HeLa细胞(转染组、空载体组)的迁移及侵袭能力。使用8 μmol/L人工基底膜将上下两室分开,侵袭实验需要预先在膜上铺2 µg基质胶[5-6]。制备HeLa细胞空质粒组和表达α1-PDX cDNA稳定转染细胞悬液,调整细胞密度至5×105/ml。取不含血清的培养基制备的单细胞悬液100 µl加入Boyden上室,下室一般加入600 µl培养基含10%小牛血清。常规培养细胞24 h。取出Boyden小室,弃去孔中培养液,PBS洗2遍,甲醇固定30 min,将小室适当风干。0.2%结晶紫染色20 min,1% SDS洗3遍。倒置显微镜拍照细胞并记数。
1.2.4 细胞免疫荧光细胞培养过夜贴壁后分别转染空质粒及pCDNA3.0-V5-PDX质粒培养24 h,加入2 ml 4%多聚甲醛室温固定30 min,透化并封闭后孵育V5标签抗体,使用1% BSA按适当滴度(1:100)稀释滴在盖玻片上4 ℃过夜。荧光标记二抗在室温避光静置1 h。封片荧光显微镜拍照。
1.2.5 免疫印迹低温刮取各组细胞裂解静置30 min,高速离心后取上清备用。蛋白定量并在95 ℃水浴变性5 min。样品凝胶电泳结束后转膜,加入Furin单抗(1: 1000)、MT1-MMP单抗(1:1000)4 ℃过夜。二抗(1: 5000)室温孵育2 h,化学发光并曝光,扫描结果。
1.2.6 Furin酶活性检测活化的Furin能够特异切割Cbz-Arg-Ser-Lys-Arg-AMC短肽底物,水解Arg-SerLys-Arg肽键。在共价偶联时,AMC不能被激发荧光,短肽被水解后释放出AMC,自由AMC才能被激发发射荧光。根据释放的AMC荧光强度大小,可反映Furin被活化的程度。96孔板中接种细胞培养过夜,瞬时转染空质粒pcDNA3.0和包含α1-PDX质粒并将细胞接种于96孔细胞培养板,继续培养24 h后裂解细胞使用BCA法测蛋白浓度,重复3孔。200 μl体系中加入Furin特异性底物Cbz-Arg-Ser-Lys-Arg-AMC,37 ℃避光孵育1 h。酶标仪检测荧光强度,激发光波长380 nm,发射光波长为460 nm,记录并分析结果。
1.2.7 裸鼠皮下移植瘤模型的建立稳定转染宫颈癌HeLa/PDX及HeLa/CTL细胞,制成单细胞悬液,调整浓度为1×107/ml;12只裸鼠分成两组,无菌条件下用1 ml注射器接种于右前肢腋部皮下,接种量为0.2 ml,间隔5 d观察1次直到注射后30 d。观察两组裸鼠成瘤一般情况并测量瘤体积变化,即用游标卡尺测量肿瘤长径和宽径,估算肿瘤体积(V),取各组平均值,绘制生长曲线:V=长径×宽径2×0.5。
1.3 图象分析及数据统计实验数据采用均数±标准差表示,SPSS13.0统计软件对数据行t检验或方差分析,P < 0.05表明统计有显著性差异。
2 结果 2.1 稳定转染α1-PDX后蛋白表达情况HeLa细胞荧光实验表明,与空质粒组相比,稳定转染α1-PDX组可见V5-α1-PDX红色荧光蛋白阳性表达(图 1A);蛋白印迹实验表明,与对照组相比,α1-PDX转染组V5-α1-PDX蛋白水平明显增加(图 1B)。
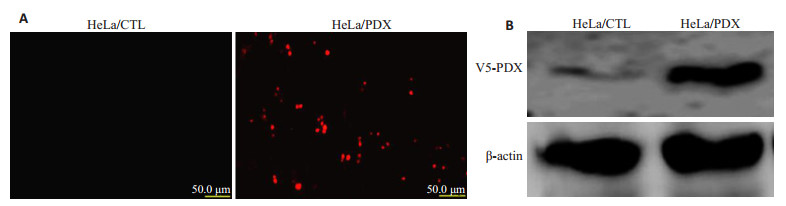
|
图 1 细胞免疫荧光及蛋白印迹法检测HeLa细胞中V5-α1-PDX的表达 Figure 1 V5-α1-PDX expression in HeLa cells detected by cell immunofluorescence staining (A, original magnification:×200) and Western blotting (B). |
MTT实验表明,不同时间点α1-PDX均对HeLa细胞增殖产生抑制作用,24 h对细胞增殖的抑制作用最大,达到18.4%(P=0.001,图 2)
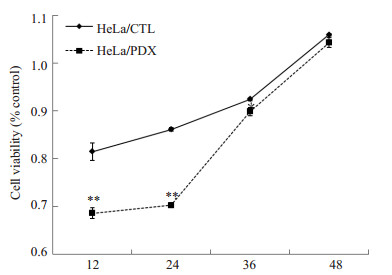
|
图 2 α1-PDX对HeLa细胞的生长抑制作用 Figure 2 Inhibitory effects of α1-PDX on the proliferation of human cervical cancer HeLa cells measured by MTT assay. |
为了分析Furin抑制后是否影响宫颈癌细胞的迁移和侵袭,使用Boyden小室进行检测。孵育24 h后,α 1-PDX稳定表达组与对照组相比, 穿透人工基底膜和基质胶的HeLa细胞数量均明显减少,具有统计学意义(P=0.001,P=0.002,图 3A, B)
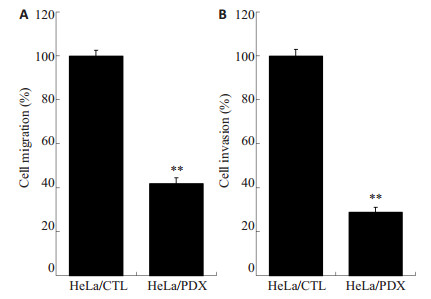
|
图 3 α1-PDX对HeLa细胞迁移率及侵袭率的影响 Figure 3 Effects of α1-PDX on the migration (A) and invasion (B) of HeLa cells. |
相对分子质量约90 000处可见Furin特异性蛋白条带,α1-PDX组与对照组相比染色较浅。但两者Furin表达差别不明显(图 4A)。进一步检测α1-PDX对Furin酶活性的影响。如图 4B所示,与对照组相比,α1-PDX对Furin酶活性有明显的抑制作用,使用酶标仪测定酶水解底物AMC的荧光强度(a.u.)值由开始的310.33±5.51降低到此时的189.00±6.24,活性水平下降了约39.1%(P < 0.001,n=3)。
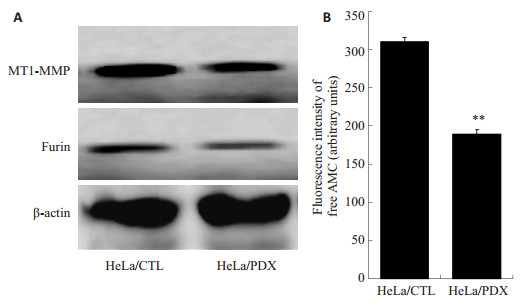
|
图 4 α1-PDX对Furin、MT1-MMP蛋白及Furin活性的影响 Figure 4 Effects of α1-PDX on the protein expression of furin and MT1-MMP (A) and furin activity (B). |
相对分子质量约58 000处可见MT1-MMP特异性蛋白条带,与对照组相比,α1-PDX组蛋白条带着色较浅(图 4A)。
2.6 癌细胞HeLa致瘤裸鼠实验 2.6.1 裸鼠的一般情况皮下肿瘤前期生长较慢,开始外观呈球形或半球形,初起可活动,日渐变硬。肿瘤大小不一,观察期内无一例发生局部皮肤破溃。随着肿瘤的增长,裸鼠逐渐出现状态欠佳,活动减少。第20天,空质粒组有两只裸鼠开始出现精神萎靡,体质量明显下降,但截止到处死期,无一例死亡(图 5B)。
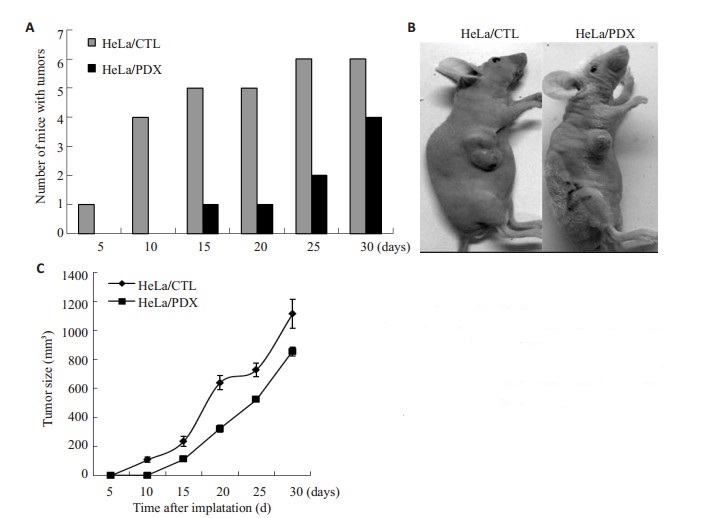
|
图 5 体内致瘤裸鼠实验 Figure 5 Effects of α1-PDX in vivo on tumorigenicity in nude mice. A: Tumor formation evaluated at the indicated time point; B: Nude mice on day 30; C: Tumor volume changes with time. |
第5天空质粒组有1只宫颈癌HeLa致瘤裸鼠出现皮下肿瘤,第25天6只均出现皮下肿瘤,成瘤几率为100%;第15天α 1-PDX组仅有一只裸鼠出现肿瘤,直到第30天有4只出现肿瘤(图 5A),成瘤几率为67%。
2.6.3 α1-PDX对人宫颈癌HeLa裸鼠移植瘤体积的生长曲线使用游标卡尺从体表测量裸鼠皮下移植瘤的长径及宽径,用公式V=长径×宽径2×0.5估算瘤体积。数据统计分析后发现第20天α1-PDX组瘤体积为323.00±23.07,远远小于空质粒组的639.67±49.22,两组相比差异有统计学意义(P < 0.01,图 5C)。
3 讨论发展中国家,宫颈癌是最常见的妇科恶性肿瘤之一。目前手术治疗、放疗及化疗明显降低了宫颈癌患者的死亡率,宫颈癌的浸润和转移是造成预后不良患者死亡的主要原因[7]。肿瘤细胞侵袭和转移需要突破基底膜并侵犯邻近组织或进入血管、淋巴管到达靶器官[8]。MT1-MMP是基质金属蛋白酶家族的一个亚族,能降解细胞外基质和基底膜成分,研究显示MT1-MMP抑制剂在一定程度上可对抗肿瘤细胞的浸润和转移[9]。MT1-MMP要发挥跨膜蛋白水解酶的作用,首先需要在蛋白前体转化酶Furin的作用下裂解前体MT1-MMP(proMT1-MMP)生成活性MT1-MMP。
Furin是发现得最早且功能研究最为清楚的哺乳动物前体加工酶,在组织细胞内广泛分布。Furin活化可参与加工多种底物分子前体。Furin在许多人类肿瘤中过表达,在肿瘤细胞的增殖调控、粘附转移和免疫反应中发挥作用[10]。它可作为肿瘤进展的分子标记,其活性与肿瘤的恶性表型呈正相关[11]。Furin参与宫颈癌发病的相关研究不多,研究表明生长因子激活p38激酶可导致Furin活化并裂解人乳头状瘤病毒蛋白从而影响宫颈癌的预后[12]。活化的Furin裂解Notch-1、MT1-MMP等前体蛋白底物分子对于癌细胞的转化、迁移、侵袭及血管生成有重要意义[13-14]。
许多小分子物质、天然物质、多肽及多肽的衍生物可以抑制Furin活性[15]。本研究中使用Furin选择性抑制剂α 1-PDX,它常被用于体内外各种实验模型[16-17]。我们发现随着时间延长至48 h,对照组宫颈癌HeLa细胞增殖能力显著;致瘤裸鼠的肿瘤生长有明显的时间依赖性,30 d左右,肿瘤体积将突破1200 mm3。与此相比,α1-PDX明显降低了宫颈癌细胞的生长增殖(图 2);图 5中可见α1-PDX对HeLa移植瘤的体内生长有明显抑制作用, 且裸鼠致瘤几率降低了33%。同时α1-PDX明显降低了宫颈癌细胞的迁移和侵袭能力,特别是迁移率和侵袭率分别下降到41.8%和28.9%。这与之前Coppola的研究结果相一致[18],说明重组蛋白α 1-PDX对于体外对抗肿瘤细胞的生长和侵袭非常有效。为了研究α1-PDX抑制肿瘤细胞生长转移的内在机制,我们进一步实验发现它对Furin蛋白作用不太大,对Furin活性抑制比较明显,使其活性降低了39.1%。蛋白印迹结果发现它能够使宫颈癌细胞内MT1-MMP蛋白水平显著降低。这与其他实验室研究结果是一致的[18-19]。但值得注意的是早期有报告认为侵袭标志因子MT1-MMP的激活在人结肠癌LoVo细胞株中为非Furin依赖途径[20]。分析可能与各实验室选择的细胞株类型有关。本实验中α1-PDX可有效抑制人宫颈癌HeLa细胞的生长及转移能力,可能通过降低Furin活性及产物MTI-MMP的表达, 使后者失去了降解胶原和纤维连接蛋白的能力,而Furin裂解活化MT1-MMP的细节需要进一步研究。Furin是多种活性分子的前体,如MT1-MMP,TGF-β,IGF-1R,VEGF-C,PDGF-A,ADAM等,这些分子均与生长增殖有关,Furin裂解活化这些活性分子前体的细节也需要进一步研究。正是因为如此,我们认为抑制Furin活性比单纯抑制肿瘤转移相关蛋白MT1-MMP的表达对于控制肿瘤转移和侵袭更为有效。使用Furin抑制剂进行临床肿瘤治疗将会是一条新思路。
| [1] | Thomas G. Furin at the cutting edge: From protein traffic to embryogenesis and disease[J]. Nat Rev Mol Cell Biol,2002, 3 (10) : 753-66. DOI: 10.1038/nrm934. |
| [2] | Zhang L, Sun Z, Liu Q, et al. Expression and clinicopathologic significance of Furin in cervical carcinomas[J]. Zhonghua Bing Li Xue Za Zhi,2014, 43 (1) : 36-7. |
| [3] | Scamuffa N, Sfaxi F, Ma J, et al. Prodomain of the proprotein convertase subtilisin/kexin Furin (ppFurin) protects from tumor progression and metastasis[J]. Carcinogenesis,2014, 35 (3) : 528-36. DOI: 10.1093/carcin/bgt345. |
| [4] | Lalou C, Basak A, Mishra P, et al. Inhibition of tumor cells proliferation and migration by the flavonoid furin inhibitor isolated from oroxylum indicum[J]. Curr Med Chem,2013, 20 (4) : 583-91. |
| [5] | Golubkov VS, Cieplak P, Chekanov AV, et al. Internal cleavages of the autoinhibitory prodomain are required for membrane type 1 matrix metalloproteinase activation, although furin cleavage alone generates inactive proteinase[J]. J Biol Chem,2010, 285 (36) : 27726-36. DOI: 10.1074/jbc.M110.135442. |
| [6] | Guo C, Piacentini L. Type I collagen-induced MMP-2 activation coincides with up-regulation of membrane type 1-matrix metalloproteinase and TIMP-2 in cardiac fibroblasts[J]. J Biol Chem,2003, 278 (47) : 46699-708. DOI: 10.1074/jbc.M307238200. |
| [7] | Wang W, Jia HL, Huang JM, et al. Identification of biomarkers for lymph node metastasis in early-stage cervical cancer by tissuebased proteomics[J]. Br J Cancer,2014, 110 (7) : 1748-58. DOI: 10.1038/bjc.2014.92. |
| [8] | Polette M, Birembaut P. Membrane-type metalloproteinases in tumor invasion[J]. Int J Biochem Cell Biol,1998, 30 (11) : 1195-202. DOI: 10.1016/S1357-2725(98)00083-1. |
| [9] | Xu M, Wang YZ. miR133a suppresses cell proliferation, migration and invasion in human lung cancer by targeting MMP14[J]. Oncol Rep,2013, 30 (3) : 1398-404. |
| [10] | Zhou Z, Shen T, Zhang BH, et al. The proprotein convertase furin in human trophoblast: Possible role in promoting trophoblast cell migration and invasion[J]. Placenta,2009, 30 (11) : 929-38. DOI: 10.1016/j.placenta.2009.09.003. |
| [11] | Huang YH, Lin KH, Liao CH, et al. Furin overexpression suppresses tumor growth and predicts a better postoperative diseasefree survival in hepatocellular carcinoma[J]. PLoS One,2012, 7 (7) : e40738. DOI: 10.1371/journal.pone.0040738. |
| [12] | Kumar V, Behera R, Lohite K, et al. p38 kinase is crucial for osteopontin-induced furin expression that supports cervical cancer progression[J]. Cancer Res,2010, 70 (24) : 10381-91. DOI: 10.1158/0008-5472.CAN-10-1470. |
| [13] | Ma YC, Shi C, Zhang YN, et al. The tyrosine kinase c-Src directly mediates growth factor-induced notch-1 and furin interaction and notch-1 activation in pancreatic cancer cells[J]. PLoS One,2012, 7 (3) : e33414. DOI: 10.1371/journal.pone.0033414. |
| [14] | Shi C, Ma YC, Liu H, et al. The non-receptor tyrosine kinase c-Src mediates the PDGF-induced association between Furin and proMT1-MMP in HPAC pancreatic cells[J]. Mol Cell Biochem,2012, 362 (1/2) : 65-70. |
| [15] | Lopez-Vallejo F, Martinez-Mayorga K. Furin inhibitors: Importance of the positive formal charge and beyond[J]. Bioorg Med Chem,2012, 20 (14) : 4462-71. DOI: 10.1016/j.bmc.2012.05.029. |
| [16] | Fu J, Bassi DE, Zhang JR, et al. Transgenic overexpression of the proprotein convertase furin enhances skin tumor growth[J]. Neoplasia,2012, 14 (4) : 271-82. DOI: 10.1593/neo.12166. |
| [17] | Lapierre M, Siegfried G, Scamuffa N, et al. Opposing function of the proprotein convertases furin and PACE4 on breast cancer cells'malignant phenotypes: role of tissue inhibitors of metalloproteinase-1[J]. Cancer Res,2007, 67 (19) : 9030-4. DOI: 10.1158/0008-5472.CAN-07-0807. |
| [18] | Coppola J, Bhojani MS, Ross BD. A small molecule furin inhibitor inhibits cancer cell motility and invasiveness[J]. Neoplasia,2008, 10 (4) : 363-70. DOI: 10.1593/neo.08166. |
| [19] | Stawowy P, Margeta C, Kallisch H, et al. Regulation of matrix metalloproteinase MT1-MMP/MMP-2 in cardiac fibroblasts by TGF-beta1 involves furin-convertase[J]. Cardiovasc Res,2004, 63 (1) : 87-97. DOI: 10.1016/j.cardiores.2004.03.010. |
| [20] | Deryugina EI, Ratnikov BI, Yu Q, et al. Prointegrin maturation follows rapid trafficking and processing of MT1-MMP in furinnegative colon carcinoma LoVo cells[J]. Traffic,2004, 5 (8) : 627-41. DOI: 10.1111/j.1600-0854.2004.00206.x. |
 2015, Vol. 35
2015, Vol. 35