2. 广州市刑事科学技术研究所,广东 广州 510030
2. Guangzhou Forensic Science Institute, Guangzhou 510030, China
水中尸体的死因鉴定是法医学实践中亟待解决的难题之一[1-2]。多数学者认为硅藻检验是水中尸体,尤其是腐败尸体死因鉴定的有效方法[3-5]。目前,国内外法医学实验室普遍采用强酸消解-离心富集-光镜检验法观察硅藻。这种硅藻检验方法存在反应剧烈、安全性低、易污染环境、离心导致硅藻损失、检出率低等不足[6],胡孙林等[7]建立的微波消解-滤膜富集-扫描电镜联用法,具有灵敏度高,可定性定量检验硅藻等特点,但是扫描电镜(SEM)设备昂贵、操作复杂,限制了该方法的推广应用。理想的硅藻检验方法应具有检出率高、操作简单、安全,对设备要求不高,检验成本低的优点[8]。为此,作者建立了一种基于滤膜富集的光学显微镜观察法检验硅藻。该方法可以有效地将硅藻富集至滤膜上,避免了离心造成的硅藻损失;采用光学显微镜观察弥补了SEM设备昂贵、操作复杂的不足。
本研究比较了强酸消解-离心富集-光镜检验法、微波消解-滤膜富集-扫描电镜联用法和微波消解-滤膜富集-光镜检验法,旨在探讨它们在硅藻检验中各自的特点,为法医学实验室选择合适的硅藻检验方法提供参考。
1 材料与方法 1.1 仪器与试剂MW3000微波消解仪(Anton Paar公司);HL-6型多联滤膜富集装置(珠海黑马仪器公司);SIGMA 3-18K离心机(Sartorius公司);AL104-IC型天平(Mettler Toledo公司);HH-2型数显恒温水浴锅(国华电器有限公司);WS70-1型红外线快速干燥器(上海锦屏仪器仪表有限公司);聚醚砜(PES)材质滤膜及尼龙材质滤膜(直径16 mm,孔径0.45 μm,天津津腾公司);FEI Quanta 600型扫描电镜(FEI公司);Ti-S光学显微镜(NIKON公司)。浓硝酸、30%双氧水、乙酸(分析纯,广州化学试剂厂),丁香酚(分析纯,购自南京文森宝国际贸易有限公司)。
实验开始前将工具、器皿、容器使用超纯水清洗3遍;丁香酚和乙酸按照7:3的比例配制成丁香酚-乙酸试剂待用。
1.2 材料、样本与分组 1.2.1 材料新西兰大白兔10只(体质量2.5~2.9 kg,雌雄不限,购自广东省实验动物中心)耳缘静脉注射过量麻醉剂处死后提取肾脏待检;广州市区段珠江水样500 ml(2013年12月,猎德大桥处)加入甲醛溶液使其终浓度为5%,避光密闭保存。
1.2.2 样本60份实验样本(每份样本含肾脏组织2 g和珠江水样2 ml),30份空白对照样本(每份含肾脏组织2 g和超纯水2 ml)。
4份珠江水样(每份2 ml)通过滤膜富集后在扫描电镜下观察,记录硅藻数量、种类及长度;取硅藻数量的平均值作为水样中硅藻的标准数量。
1.2.3 分组实验样本随机分为强酸消解-离心富集-光镜检验法组(A组)、微波消解-滤膜富集-扫描电镜联用法组(B组)、微波消解-滤膜富集-光镜检验法组(C组),每组20份样本;空白对照样本随机均等分入A、B、C三组。
1.3 方法 1.3.1 强酸消解-离心富集-光镜检验法[9](方法A)A组样本置于烧杯中,加入8 ml浓硝酸和2 ml双氧水,置于80 ℃水浴锅中加热直至消化液澄清;将消化液以4000 r/min离心15 min;重复离心直至上清液酸碱度在6.5~7.5之间;最后吸取沉淀滴加至载玻片上,封片、置于光学显微镜下观察。记录样本前处理时间(不包括观察)及硅藻总数;随机选取4份样本记录硅藻种类及各种类数量(分类至“属”)。
1.3.2 微波消解-滤膜富集-扫描电镜联用法[7](方法B)B组样本置于消解管内,加入8 ml浓硝酸和2 ml双氧水后置于微波消解仪中消解,程序设定:(1)5 min内功率由0升至700 W,保持10 min;(2)停止消解,冷却15 min;(3)消解管中加入50 ml超纯水稀释其酸度。采用多联滤膜富集装置(配尼龙滤膜)富集硅藻,真空度为200 mmHg。富集结束后将滤膜镀上一层金膜在SEM下观察。SEM设置:加速电压20 kV,图片像素为1024×800。记录样本前处理时间(不包括观察)及硅藻总数;随机选取4份样本记录硅藻种类及各种类数量(分类至“属”)。
1.3.3 微波消解-滤膜富集-光镜检验法(方法C)C组样本置于消解管内,微波消解后采用多联滤膜富集装置(配PES滤膜)富集硅藻(仪器设置同1.3.2);将滤膜置于干燥器中干燥5~10 min;载玻片中心滴加2~3滴丁香酚-乙酸试剂,将干燥后的滤膜置于玻片中心,滤膜再次滴加1~2滴丁香酚-乙酸试剂,加盖盖玻片。将透明后的滤膜置于光学显微镜下观察。记录样本前处理时间(不包括观察)及硅藻总数;随机选取4份样本记录硅藻种类及各种类数量(分类至“属”)。
1.3.4 计算方法硅藻总回收率及各种类回收率计算公式:R=NM/NS×100%式中:NM表示使用某种方法检出的硅藻数量(或某种类下硅藻检出数量);NS表示水样中硅藻的标准数量(或某种类下硅藻检出数量)。
1.4 统计分析实验数据采用SPSS 19.0统计学软件分析,组间比较采用单因素方差分析多重比较进行数据分析,检验水准α=0.05。
2 结果 2.1 空白对照样本和水样中的硅藻数量和种类空白对照样本中均未检出硅藻。
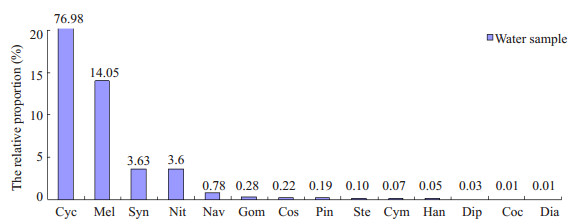
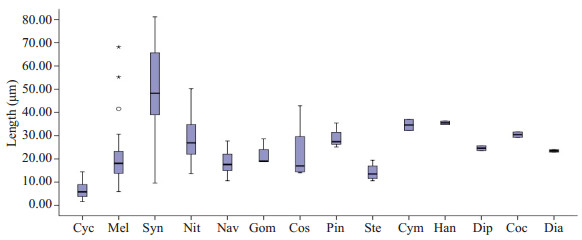
水样中的硅藻平均数量为3797.8/ml,共检出14种硅藻,各种硅藻的相对数量如图 1所示;水样中检出的硅藻种类和长度分布如图 2所示。
|
图 1 水样中各种类硅藻数量的相对比例 Figure 1 Relative contents of diatoms in water samples. Cyc: Cyclotella; Mel: Melosira; Syn: Synedra; Nit: Nitzschia; Nav: Navicula; Gom: Gomphonema; Cos: Coscinodiscus; Pin: Pinnularia; Ste: Stephanodiscus; Cym: Cymbella; Han: Hantzschia; Dip: Diploneis; Coc: Cocconeis; Dia: Diatoma. |
|
图 2 水样中检出的硅藻种类和长度分布 Figure 2 Species and sizes of diatoms in the water samples. |
方法A处理A组样品所需的时间(均数±标准差,不包括硅藻观察,余同)为230.2±4.1 min;方法B处理B组处理时间为65.5±3.3 min;方法C处理C组处理时间为51.4±4.8 min;组间比较具有统计学差异(P < 0.05)。
2.3 33种处理方法对组织消解程度的比较方法A消解组织不完全,光镜下可见较多组织残留,部分硅藻被覆盖(图 3A);方法B消解组织完全,无组织残留,硅藻表面纹理清楚(图 3B);方法C消解组织完全,无组织残留,可观察到硅藻表面纹理(图 3C)。

|
图 3 3组样品处理后观察小环藻效果比较 Figure 3 Observation of Cyclotella detected by the three methods. A: Cyclotella digested by SD-CE-LM method observed under optical microscope (original magnification: ×400); B: Cyclotella digested by MD-ME-SEM method observed under SEM (original magnification: × 8000); C: Cyclotella digested by MD-MF-LM method observed under LM (Original magnification: ×400). |
方法A处理A组样品硅藻的回收率(均值±标准差)为(2.6±1.7)%;方法B处理B组的回收率为(76.9±20.2)%;方法C处理C组的回收率为(54.2±23.1)%;组间比较具有统计学差异(P < 0.05)。
2.5 3种方法检出各硅藻种类回收率的比较如表 1所示,A、B、C组检出硅藻种类数分别为6、13、13种。A、B、C三组硅藻各种类的回收率(均值±标准差)分别是(2.95±4.11)%、(65.54±29.66)%和(45.31±29.69)%,组间比较具有统计学差异(P < 0.05)。
| 表 1 3种方法实验组各种类的硅藻回收率 Table 1 Recovery rates of diatoms by the three methods (Mean±SD) |
如表 2所示,方法A检验成本低,但应用效果差;方法B具有回收率高、种属鉴定精细的优点;方法C具有经济、高效的优点。
| 表 2 3种硅藻检验方法应用效果比较 Table 2 Comparison of the three methods for diatom test |
2014年4月12日,在广州市天河区某湖中发现一具浮尸,男性,已高度腐败。尸体解剖后取肺、肝和肾组织各3份,分别采用A、B、C三种方法进行检验。采用A方法从肺组织中检出5种硅藻,含量为421/10 g,肝、肾组织中未检出。B方法从肺组织中检出9种硅藻,含量为4116 /10 g;肝组织中检出10种硅藻,含量为80/10 g;肾组织中检出6种硅藻,含量为16/10g;水样中检出11种硅藻,含量为36115/10 ml。C方法从肺组织中检出8种硅藻,含量为2364/10 g;肝组织中检出8种硅藻,含量为56/10 g;肾组织中检出5种硅藻,含量为12/10 g。使用A方法仅从肺组织中检出5种硅藻,等量的组织使用B、C方法均检出与现场水样中相同类型的硅藻,根据该硅藻检验结果,认定该男性死因为溺死。后经公安机关调查证实,该男性为意外落水溺死。
4 讨论利用硅藻检验判定溺死标准是肺、肝、肾、牙齿、骨髓等器官内发现硅藻,且硅藻种类与现场水样一致即可诊断为溺死[8]。国内外有学者进一步研究了硅藻数量和种类分布与溺死地点的关系,提出硅藻种类分布对于溺死地点推断具有重要的价值[10-11]。目前,强酸消解-离心富集-光镜检验法以低成本、操作简单而广泛采用。但该方法存在的明显不足是反复离心导致微型硅藻大量损失[12]。有报道称,离心丢弃的上清液中,50%的硅藻长度小于15 μm,90%以上的硅藻长度小于40 μm[13];而溺死人体循环脏器中40%的硅藻长度小于15 μm,90%以上的硅藻长度小于40 μm[14]。可见该方法可导致体循环器官硅藻检出率低,甚至可出现假阴性,这对溺死诊断十分不利。
本实验结果显示,采用强酸消解-离心富集-光镜检验法处理时间最长;组织消解不完全,影响硅藻的观察和计数;硅藻总回收率最低,仅为2.95%。小环藻和冠盘藻在水样中所占的比例超过77%,但其平均长度小于15 μm,使用该方法检验2种硅藻的损失率分别为94.52%和100%,远高于微波消解-滤膜富集-扫描电镜联用法(分别为33.59%和30%)和微波消解-滤膜富集-光镜检验法(分别为51.18%和50%);异极藻、羽纹藻、桥弯藻、菱板藻、双壁藻和卵形藻在水样中的长度在15~40 μm之间,在水样中所占的比例均小于19%,使用强酸消解-离心富集-光镜检验法检验有5种硅藻漏检;针杆藻的平均长度虽然大于40 μm,但其体型细长,比重较小,离心过程易丢失,同时受光学显微镜的分辨率限制,使用该方法未检出。因此,离心法富集硅藻降低了硅藻回收率,易漏检长度小于40 μm的硅藻(如羽纹藻和冠盘藻等)和含量低于1/5的硅藻(如双壁藻和卵形藻等)。
微波消解-滤膜富集-扫描电镜联用法的处理时间为强酸消解-离心富集-光镜检验法的近1/4;组织消解完全,硅藻纹理清晰,易于观察和计数;该方法硅藻总回收率最高,达到了76.9%,各种类的回收率也高于另外两种方法,达到了96.26%。平均长度小于15 μm的小环藻和冠盘藻在水样中所占的比例接近4/5,使用该方法检验2种硅藻的回收率均大于66%;双壁藻、卵形藻、桥弯藻等7种硅藻在水样中所占的比例均小于19%,使用该方法可检出6种;对于长度小于15 μm的硅藻(如直链藻和冠盘藻等)和含量低于19%的硅藻(如双壁藻和卵形藻等)也具有较高的回收率,对鉴定溺死与溺死地点的推断十分有利,但SEM的成本较高,操作复杂,处理时间长,难以在基层法医学实验室推广,该方法对于疑难案例的溺死诊断具有优势。
微波消解-滤膜富集-光镜检验法中采用的微孔滤膜由聚醚砜(PES)材料制成,具有很强的稳定性,可用于酸性液体的超滤[15];利用PES可溶于强极性溶液的特点[16],使用丁香酚-乙酸试剂使其透明,满足光镜下观察的要求。该方法的处理时间最短,为强酸消解-离心富集-光镜检验法的近1/5,较微波消解-滤膜富集-扫描电镜联用法的时间缩短了14 min;组织消解完全,易于观察和计数;硅藻总回收率高于强酸消解-离心富集-光镜检验法,达到了54.2%。微波消解-滤膜富集-光镜检验法对小环藻和冠盘藻回收率高于强酸消解-离心富集-光镜检验法,同时水样中含量小于19%的7种硅藻检出了6种,提示该方法与强酸消解-离心富集-光镜检验法相比,对小于40 μm的硅藻和含量低于19%的硅藻回收率和种类检出率较高,且组织处理时间短,消化程度更彻底。案例应用结果说明了该方法的应用效果优于强酸消解-离心富集-光镜检验法。
滤膜富集法与光镜观察相结合,最大限度地将硅藻富集至滤膜上,避免了离心造成的硅藻损失;同时采用光学显微镜观察弥补了SEM设备昂贵、操作复杂的不足。而且,由于PES滤膜的稳定性,滤膜富集、光镜检验可与多种消解方法配合使用,如微波消解法、强酸消解法、“破机罐”法等,满足基层法医学实验室的日常检验。
综上所述,强酸消解-离心富集-光镜检验法的前处理时间长,消解不彻底;硅藻回收率低,易漏检长度小于40 μm、含量低于1/5的硅藻;微波消解-滤膜富集-扫描电镜联用法具有前处理时间较短,消解彻底;硅藻回收率高、定性定量分析准确的优点,适用于疑难案例的硅藻检验;但SEM价格昂贵、操作复杂,难以推广;微波消解-滤膜富集-光镜检验法前处理时间短,消解彻底;硅藻回收率高、种类检出全,结合其设备经济、操作简单、易于推广的特点,适用于基层法医学实验室的硅藻检验。
| [1] | Piette MH, De Letter EA. Drowning: still a difficult autopsy diagnosis[J]. Forensic Sci Int,2006, 163 (1/2) : 1-9. |
| [2] | Munro R, Munro H. Some challenges in forensic veterinary pathology: a review[J]. J Comp Pathol,2013, 149 (1) : 57-73. DOI: 10.1016/j.jcpa.2012.10.001. |
| [3] | Merck M.Diatoms. Veterinary Forensics: Animal Cruelty Investigations[M]. 2007 : 166 -8. |
| [4] | Ago K, Hayashi T, Ago M, et al. The number of diatoms recovered from the lungs and other organs in drowning deaths in bathwater[J]. Leg Med,2011, 13 (4) : 186-90. DOI: 10.1016/j.legalmed.2011.04.002. |
| [5] | Thakar MK, Singh R. Diatomological mapping of water bodies for the diagnosis of drowning cases[J]. J Forensic Leg Med,2010, 17 (1) : 18-25. DOI: 10.1016/j.jflm.2009.07.016. |
| [6] | Ming M, Meng XZ, Wang EY. Evaluation of four digestive methods for extracting diatoms[J]. Forensic Sci Int,2007, 170 : 29-34. DOI: 10.1016/j.forsciint.2006.08.022. |
| [7] | Hu SL, Liu C, Wen JF, et al. Detection of diatoms in water and tissues by combination of microwave digestion, vacuum filtration and scanning electron microscopy[J]. Forensic Sci Int,2013, 226 (1/ 3) : E48-51. |
| [8] | 赵子琴. 法医病理学[M]. 北京: 人民卫生出版社, 2012 : 316 -31. |
| [9] | 中华人民共和国公安部, GA/T 813-2008.人体组织器官中硅藻硝酸破机法检验[M].北京:中国标准出版社, 2009. |
| [10] | Benjamin P, Steve B, Caroline H. The development and application of a diatom-based quantitative Reconstruction technique in forensic science[J]. J Forensic Sci,2006, 3 (51) : 643-50. |
| [11] | Zhao J, Wang YZ, Zhang YJ, et al. Types of diatoms in China's three major rivers and the possible application for an automatic forensic diatom test[J]. Australian J of Forensic Sciences,2014 : 937. |
| [12] | Zhao J, Liu C, Hu SL, et al. Microwave Digestion-Vacuum Filtration-Automated scanning electron microscopy as a sensitive method for forensic diatom test[J]. Int J Legal Med,2013, 127 (2) : 459-63. DOI: 10.1007/s00414-012-0756-9. |
| [13] | 苏会芳, 刘超, 胡孙林, 等. 微波消解-扫描电镜联用法在溺死诊断中的应用[J]. 中国法医学杂志,2012, 27 (2) : 97-100. |
| [14] | Hurlimann J, Feer P, Elber F, et al. Diatom detection in the diagnosis of death by drowning[J]. Int J Legal Med,2000, 114 (1/ 2) : 6-14. |
| [15] | 王倩, 王铎, 娄红瑞, 等. 新型聚醚砜超滤膜的制备与表征[J]. 膜科学与技术,2008, 28 (6) : 9-13. |
| [16] | 任彦荣, 李志强. 磺化聚醚砜的研究及其应用进展[J]. 化学推进剂与高分子材料,2005, 3 (2) : 23-7. |
 2015, Vol. 35
2015, Vol. 35
