2. 解放军总医院 神经内科,北京 100853
2. Department of Neurology, General Hospital of PLA, Beijing 100853, China
B淋巴细胞活化因子(BAFF)属肿瘤坏死因子超家族成员,对B细胞的增殖、分化及生存起重要作用[1]。BAFF水平异常影响产生自身抗体B细胞的存活信号通路,从而诱发疾病[2]。BAFF与自身免疫性疾病的关系非常密切。已有研究证实,BAFF在系统性红斑狼疮、类风湿关节炎、干燥综合征、重症肌无力等自身免疫疾病的发病中扮演重要角色。BAFF在多发性硬化(MS)中的作用也逐渐引起学者的重视。未经治疗的MS患者,外周血清BAFF水平与健康正常人无差异,经干扰素-β(IFN-β)治疗的MS患者外周血清中BAFF水平明显升高[3]。BAFF受体表达缺陷的MS动物模型实验性自身免疫性脑脊髓炎(EAE),BAFF水平增高,病情加重,提示BAFF可能通过其受体通路参与了MS的发病过程[4]。Zhou等[5]进一步研究发现,BAFF影响Th17细胞的生成,BAFF的拮抗剂有可能成为治疗MS的有效手段。
BAFF在NMO发病中的作用目前还不完全清楚。本研究将探讨NMO患者血清及脑脊液中BAFF的表达情况,明确BAFF能否作为一种生物标记物,以鉴别NMO和MS。同时结合扩展残疾评分(EDSS)和水通道蛋白4(AQP4)抗体滴度,判定BAFF在推测NMO疾病的活动性中可能起到的作用。
1 对象和方法 1.1 对象收集2012年4月~2013年10月就诊于解放军总医院门诊及住院部的NMO和MS患者的临床资料,所有患者均为急性复发期,临床类型为复发-缓解型(急性复发期定义:患者出现新的神经缺损症状体征,持续时间至少24 h或以上,EDSS评分增加≥1分)。其中NMO患者44例,符合2006年修订的NMO诊断标准;MS患者38例,符合2010年的Mcdonald诊断标准。对照组血清标本来自体检中心健康正常人,共30例;对照组脑脊液标本来自同期住院的非炎性神经系统疾病住院患者共15例(其中运动神经元病9例,偏头痛4例,低颅压综合征2例)。所有研究对象6个月内均未服用任何影响免疫功能的药物(如肾上腺皮质激素、免疫抑制剂或其他免疫调节剂等)。NMO和MS患者在急性复发期1周内,应用大剂量皮质类固醇激素治疗前采集血清及脑脊液标本。
1.2 方法 1.2.1 标本采集所有受试对象在征得知情同意后,抽取晨起空腹静脉血2管,每管4 ml,置EDTA抗凝管中,其中一份静脉血在室温条件下以3000 r/min离心15 min,取上清,置于EP管中-80 ℃冰箱保存备用。另一份送检AQP4抗体滴度。签署腰椎穿刺知情同意书后,留取脑脊液4 ml,置于EP管中-80 ℃冰箱保存备用。所有标本统一进行检测。
1.2.2 主要仪器设备及试剂RT-6000酶标分析仪(中国深圳雷杜生命科学股份有限公司);人BAFF/BLyS/ TNFSF13B/ELISA试剂盒(美国R & D Systems)。
1.2.3 临床资料收集登记所有研究对象的性别、年龄、病程、用药史、复发次数和EDSS评分等项目。其中EDSS评分由两名神经科医生来完成。
1.2.4 AQP4抗体滴度测定患者的一份血清送至德国柏林医学诊断检验中心,采用细胞间接免疫荧光法检测血清AQP4抗体滴度[6]。
1.2.5 血清及脑脊液中BAFF水平的测定采用ELISA方法进行检测,按试剂盒说明书进行。
1.3 统计学分析应用SPSS15.0软件完成。计量资料以均数±标准差表示,各组间比较采用t检验,BAFF水平与EDSS评分,BAFF水平与AQP4抗体滴度之间的相关性,采用Pearson相关分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 研究对象的一般资料NMO患者44例,其中女性33例,男性11例,平均发病年龄35.0±10.2岁(12~64岁),平均病程15.6±10.3年,平均复发次数4.0±1.8次,平均EDSS评分4.1±2.0,AQP4-Ab阳性率为72.7%(32/44);MS患者38例,其中女性29例,男性9例,平均发病年龄37.2±11.7岁(14~70岁),平均病程17.8±12.3年,平均复发次数3.2±2.1次,EDSS评分2.6±1.5,AQP4-Ab阳性率为0%(0/38);对照组A(采集血清标本)30例,其中女性23例,男性7例,平均年龄39.0±6.2岁;对照组B(采集脑脊液标本)15例,其中女性11例,男性4例,平均年龄36.1±6.5岁。各组间在性别、年龄方面无统计学差异。
2.2 血清及脑脊液中BAFF水平测定结果NMO组血清BAFF平均水平为250.2±126.9 pg/ml,MS组血清BAFF平均水平为249.6±130.7 pg/ml,对照组血清BAFF平均水平为222.9±126.1 pg/ml,3组间两两比较差异无统计学意义(P>0.05);与对照组(脑脊液BAFF平均水平为141.4±76.2 pg/ml)比较,NMO组和MS组脑脊液BAFF水平(分别为525.8±230.0 pg/ml和298.4±141.9 pg/ml)明显升高,差异具有统计学意义(P < 0.01);与MS组比较,NMO组脑脊液BAFF水平明显升高,差异具有统计学意义(P < 0.01)。
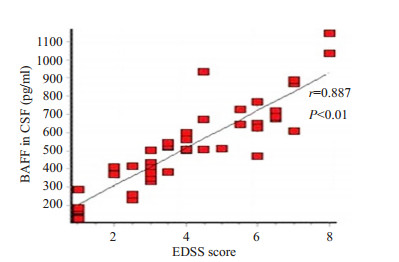
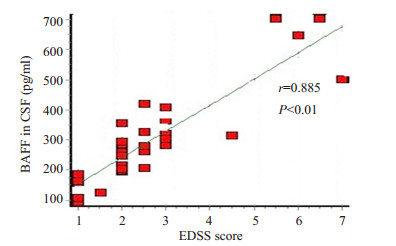
2.3 脑脊液BAFF水平与EDSS评分的关系NMO组、MS组脑脊液中BAFF水平均与EDSS评分存在相关性,EDSS评分越高,其脑脊液中BAFF水平越高(图 1、2)。
|
图 1 NMO组脑脊液中BAFF水平与EDSS评分的关系 Figure 1 Relationship between CSF BAFF levels and EDSS scores in NMO group. |
|
图 2 MS组脑脊液中BAFF水平与EDSS评分的关系 Figure 2 Relationship between CSF BAFF levels and EDSS scores in MS group. |
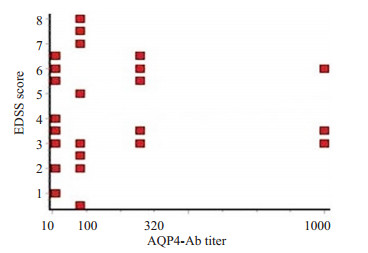
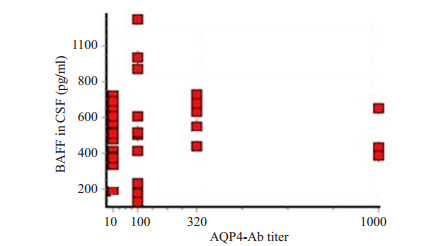
44例NMO患者中,AQP4-Ab阳性者共有32例。NMO组EDSS评分与血清AQP4-Ab滴度不具有相关性(图 3),脑脊液BAFF水平与血清AQP4-Ab滴度也不具有相关性(图 4)。
|
图 3 NMO组EDSS评分与AQP4-Ab滴度的关系 Figure 3 Relationship between EDSS scores and AQP4-Ab titer in NMO group. |
|
图 4 NMO组脑脊液中BAFF水平与AQP4-Ab滴度的关系 Figure 4 Relationship between CSF BAFF level and AQP4-Ab titer in NMO group. |
在一些系统性自身免疫性疾病,如系统性红斑狼疮和类风湿关节炎,血清中BAFF水平明显增高[7-8],而在一些器官特异性自身免疫性疾病,如胆汁性肝硬变和自身免疫性糖尿病,并未发现血清中BAFF水平表达异常[9-10]。NMO、MS作为仅累及CNS的自身免疫性疾病,我们推测其BAFF的表达可能与器官特异性自身免疫疾病类似。本研究结果验证了我们的假设,NMO组、MS组血清BAFF的水平与健康正常人比较未发现差异,血清BAFF水平尚不能作为NMO和MS鉴别诊断的生物标记物。但是,有学者发现,应用IFN-β或醋酸格拉替雷治疗的MS患者,血清BAFF水平明显升高,是监测MS患者药物治疗反应的有效指标之一[11]。Nakashima等[12]发现,应用针对B细胞表面CD20标记的利妥昔单抗治疗NMO的最初两周,患者会出现一过性的病情加重,其原因是血清中BAFF水平升高,介导了AQP4抗体滴度的一过性升高。IFN-β和醋酸格拉替雷是治疗MS的两种重要药物,但若应用于NMO患者,可能疗效甚微,甚至会使患者病情恶化,其原因可能与血清BAFF表达水平上调,B细胞活化,导致抗体介导的自身免疫反应增强有关。对于接受药物治疗的NMO和MS患者,血清BAFF不仅可以监测治疗反应,有时可能是二者鉴别诊断的有效生物标记物。
本研究同时发现,NMO组、MS组脑脊液中BAFF水平较对照组明显升高,并且NMO组脑脊液中BAFF水平较MS组升高更加明显。此结果与国外一项研究报道一致,一小样本(n=8)白种人群NMO患者,脑脊液中BAFF表达水平明显升高[13]。NMO是一种星形胶质细胞疾病,其星形胶质细胞损伤比髓鞘脱失更加严重。星形胶质细胞作为一种抗原呈递细胞,在激活或损伤后,分泌多种细胞因子,从而触发免疫反应[14]。在CNS,BAFF主要由星形胶质细胞产生,推测NMO组脑脊液中BAFF水平升高与星形胶质细胞的激活或损伤有关。BAFF水平升高,影响B细胞的存活、分化,进一步使B细胞产生的自身抗体AQP4抗体上调,从而促发NMO的病理生理过程。通过对血清细胞因子进行研究,有学者发现,NMO患者较MS患者的炎性反应及抗炎症反应过程更为剧烈[15]。这点也可解释NMO组患者脑脊液中BAFF水平为何较MS组患者更为升高。星形胶质细胞-BAFF-B细胞-AQP4抗体环路可能是参与NMO发病的重要机制之一。
本研究还发现,NMO和MS急性复发期,脑脊液中BAFF水平与EDSS评分存在相关性,说明脑脊液中BAFF水平可作为推测NMO和MS疾病严重程度的一项重要生物标记物。AQP4抗体滴度可能与NMO疾病活动性具有一定相关性。NMO急性复发期AQP4抗体滴度升高,缓解期AQP4抗体滴度下降[16]。但此方面的研究结论不尽一致。本研究结果与Hinson等[17]报道一致,未发现AQP4抗体滴度与EDSS评分具有相关性,也未发现AQP4抗体滴度与脑脊液中BAFF水平具有相关性。可能与采用的AQP4抗体滴度的测定方法、研究的样本量等因素有关。同时,AQP4抗体滴度升高,并不一定预示着急性复发,急性复发期的NMO患者,也并不一定都存在AQP4抗体滴度的升高[18]。
利妥昔单抗对预防NMO复发具有一定的疗效。但是,利妥昔单抗治疗自身免疫性疾病时,患者往往出现血清BAFF水平升高[12]。当治疗停止时,体内新生的不成熟细胞在高水平BAFF环境下,可能会触发新的自身免疫过程而加重病情。BAFF有3种受体:TACI、BCMA和BAFF R受体。在许多B细胞亚群表面BAFF受体与CD20表达有重叠,但对于浆细胞,表面只表达BCMA而无CD20。因此若能以BAFF受体为治疗靶点,效果可能会优于利妥昔单抗。鉴于NMO患者脑脊液中BAFF水平明显增高,血清BAFF水平与对照组表达无差异,进一步研究可透过血脑屏障的BAFF拮抗剂,可能会成为治疗NMO的新方法。
综上所述,NMO患者脑脊液中BAFF水平明显升高,且与EDSS评分具有相关性,脑脊液中BAFF水平可作为NMO与MS鉴别诊断、判定病情严重程度的生物标记物之一。我们应进一步开展免疫学研究,探讨星形胶质细胞-BAFF-B细胞-AQP4-Ab环路在NMO发病机制中的作用,并以BAFF及其受体为治疗靶点,可能会为NMO的治疗提供新的手段。
| [1] | Shu HB, Hu WH, Johnson H, et al. TALL-1 is a novel member of the TNF family that is down-regulated by mitogens[J]. J Leukoc Biol,1999, 65 (5) : 680-3. |
| [2] | Cancro MP, D'Cruz DP, Khamashta MA, et al. The role of B lymphocyte stimulator (BLyS) in systemic lupus erythematosus[J]. J Clin Invest,2009, 119 (5) : 1066-73. DOI: 10.1172/JCI38010. |
| [3] | Krumbholz M, Faber H, Steinmeyer F, et al. Interferonbeta increases BAFF levels in multiple sclerosis: implications for B cell autoimmunity[J]. Brain,2008, 13l (Pt6) : 1455-63. |
| [4] | Kim SS, Richman DP, Zamvil SS, et al. Accelerated central nervous system autoimmunity in BAFF-receptor-deficient mice[J]. J Neurol Sci,2011, 306 (1-2) : 9-15. DOI: 10.1016/j.jns.2011.04.008. |
| [5] | Zhou X, Xia Z, Lan Q, et al. BAFF promotes Th17 cells and aggravates experimental autoimmune encephalomyelitis[J]. PLoS One,2011, 6 (8) : e23629. DOI: 10.1371/journal.pone.0023629. |
| [6] | Takahashi T, Fujihara K, Nakashima I, et al. Establishment of a new sensitive assay for anti-human aquapotin-4 antibody inneuromyelitis optica[J]. Tohoku J Exp Med,2006, 210 (4) : 307-13. DOI: 10.1620/tjem.210.307. |
| [7] | Su DL, Lu ZM, Shen MN, et al. Roles of pro-and anti-inflammatory cytokines in the pathogenesis of SLE[J]. J Biomed Biotech,2012 : 347141. |
| [8] | Woo YJ, Yoon BY, Jhun JY, et al. Regulation of B cell activating factor (BAFF) receptor expression by NF-kB signaling in rheumatoid arthritis B cells[J]. Exp Mol Med,2011, 43 (6) : 350-7. DOI: 10.3858/emm.2011.43.6.038. |
| [9] | Zhang B, Hu M, Zhang P, et al. BAFF promotes regulatory T-cell apoptosis and blocks cytokine production by activating B cells in primary biliary cirrhosis[J]. Braz J Med Biol Res,2013, 46 (5) : 433-9. DOI: 10.1590/1414-431X20132665. |
| [10] | Mackay IR, Groom J, Mackay CR. Levels of BAFF in serum in primary biliary cirrhosis and autoimmune diabetes : J][J]. Autoimmunity,2002, 35 (8) : 551-3. DOI: 10.1080/0891693021000066333. |
| [11] | Krumbholz M, Faber H, Steinmeyer F, et al. Interferonbeta increases BAFF levels in multiple sclerosis: implications for B cell autoimmunity[J]. Brain,2008, 131 (Pt6) : 1455-63. |
| [12] | Nakashima I, Takahashi T, Cree BA, et al. Transient increases in anti-aquaporin-4 antibody titers following rituximabtreatment in neuromyelitis optica, in association with elevated serum BAFF levels[J]. JClinNeurosci,2011, 18 (7) : 997-8. |
| [13] | Vaknin-Dembinsky A, Brill L, Orpaz N, et al. Preferential increase of B-cell activating factor in the cerebrospinal fluid of neuromyelitis optica in a white population[J]. Mult Scler,2010, 16 (12) : 1453-7. DOI: 10.1177/1352458510380416. |
| [14] | Farina C, Aloisi F, Meinl E. Astrocytes are active players in cerebral innate immunity[J]. Trends Immunol,2007, 28 (3) : 138-45. DOI: 10.1016/j.it.2007.01.005. |
| [15] | Wang KC, Lee CL, Chen SY, et al. Distinct serum cytokine profiles in neuromyelitis optica and multiple sclerosis[J]. J Interferon Cytokine Res,2013, 33 (2) : 58-64. DOI: 10.1089/jir.2012.0040. |
| [16] | Takahashi T, Fujihara K, Nakashima I, et al. Anti-aquaporin-4 antibody is involved in the pathogenesis of NMO: a study on antibody titre[J]. Brain,2007, 130 (Pt 5) : 1235-43. |
| [17] | Hinson SR, McKeon A, Fryer JP, et al. Prediction of neuromyelitis optica attack severity by quantitation of complement-mediated injury to aquaporin-4-expressing cells[J]. Arch Neurol,2009, 66 (9) : 1164-7. |
| [18] | Jarius S, Aboul-Enein F, Waters P, et al. Antibody to aquaporin-4 in the long-term course of neuromyelitis optica[J]. Brain,2008, 131 (Pt 11) : 3072-80. |
 2015, Vol. 35
2015, Vol. 35
