2. 上海吉凯基因化学技术有限公司,上海 201203 ;
3. 上海中医药大学附属曙光医院石氏伤科医学中心,上海 201203 ;
4. 上海市中医药研究院骨伤科研究所,上海 201203
2. Shanghai Genechem Co. Ltd, Shanghai 201203, China ;
3. Shi's Center of Orthopedics and Traumatology, Shuguang Hospital Affiliated to Shanghai University of TCM, Shanghai 201203, China ;
4. Institute of Traumatology and Orthopedics, Shanghai Academy of Traditional Chinese Medicine, Shanghai 201203, China
正常的软骨结构是由细胞外基质如Ⅱ型胶原和可聚蛋白聚糖(aggrecan为主)组成。为维持软骨结构完整,基质成份通过基质降解酶如MMP13和ADAMTS5不断进行更新和重塑,基质的降解和合成基质同时进行,从而维持软骨结构的完整[1-4]。当软骨组织中这种合成和降解失衡时,软骨细胞退变和炎症。
Wnts/β-catenin信号通路是最常见的调控软骨退变和骨关节炎信号通路之一[5],关于软骨退变的治疗研究以Wnts/β-catenin信号通路为靶点[6-9],此通路的激活由其上游因子激活,在众多的Wnt分子中,目前发现Wnt7b分子和软骨退变及骨关节炎的发病最为密切[10]。Wnt7b目前无商业化生产,对骨关节炎机制的研究存在局限性,尤其针对由此通路的药物筛选更为局限。因此本研究针对此,在真核细胞中表达Wnt7b因子并且对其致软骨退变的功能进行鉴定,并建立体外的软骨退变模型。
1 材料与方法 1.1 实验材料 1.1.1 动物新生SD大鼠8只购自上海西普尔-必凯实验动物有限公司,动物合格证号:SCXK (沪2013-0016)。
1.1.2 药物与试剂高糖DMEM培养基、胎牛血清、胰蛋白酶、双抗、磷酸盐缓冲液片剂均购自于Biowest;Ⅱ型胶原酶(美国Sigma);GAPDH(CST#2118S)、Col2a1(SC-52658),MMP13(SC-30073),MMP3(17873-1-AP),Wnt7b(Santscruz),山羊抗兔二抗(货号7074P2);RIPA裂解液、PMSF购自上海碧云天公司;BCA蛋白定量试剂盒(美国Pierce产品);trizol试剂(Invitrogen),AMV逆转录酶(Takara)。重组酶(Novoprotein),PCDH-GFP载体(SBI)。
1.2 方法 1.2.1 软骨细胞培养和形态学观察采用本研究所已经成熟的软骨细胞培养方法,将10只新生24 h SD大鼠75%酒精浸泡5 min麻醉处死,取出四肢关节处软骨,0.1%的Ⅱ型胶原酶消化1 h,重复3~4次,收集消化的细胞悬液,1000 r/min,离心10 min取细胞沉淀,培养于含10%FBS及双抗的高糖DMEM培养基中。取P1代细胞进行实验。分别用对照培养基和Wnt7b培养基培养软骨细胞,为快速诱导软骨细胞退变,含Wnt7b的上清分别进行低倍数稀释(10倍和50倍),本实验中细胞分为3组:对照组、含Wnt7b上清10倍稀释组和50倍稀释组。倒置显微镜下观察各组软骨细胞的密度与形态。
1.2.2 克隆人Wnt7b基因至PCDH-GFP载体人Wnt7b基因PCR引物上游引物序列attctagagctagcgcgccaccATGCACAGAAACTTTCGCAAGT,下游引物序列:atccatttaaattcgTCACTTGCAGGTGAAGACC,斜体部分为和载体PCDH-GFP相同的重组序列。扩增大小为1050 bp,分别经核酸电泳回收、重组转化、菌落PCR鉴定和测序得到PCDH-Wnt7b重组质粒。
1.2.3 Western Blot法检测蛋白表达蛋白样品处理:原代细胞培养于含Wnt7b的培养基中,24 h后裂解细胞和蛋白浓度测定,蛋白变性后备用。
Western blot测定:蛋白样品电泳和转膜,10%BSA室温封闭1 h;一抗用封闭液1:1000稀释,4 ℃孵育过夜,TBST洗膜4次,每次10 min;二抗室温孵育1 h,二抗用TBST 1:20 000稀释,TBST洗膜4次,每次10 min;化学发光法检测,X胶片曝光显影。
1.2.4 Real time PCR检测基因表达原代软骨细胞培养于不同稀释度Wnt7b因子中24 h,抽提总RNA及浓度,取2 μg RNA逆转录。进行Real time PCR检测。引物序列如下A-can上游:GCAGGGATAACGGACTGA AG,A-can下游:GAGTAAAGTGGTCATA GTTCAG CTTG;Sox9上游:ATCTTCAAGGCGCTGCAA,Sox9下游:CGGTGGACCCTGAGATTG;ADAMTS5上游AGCCATCCTGTTCACCAGAG,ADAMTS5下游:CATTCCCAGGGTGTCACAT;GAPDH上游:TTCAA CGGCACAGTCAAGG,GAPDH下游:CTCAGCACCAGCATCACC。
1.3 统计学方法所有数据以均数±标准差表示,用SPSS15.0软件进行统计分析,组间差异采用单因素方差分析中LSD-t检验,P < 0.05为差异有统计学意义。
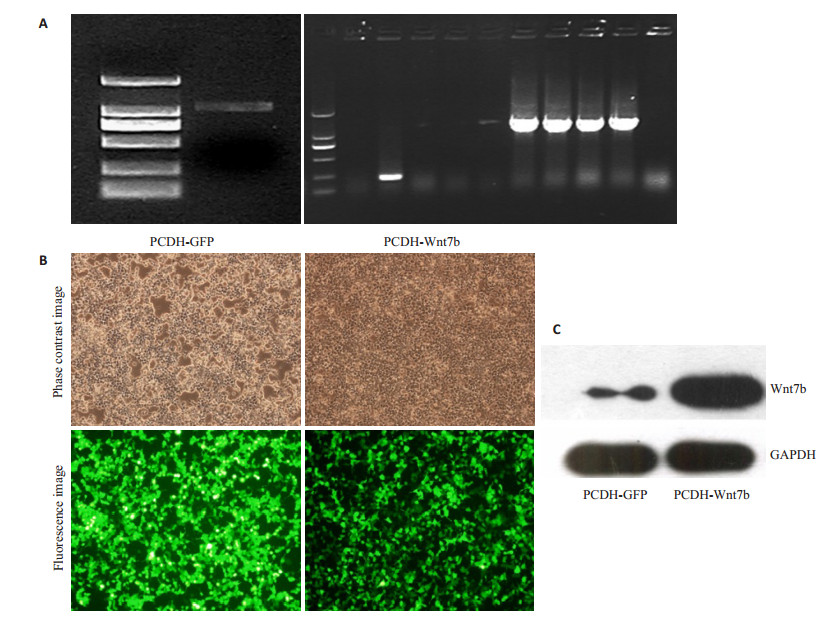
2 结果 2.1 构建PCDH-Wnt7b重组质粒转染293ft细胞及鉴定其表达PCR扩增人Wnt7b基因,大小为1050 bp,如(图 1A)的左图,克隆至PCDH-GFP空载体上得到PCDHWnt7b重组质粒,菌落PCR筛选10个菌落,其中有4个为阳性菌落,如(图 1A)的右图。测序正确后,PCDHGFP和PCDH-Wnt7b分别转染293ft细胞,分别见(图 1B)的PCDH-GFP组和PCDH-Wnt7b组,转染48 h后,分别检测PCDH-GFP组和PCDH-Wnt7b组的Wnt7b的蛋白表达(图 1C)。
|
图 1 在293ft中高效表达PCDH-Wnt7b重组质粒 Figure 1 Efficient expression of PCDH-Wnt7b in 293ft cell line. A: Agarose electrophoresis of Wnt7b gene (left) and positive colonies of bacteria screened by PCR (rught); B: 293ft cell line at 48 h after transfection with PCDH-GFP and PCDH-Wnt7b (Original magnification: ×200); C: Expression levels of Wnt7b in 293ft cell line at 48 h after transfection with PCDH-GFP and PCDH-Wnt7b. |
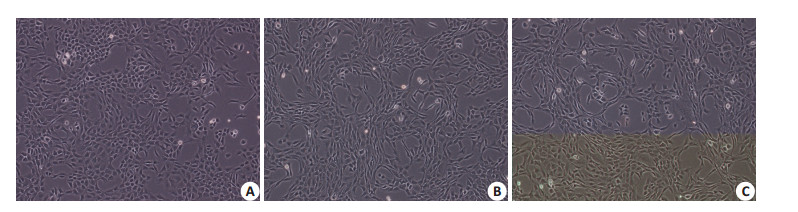
培养24 h后,对照组细胞呈多角形、短梭形等形态,紧密排列成铺路石状;Wnt7b组细胞形态逐渐变得细长(图 2)。
|
图 2 倒置显微镜下各组细胞形态观察 Figure 2 Cell morphology observed under inverted microscope (Original magnification: ×100). A: Control group; B, C: Cells cultured in the supernatant containing Wnt7b at 10-fold and 50 fold dilution, respectively. |
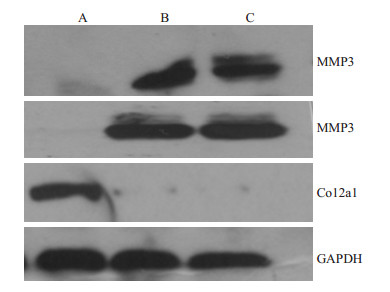
含Wnt7b因子的培养基分别稀释10倍(B组)和50倍(C组)后培养软骨细胞,24 h后分别检测对照组(A组)和实验组(B组和C组)的MMP3、MMP13和Ⅱ型胶原的蛋白表达(图 3)。
|
图 3 Wnt7b对Ⅱ型胶原和基质金属蛋白酶MMP3及MMP13的蛋白表达影响 Figure 3 Effect of Wnt7b on protein expressions of type Ⅱ collagen, MMP3 and MMP13. Wnt7 promoted the degradation of type Ⅱ collagen and increased the expression of MMP3 and MMP13 in the chondrocytes cultured in the supernatant at 10-fold and 50-fold dilutions. |
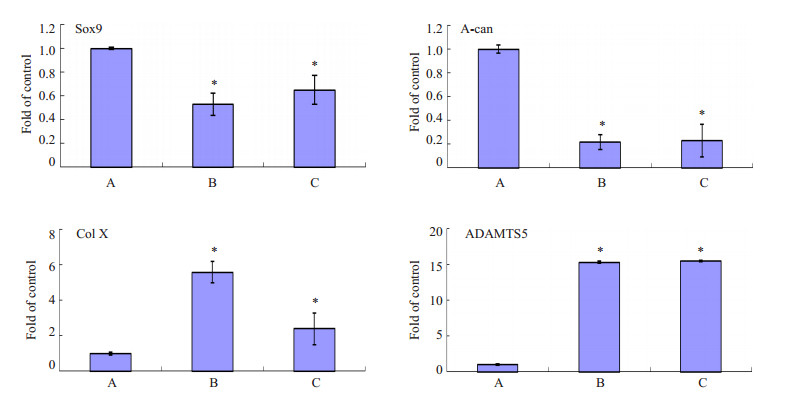
含Wnt7b因子的培养基分别稀释10倍(B组)和50倍(C组)后培养软骨细胞,24 h后分别检测对照组(A组)和实验组(B组和C组)的Sox9、A-can和Ⅹ型胶原(ColⅩ)及ADAMTS5的mRNA的表达(图 4)。
|
图 4 Wnt7b对Sox9、A-can、ColⅩ和ADAMTS5基因的mRNA的表达影响 Figure 4 Effect of Wnt7b on the mRNA expressions of Sox9, A-can, ColⅩ and ADAMTS5. A: Control group; B, C: Cells cultured in the supernatant containing Wnt7b at 10-fold and 50 fold dilution, respectively. Compare with control group, *P < 0.05. |
骨关节炎是导致老年人疼痛和行动不便的主要原因之一,对于晚期的骨关节炎,除了改善症状,关节置换手术常常是有必要的。研究其发病机制并找出其治疗靶点尤为重要。本文中通过扩增人的Wnt7b基因在真核细胞中过表达,收集细胞上清进行稀释后培养软骨细胞,分别从软骨细胞形态改变、和基因表达改变方面进行观察和比较。
含Wnt7b因子的培养基干预软骨细胞,在24 h后即可见软骨细胞形态发生显著改变,细胞由原来的多角形变成长梭形,而对照培养基培养的细胞变得更为细长,失去软骨细胞原有的形态特征,提示软骨细胞可能发生退变,但需进一步从基因表达的改变进行确定。
关节软骨细胞外基质的丢失是导致退行性骨关节炎和其他炎性关节炎的共同特征[11-12],关节软骨细胞基质主要由Ⅱ型胶原和蛋白多聚糖构成。因此判断软骨退变的关键在于Ⅱ型胶原和蛋白多聚糖的降解与否及调控基因的表达。通过检测Ⅱ型胶原、基质金属蛋白酶(包括MMP13和MMP3)的蛋白表达水平,发现经过Wnt7b因子干预的细胞Ⅱ型胶原发生显著的降解,而在正常软骨细胞中低表达的MMP13和MMP3,经过Wnt7b因子的作用,表达水平显著提高。符合软骨退变的基因改变特征。
蛋白多聚糖在软骨细胞中起到支撑作用,其中以Aggrecan基因为代表,Wnt7b因子明显下调aggrecan (A-can)的mRNA表达水平,说明软骨细胞中蛋白多聚糖发生降解。Aggrecan基因的表达水平是主要受到ADAMTS5基因的调控作用,在Wnt7b作用下,相对于对照组细胞,ADAMTS5基因的核酸水平显著提高,进一步说明Wnt7b不仅通过上调MMP13和MMP3的表达来对Ⅱ型胶原蛋白进行降解,同时通过提高ADAMTS5的表达来降解蛋白多聚糖,从而使软骨细胞发生退变作用。
Sox9是软骨细胞中标志性的转录因子,调控软骨细胞中蛋白多聚糖和Ⅱ型胶原的表达[13-14]。具有保持软骨细胞的细胞表型而抑制软骨细胞退变的作用[15],在本研究中发现Wnt7b因子明显下调Sox9的表达。除了以上基因的对软骨细胞退变的调控作用,ColⅩ为软骨退变过程中重要的标志基因,在Wnt7b因子干预后,发现此基因的表达水平也明显提高,进一步证明Wnt7b的促软骨退变作用。
通过在293ft细胞中表达Wnt7b因子并干预软骨细胞,发现对软骨细胞的形态改变、诱导软骨基质蛋白降解及上调基质降解酶均具有明显的效应,说明表达的Wnt7b因子具有生物活性和功能,同时Wnt7b可作为软骨退变的防治靶点,但Wnt7b如何通过Wnts/β-catenin通过调控软骨细胞的退变目前还未有研究。本研究成功构建表达Wnt7b因子并对功能进行验证,对后续的研究提供可靠的实验基础。
| [1] | Troeberg L, Nagase H. Proteases involved in cartilage matrix degradation in osteoarthritis[J]. Biochim Biophys Acta,2012, 1824 (1, SI) : 133-45. DOI: 10.1016/j.bbapap.2011.06.020. |
| [2] | Lin EA, Liu CJ. The role of ADAMTSs in arthritis[J]. Protein Cell,2010, 1 (1) : 33-47. DOI: 10.1007/s13238-010-0002-5. |
| [3] | Wu CW, Tchetina EV, Mwale F, et al. Proteolysis involving matrix metalloproteinase 13 (collagenase-3) is required for chondrocyte differentiation that is associated with matrix mineralization[J]. J Bone Miner Res,2002, 17 (4) : 639-51. DOI: 10.1359/jbmr.2002.17.4.639. |
| [4] | Dahlberg L, Billinghurst RC, Manner P, et al. Selective enhancement of collagenase-mediated cleavage of resident type II collagen in cultured osteoarthritic cartilage and arrest with a synthetic inhibitor that spares collagenase 1(matrix metalloproteinase 1)[J]. Arthritis Rheum,2000, 43 (3) : 673-82. DOI: 10.1002/1529-0131(200003)43:3<673::AID-ANR25>3.0.CO;2-8. |
| [5] | Zhu M, Tang D, Wu Q, et al. Activation of beta-catenin signaling in articular chondrocytes leads to osteoarthritis-like phenotype in adult beta-catenin conditional activation mice[J]. J Bone Miner Res,2009, 24 (1) : 12-21. DOI: 10.1359/jbmr.2009.24.issue-1. |
| [6] | Takamatsu A, Ohkawara B, Ito M, et al. Verapamil protects against cartilage degradation in osteoarthritis by inhibiting Wnt/beta-Catenin signaling[J]. PLoS One,2014, 9 (3) : e92699. DOI: 10.1371/journal.pone.0092699. |
| [7] | Enochson L, Stenberg J, Brittberg M, et al. GDF5 reduces MMP13 expression in human chondrocytes via DKK1 mediated canonical Wnt signaling inhibition[J]. Osteoarthritis Cartilage,2014, 22 (4) : 566-77. DOI: 10.1016/j.joca.2014.02.004. |
| [8] | Oh H, Chun CH, Chun JS. Dkk-1 expression in chondrocytes inhibits experimental osteoarthritic cartilage destruction in mice[J]. Arthritis Rheum,2012, 64 (8) : 2568-78. DOI: 10.1002/art.34481. |
| [9] | Zhou XD, Li WJ, Jiang LF, et al. Tetrandrine inhibits the Wnt/ beta-Catenin signalling pathway and alleviates osteoarthritis: an in-vitro and in vivo study[J]. Evid Based Complement Alternat Med,2013 : 809579. DOI: 10.1155/2013/809579. |
| [10] | Ma B, van Blitterswijk CA, Karperien M. A Wnt/beta-catenin negative feedback loop inhibits interleukin-1-induced matrix metalloproteinase expression in human articular chondrocytes[J]. Arthritis Rheum,2012, 64 (8) : 2589-600. DOI: 10.1002/art.34425. |
| [11] | Aigner T, Sachse A, Gebhard PM, et al. Osteoarthritis: patho-biology-targets and ways for therapeutic intervention[J]. Adv Drug Deliv Rev,2006, 58 (2) : 128-49. DOI: 10.1016/j.addr.2006.01.020. |
| [12] | Goldring MB. Update on the biology of the chondrocyte and new approaches to treating cartilage diseases[J]. Best Pract Res Clin Rheumatol,2006, 20 (5) : 1003-25. DOI: 10.1016/j.berh.2006.06.003. |
| [13] | Bell DM, Leung KK, Wheatley SC, et al. SOX9 directly regulates the type-Ⅱ collagen gene[J]. Nat Genet,1997, 16 (2) : 174-8. DOI: 10.1038/ng0697-174. |
| [14] | Sekiya I, Tsuji K, Koopman P, et al. SOX9 enhances aggrecan gene promoter/enhancer activity and is up-regulated by retinoic acid in a cartilage-derived cell line, TC6[J]. J Biol Chem,2000, 275 (15) : 10738-44. DOI: 10.1074/jbc.275.15.10738. |
| [15] | Okubo Y, Reddi AH. Thyroxine downregulates Sox9 and promotes chondrocyte hypertrophy[J]. Biochem Biophys Res Commun,2003, 306 (1) : 186-90. DOI: 10.1016/S0006-291X(03)00912-4. |
 2015, Vol. 35
2015, Vol. 35