正常子宫内膜仅在一个极短的关键时期允许胚胎植入,这一时期称为围着床期,此期是妊娠发生与启动的关键时期[1]。近年来,巨噬细胞(macrophage, Mφ)在胚胎植入中发挥的作用引起不少学者的关注。已有研究报道:早孕妇女的子宫内膜分布有大量Mφ,主要分布在蜕膜和螺旋动脉周围,此乃胚胎着床和蜕膜发生的部位;且发现子宫内膜中Mφ的分布不平衡,非着床部位Mφ占淋巴细胞的比例下降[2]。虽然Mφ在子宫中的动态分布已有报道,但是Mφ与着床的相关性国内尚未见研究报道。由于伦理学因素和技术的限制,人类围着床期子宫内膜Mφ的研究难以深入开展。小鼠的胚胎着床类型与人类一致,均属于表面着床模式,因此,我们利用妊娠小鼠和假孕小鼠模型,观察子宫组织中Mφ的变化特点以及Mφ在着床部位和非着床部位的分布差异,探讨其在围着床期胚胎植入中的作用。
1 材料与方法 1.1 材料 1.1.1 试剂大鼠抗小鼠F4/80抗体,PE标记的兔抗大鼠IgG(美国Santa Cruz公司);兔抗小鼠iNOS抗体,羊抗兔IgG(武汉博士德生物有限公司);人抗小鼠LIF抗体,兔抗人IgG;SABC试剂盒,DAB显色剂,内源性过氧化物酶抑制剂,PBS,枸橼酸盐缓冲液,4%多聚甲醛。
1.1.2 实验动物取性发育成熟的昆明小鼠,由南方医科大学动物实验中心提供,自由饮水取食。雌鼠:6~8周龄,体质量28±2 g;雄鼠:2~3月龄性成熟。
1.1.3 主要仪器石蜡切片机、石蜡包埋机、生物组织烤片机、恒温箱、光学显微镜、镊子、剪刀、解剖盘等解剖用具。
1.2 方法 1.2.1 假孕小鼠模型的建立昆明雄鼠全麻状态下,开腹结扎双侧输精管,常规缝合,恢复后与动情期雌鼠以1:1比例合笼,次日清晨发现阴道栓者记为D0.5,以此类推,选取D1.5~D6.5小鼠作为对照组(n=30)。
1.2.2 妊娠小鼠模型的建立昆明小鼠于动情期以雌雄比例1:1合笼,次日发现阴道栓者,记为D0.5,选取D1.5~D6.5小鼠作为实验组(n=30)。于午间12~14点分别取两组小鼠,颈椎脱臼处死,开腹取“Y”型子宫,固定于4%多聚甲醛液,常规石蜡包埋切片。
1.2.3 免疫组织化学法(SABC法)石蜡标本连续切片,厚度4 μm,每例标本连续10张切片后取1张,每例标本取5张切片,之后进行SABC法染色(依据说明书操作),每张切片随机取10个视野,在10×20倍镜下计数阳性细胞,阳性细胞呈棕黄色或棕褐色颗粒。
1.3 统计学处理应用SPSS13.0软件统计数据,计数结果用均数±标准差表示,组间比较采用两样本t检验,两者相关性采用两变量相关性分析,设双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 妊娠组与假孕组小鼠子宫解剖形态和组织结构比较解剖形态学观察可见:假孕组小鼠子宫细小,颜色苍白或呈淡粉色,随妊娠天数(D1.5~D6.5)增加,小鼠子宫未见明显变化;妊娠组小鼠子宫随妊娠天数增加,逐渐充血增粗,表面水肿呈水样光泽,D4.5开始出现肉眼可见的充血、红色串珠样的局部隆起(图 1)。
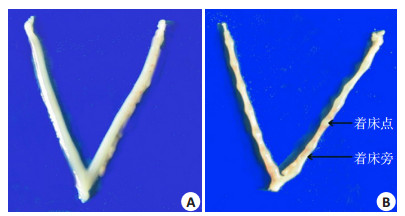
|
图 1 两组的小鼠子宫-解剖学形态 Figure 1 Anatomic morphology of the uterus in the two groups. A: Control group (D4.5); B: Experimental group (D4.5). |
组织学HE染色显示:假孕组子宫内膜可见明显的腺体和基底细胞,D1.5~D6.5未见明显变化。实验组小鼠子宫内膜呈分泌期改变,D1.5~D3.5子宫内膜上皮细胞明显水肿,基质疏松,间质细胞少见蜕膜化;D4.5开始子宫内膜进一步增厚,间质细胞明显蜕膜化,着床部位可见胚胎结构,血管显著增生;非着床部位血管增生较少,腺体相对密集(图 2)。
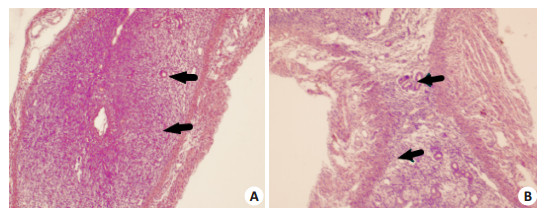
|
图 2 小鼠子宫组织着床点与非着床点HE染色 Figure 2 Histological changes of the uterus in early pregnancy (HE staining, original magnification: ×200). A: Implantation sites; B: Non-implantation sites. Arrows point to blood vessel. |
SABC法DAB显色后可见F4/80-Mφ可分布于子宫各层(图 3),其中妊娠组子宫内膜Mφ数目在D1.5、D4.5和D6.5低于假孕组,D2.5高于假孕组,差异均有统计学意义(表 1)。同时观察到妊娠组子宫肌膜的Mφ数目D4.5和D6.5低于假孕组,D2.5高于假孕组,差异均有统计学意义(表 2);妊娠组子宫外膜的Mφ数目D2.5、D4.5、D5.5和D6.5均明显高于假孕组,差异有统计学意义(表 3)。此外,F4/80-Mφ在子宫的分布随着时间发生明显改变,D4.5前主要分布于子宫内膜,D4.5后逐渐迁移至子宫外膜。
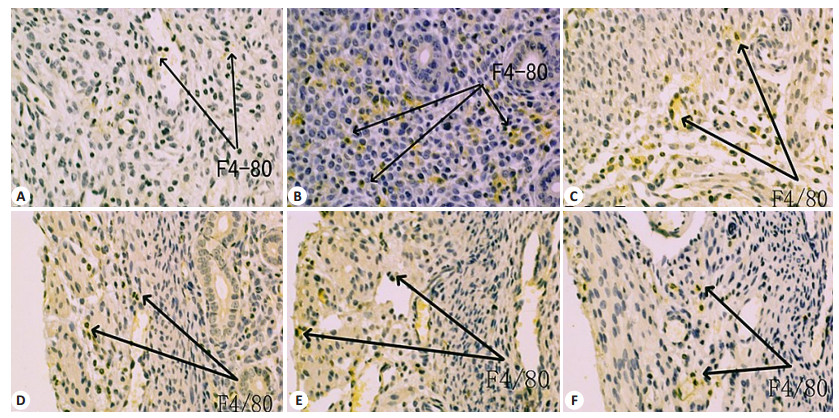
|
图 3 妊娠组小鼠子宫F4/80-Mφ随妊娠时间的变化 Figure 3 Change of macrophages in the mouse uterine during early pregnancy (SABC staining, original magnification: ×200). A: D1.5; B: D2.5; C: D3.5; D: D4.5; E: D5.5; F: D6.5. Arrows point to macrophages. |
| 表 1 子宫内膜F4/80-Mφ和iNOS的分布 Table 1 Comparison of the number of F4/80 and iNOS staining in mouse endometrium during early pregnancy (Mean±SD) |
| 表 2 子宫肌膜F4/80-Mφ和iNOS的分布 Table 2 Comparison of the number of F4/80 and iNOS distribution in mouse myometrium during early pregnancy (Mean±SD) |
| 表 3 子宫外膜F4/80-Mφ和iNOS的分布 Table 3 Comparison of the number of F4/80 and iNOS distribution in mouse perimetrium during early pregnancy (Mean±SD) |
诱导型一氧化氮合成酶(iNOS)阳性细胞分布于子宫各层,妊娠组子宫内膜iNOS在D1.5明显低于假孕组,D2.5、D3.5和D4.5高于假孕组,差异有统计学意义(表 1)。子宫肌膜中iNOS比较,妊娠组D1.5显著低于假孕组,D4.5、D5.5、D6.5高于假孕组,无显著性差异(表 2)。子宫外膜iNOS比较,妊娠组D1.5低于假孕组,D3.5-D6.5均高于假孕组,差异均有统计学意义(表 3)。此外,子宫中iNOS数量于D4.5后明显下降。
F4/80-Mφ与iNOS进行两变量相关性分析:围着床期F4/80-Mφ与iNOS之间存在正相关关系,r=0.565,P=0.000。
2.3 着床部位与非着床部位Mφ的分布既往研究认为小鼠同笼后D4.5是着床起始的时间,故我们将滋养细胞粘附于内膜上皮(D4.5)为界,分为两个阶段,即着床前阶段(D1.5~4.5)与着床后(D4.5~6.5)阶段。D4.5~6.5期间,观察发现小鼠子宫F4/ 80-Mφ、白血病抑制因子(LIF)在着床部位的数目显著高于非着床部位,差异均有统计学意义(P < 0.05);iNOS在着床部位的数量高于非着床部位,但差异无统计学意义(P>0.05,表 4)。且对F4/80-Mφ与LIF进行两变量相关性分析,二者之间存在相关性(r=0.256,P=0.027)。
| 表 4 子宫内膜中F4/80-Mφ、iNOS和LIF在着床点和非着床点之间的比较 Table 4 Comparison of the number of F4/80 staining cells, iNOS staining cells and LIF staining cells between implantation sites and non-implantation sites (Mean±SD) |
近年来,Mφ作为体内一种重要的非特异性免疫细胞,在胚胎植入中的作用引起越来越多学者的兴趣。F4/80是小鼠成熟巨噬细胞表达的特异性抗原,其定位于细胞膜[3-4]。激活的Mφ释放细胞因子如NO及血管内皮生长因子(VEGF),可调节子宫内膜的周期性变化与胚胎着床、妊娠过程。NO是一种重要的信使分子和生物活性物质,半衰期较短,是目前已知双向调节血管新生与发育最主要的细胞因子,而Mφ是体内NO合成、储存与释放的重要来源[5]。内源性NO的生成是由左旋精氨酸和分子氧在NOS催化下转化为L-羟基-精氨酸,再经过进一步氧化生成稳定的NO和NO终产物[6]。iNOS即巨噬细胞NOS,是在免疫或炎症刺激激活的巨噬细胞中被诱导合成的。而着床被认为是一种类炎症反应[7]。
本研究发现,妊娠组小鼠的子宫解剖形态与组织学均在D4.5发生明显改变,提示D4.5是小鼠胚胎着床起始时间,也是局部血管生成高峰期,这种微环境是胚胎着床、胎盘形成和妊娠维持的先决条件[8]。为了观察Mφ在子宫中的变化,选择D1.5~D6.5小鼠为研究对象,结果显示:妊娠组D2.5~D3.5为Mφ表达高峰,主要分布在子宫内膜;D4.5~D6.5Mφ数量减少,主要分布于子宫外膜层,此结果与De等[9]的研究结果一致,提示子宫F4/ 80巨噬细胞在着床阶段迁移至子宫外膜层,远离着床部位,利于减少对胚胎的免疫排斥作用[10]。
胚胎着床过程与子宫内膜的蜕膜化和血管的新生密切相关,研究发现NO不但可以促进子宫内膜蜕膜化、血管新生,而且通过增加血管的通透性促进血液循环和营养物质之间的交换,影响胚胎的发育[11]。本研究中发现妊娠组iNOS表达量高于假孕组,主要集中在子宫内膜层;且F4/80-Mφ与iNOS之间存在正相关关系,提示iNOS可能在促进胚胎着床过程中发挥重要作用,并且Mφ可能通过NOS作为下游信号分子,调控着床过程。Tan等[8]关于围着床期小鼠子宫巨噬细胞与内膜血管生成关系的初步探讨中,进一步证实了此推测。
许多研究证实多种免疫细胞因子均参与胚胎着床过程,LIF作为胚胎着床点的分子标记物,是已被证实的介导胚泡着床的最关键细胞因子之一[12]。那么Mφ在胚胎着床过程中,与LIF之间是否存在联系,对着床部位的选择是否发挥作用?我们首先观察LIF在子宫的表达情况,结果显示假孕组LIF微弱表达,几乎不表达;妊娠组LIF高表达,在子宫内膜胚胎着床部位密集分布。当对着床部位和非着床部位Mφ、iNOS和LIF的表达进行比较,发现三者在着床部位的分布和表达均高于非着床部位,且Mφ和LIF的表达趋势一致,二者间存在相关性。因此,推测Mφ不仅仅是减少免疫排斥、促进胚胎着床,还参与着床部位的选择过程,但是具体机制还需进一步研究。
综上所述,着床前后,子宫Mφ在时间和空间上均发生显著变化,提示Mφ在胚胎着床中发挥重要作用,通过降低母胎免疫耐受、促进NO生成及血管新生,直接或间接参与着床过程和着床位点的选择,但是相关机制还需要进一步研究。
| [1] | Bazer FW, Spencer TE, Johnson GA, et al. Uterine receptivity to implantation of blastocysts in mammals[J]. Front Biosci,2011, 3 : 745-67. |
| [2] | Jones RL, Hannan NJ, Kaitu TJ, et al. Identificaation of chemokines important for leukocyte recruitment to the human endometrium at the times of embryo implantation and menstrucation[J]. J Clin Endocrinol Metab,2004, 89 (12) : 6155-67. DOI: 10.1210/jc.2004-0507. |
| [3] | Lin HH, Stacey M, Stein-Streilein J, et al. F4/80: the macrophage-specific adhesion-GPCR and its role in immunoregulation[J]. Adv Exp Med Biol,2010, 706 : 149-56. DOI: 10.1007/978-1-4419-7913-1. |
| [4] | Fukuda S, Nagano M, Yamashita T, et al. Functional endothelial progenitor cells selectively recruit neurovascular protective monocyte-derived F4/80(+) /Ly6c (+) macrophages in a mouse model of retinal degeneration[J]. Stem Cells,2013, 31 (10) : 2149-61. DOI: 10.1002/stem.1469. |
| [6] | Leppänen T, Tuominen RK, Moilanen E. Protein kinase C and its inhibitors in the regulation of inflammation: inducible nitric oxide synthase as an example[J]. Basic Clin Pharmacol Toxicol,2014, 114 (1) : 37-43. DOI: 10.1111/bcpt.2013.114.issue-1. |
| [6] | Robinson MA, Baumgardner JE, Otto CM. Oxygen-dependent regulation of nitric oxide production by inducible nitric oxide synthase[J]. Free Radic Biol Med,2011, 51 (11) : 1952-65. DOI: 10.1016/j.freeradbiomed.2011.08.034. |
| [7] | Granot I, Gnainsky Y, Dekel N. Endometrial inflammation and effect on implantation improvement and pregnancy outcome[J]. Reproduction,2012, 144 (6) : 661-8. DOI: 10.1530/REP-12-0217. |
| [8] | Tan W, Chen L, Guo L, et al. Relationship between macrophages in mouse uteri and angiogenesis in endometrium during the peri-implantation period[J]. Theriogenology,2014, 82 (7) : 1021-7. DOI: 10.1016/j.theriogenology.2014.07.025. |
| [9] | De M, Wood G. Analysis of the number and distribution of macrophages, lymphocytes, and granulocytes in the mouse uterus from implantation therough parturition[J]. Leukocyte Biol,1991, 50 (4) : 381-92. |
| [10] | Erlebacher A. Immunology of the maternal-fetal interface[J]. Annu Rev Immunol,2013, 31 : 387-411. DOI: 10.1146/annurev-immunol-032712-100003. |
| [11] | Toda N, Toda H, Okamura T. Regulation of myometrial circulation and uterine vascular tone by constitutive nitric oxide[J]. Eur J Pharmacol,2013, 714 (1-3) : 414-23. DOI: 10.1016/j.ejphar.2013.07.006. |
| [12] | Liang XH, Deng WB, Li M, et al. Egr1 protein acts downstream of estrogen-leukemia inhibitory factor (LIF)-STAT3 pathway and plays a role during implantation through targeting Wnt4[J]. J Biol Chem,2014, 289 (34) : 23534-45. DOI: 10.1074/jbc.M114.588897. |
 2016, Vol. 35
2016, Vol. 35
