胃癌预后差的主要原因在于胃癌转移迅速,许多患者在初次就诊时就已存在局部或远处转移,导致手术、化疗等措施无法达到根治。因此寻找胃癌转移相关蛋白质有重要意义。当前蛋白质组学研究已成为研究肿瘤转移的新技术,并已取得一些重要成果[1-2]。我们前期发现锌指蛋白139(zinc finger protein 139, ZNF139)在胃癌中过表达,与胃癌多药耐药(multidrug resistance, MDR)关系密切[3-4],且有促进胃癌侵袭转移的作用[5-6],但ZNF139在体内能通过调控哪些蛋白质促进淋巴结转移相关报道很少。故本研究应用蛋白质组学技术对ZNF139调控的胃癌转移相关蛋白质的进行了鉴定,并对这些蛋白质的功能进行了初步分析。
1 材料与方法 1.1 实验材料及试剂人胃癌细胞株SGC7901(本院科研中心保种并传代);4周龄BALB/c雄性裸鼠(北京华阜康公司)53只,3~4周龄,体质量20~23 g,其中8只用于皮下移植瘤并传代,45只用于原位移植;RPMI-1640(美国Solarbio公司);3-[(3-胆酰胺丙基)-二乙胺](CHAPS)(美国Aresco);Trizol Reagent、尿素(Urea)、硫脲(Thiourea)、十二烷基硫酸钠(SDS)、甲叉丙烯酰胺(Bis-acrylamide)、丙烯酰胺(Acrylamide)、四甲基二乙胺(TEMED)、过硫酸氨(AP)均购自美国Sigma;二硫苏糖醇(DTT)(北京华美生物公司);CyDye荧光染料(Cy3、Cy5)(美国GE Healthcare);两性电解质(IPG buffer)(美国GE Healthcare)。兔抗人单克隆抗体Fascin、兔抗人多克隆抗体ZNFl39、hnRNPA2/B1、ANXA1、内参照β-actin购自英国Abcam;兔抗人多克隆抗体ANXA5(美国Abgent)。
1.2 实验仪器ABI Prism 7900型荧光定量PCR仪(美国应用生物系统公司);U-2001型紫外可见分光光度计(日本日立公司);DYY-6C型电泳仪(北京六一仪器厂);Ettan IPGphor等电聚焦仪(美国GE Healthcare);DYCZ-28A型垂直电泳槽(北京六一仪器厂);Typhoon TRIO Variable Mode Imager(瑞典Amersham Bioscience);Ettan spot picker(美国GE Healthcare);Flexi-Dry冷冻干燥机(美国FTS Systems);液质联用仪LTQXL型(美国Thermo)。
1.3 实验方法 1.3.1 细胞培养胃癌SGC7901细胞复苏后常规培养,于含10%小牛血清的RPMI 1640培养液中培养于5% CO2恒温孵育箱中37 ℃下培养传代。
1.3.2 靶向ZNF139-siRNA干扰质粒构建及扩增纯化应用上海吉玛制药技术有限公司合成ZNF139-siRNA干扰质粒工程菌(图 1)进行转染实验。菌液接种于含有100 μg/ml氨苄青霉素的LB液体培养基中,使用Tiangen公司质粒中提试剂盒Endofree Maxi Plasmid Kit提取质粒。
|
图 1 ZNF139-siRNA干扰质粒构建 Figure 1 Construction of ZNF139-siRNA plasmid. |
ZNF139-siRNA模板序列:5-ACCTCGGAA GATTCAGCAT-3;5-ATGCTGAATCTTCCGAGGT-3。ZNF139-siRNA无关对照模板序列:5-GACGAGTTGAC TGCGATTG-3;5-CAATCGCAGTCAACTCGTC-3。
1.3.3 ZNF139-siRNA质粒转染经定量分析后,分别取2.4、3.6、4.8、6.0 μg重组质粒,用无血清培养基稀释质粒至1 μg/100 μl,加入转染试剂后转染细胞,培养24 h后收集细胞,进行下一步实验。
1.3.4 荧光定量RT-PCR检测反应条件:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,40个循环。以β-actin为内参照,计算目的基因mRNA相对表达量。反应体系见表 1。
| 表 1 荧光定量RT-PCR反应体系 Table 1 Reaction system of fluorescence quantitative RT-PCR |
分别取4.8 μg阳性质粒、阴性质粒转染对数期生长的SGC7901细胞24 h,加入G418(400 μg/ml)筛选,待细胞密度达到80%时用400 μg/ml G418的培养基再筛选1次。直至得到稳定转染细胞株。
1.3.6 胃癌原位移植裸鼠模型的建立45只裸鼠分为ZNF139-siRNA组、阴性质粒组、空白组,每组15只。先建立裸鼠皮下移植瘤模型,鼠间传代5次,以第6代皮下移植瘤为原位移植的瘤源进行胃癌原位移植。具体造模方法依照本课题组前期研究方法进行[7]。原位移植瘤形成后,每4 d测量一次瘤体长短径,待腹部膨隆,肿瘤长至1.0 cm×1.0 cm左右,出现活动减少,进食减少,体质量下降时,颈椎脱臼处死,取出原位移植瘤,腹腔转移淋巴结至少需要采集5枚以上,标本分为3份,1份福尔马林固定送病理检查,两份迅速放入液氮中保存。
1.3.7 蛋白质组学实验 1.3.7.1 蛋白样品制备各组织使用超声破碎仪及细胞裂解液进行破碎及裂解,离心取上清并用Tris饱和酚抽提蛋白质,之后用DIGE buffer溶解蛋白质,最后用Bradford法测定蛋白质浓度,-80 ℃保存备用。
1.3.7.2 双向差异凝胶电泳及图像分析取各组蛋白CyDye荧光染料标记各组样品2 h。先后进行一向和二向凝胶电泳,扫描和分析相应图像。在对进行蛋白质点的检测、编辑和匹配、蛋白质点的相对分子质量和等电点校正后,通过DIA和BVA分析选择可重复的点,生成差异蛋白质列表,将差异蛋白质列表导入Ettan spot picker软件分析,并根据结果在凝胶进行挖点。
1.3.7.3 蛋白质胶内酶解用NH4HCO3和ACN清洗胶粒后冻干,加入含有Trypsin(10 ng/μl)的50 mmol/L NH4HCO3(pH 8.0)孵育12 h,吸取上清液并冻干,最后加入15 μl含有0.1% FA的去离子水制备成待测样品。
1.3.7.4 质谱分析与数据鉴定应用LTQ XL增强型离子阱型质谱仪,通过nanoESI-LC-MS/MS的分析方法鉴定差异表达的蛋白质。二级质谱图谱经BioWorks 3.3.1软件(Thermo Fisher公司)SEQUEST运算方法进行数据库检索。
1.4 Western blot对差异蛋白进行验证各组蛋白经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转移至PVDF膜。经5%脱脂奶粉室温封闭90 min,分别加入一抗(1:400),4 ℃孵育过夜。次日,加入二抗,孵育90 min,化学发光法显色。以β-actin为内参照。利用BioRad图像分析系统测定蛋白条带的积分吸光度(L4),以目的蛋白与内参照蛋白L4值的比值表示目的蛋白的相对表达水平。实验重复3次。
1.5 统计学处理采用SPSS13.0统计软件对实验结果进行分析,计量资料以均数±标准差表示并应用t检验,以P < 0.05存在差异有统计学意义。
2 结果 2.1 siRNA对ZNF139的抑制情况实时定量PCR显示,随质粒浓度增高,转染的SGC7901细胞中ZNF139 mRNA相对表达量逐渐降低(P < 0.05),其中以0.8 μg/μl组抑制效率最高,为82.92%(图 2)。
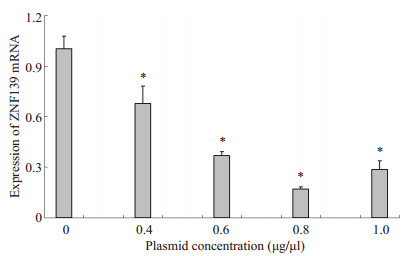
|
图 2 siRNA对ZNF139抑制的荧光定量RT-PCR结果 Figure 2 Effect of siRNA on ZNF139 expression assessed by fluorescence quantitative RT-PCR. *P < 0.05 vs 0 μg/μl group. |
原位移植瘤自可触及开始每4 d测量其最长径与最短径,按V=ab2/2(a为长径,b为短径,单位mm)计算移植瘤体积。空白组比阴性质粒组肿瘤无统计学差异(P>0.05);与阴性对照组比较,实验组原位移植瘤生长明显减慢(P < 0.01,图 3)。
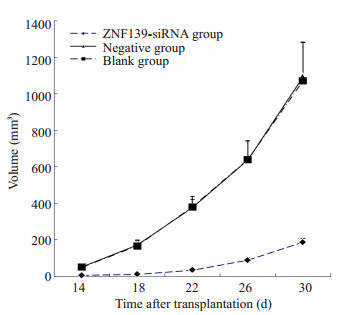
|
图 3 原位移植裸鼠肿瘤体积生长曲线 Figure 3 Tumor volume growth curve of the mice bearing orthotopic transplanted tumor. |
裸鼠原位成瘤率100%。空白组及阴性质粒组均发现腹腔淋巴结,HE染色证实淋巴结中有癌细胞,淋巴结转移率100%;ZNF139-siRNA组9只裸鼠发现腹腔淋巴结HE染色证实有癌细胞,淋巴结转移率为60%,明显低于空白组及阴性组(χ2=12.857, P < 0.001)。
2.4 蛋白质组学结果ZNF139-siRNA组与阴性质粒组的2D-DIGE中,原位移植瘤平均为7658±47个蛋白质点,匹配率为91.6%;转移淋巴结蛋白质点平均为3117±82,匹配率为92.5%。应用DeCyder Differential Analysis Software选取原位移植瘤6个差异蛋白点,LC-MS鉴定出5种蛋白质,经生物信息学分析确定3种可能与肿瘤有关的蛋白质,其中Fascin、hnRNPA2/B1在ZNF139-siRNA组表达下调,ANXA1表达上调。转移淋巴结选取3个差异蛋白点,经LC-MS鉴定出3种蛋白质,经分析确定1种可能与胃癌有关的蛋白质ANXA5,在ZNF139-siRNA组的淋巴结中表达下调(图 4)。
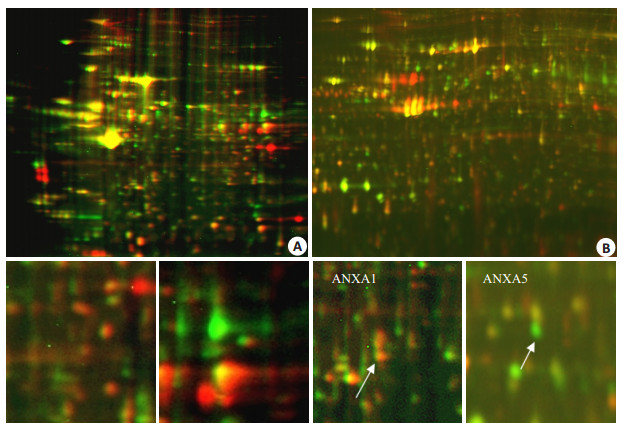
|
图 4 ZNF139-siRNA组与阴性质粒组原位移植肿瘤原发灶和转移淋巴结的2D-DIGE结果 Figure 4 Results of 2D-DIGE of the primary tumors (A) and metastatic lymph nodes (B) in ZNF139-siRNA group and negative plasmid group. A: 2D-DIGE figure of ptimary tumors; B: 2D-DIGE figure of metastatic lymph nodes. |
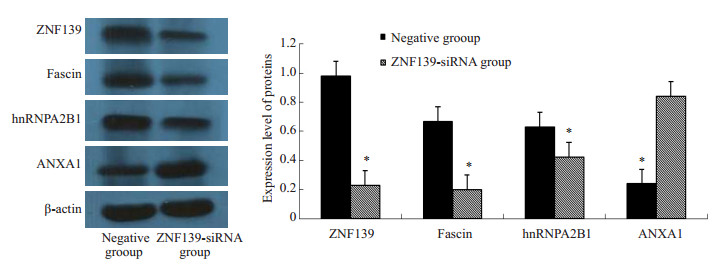
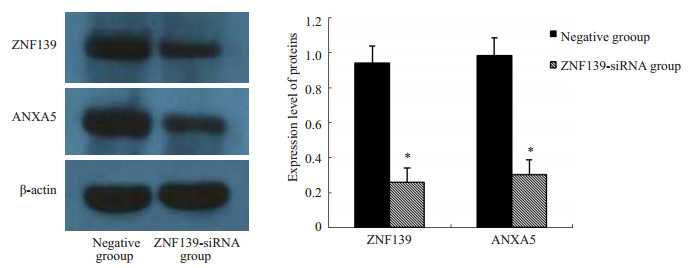
Western blot表明,Fascin、hnRNPA2/B1在ZNF139-siRNA组表达下调、ANXA1表达上调(P < 0.01)。ANXA5,在ZNF139-siRNA组的淋巴结中表达下调。结果与蛋白质组学结果一致(图 5、6)。
|
图 5 ZNF139-siRNA组与阴性质粒组原位移植肿瘤原发灶差异蛋白质的Western blot验证结果 Figure 5 Western blotting for verification of the differential proteins in primary tumors in ZNF139-siRNA group and negative plasmid group. *P < 0.05 vs negative control group. |
|
图 6 ZNF139-siRNA组与阴性质粒组原位移植肿瘤淋巴结转移灶的Western blot验证结果 Figure 6 Western blotting for verification of the differential proteins in metastatic lymph nodes in ZNF139-siRNA group and negative plasmid group. *P < 0.05 vs negative control group. |
本课题组前期研究发现胃癌细胞中锌指蛋白139(zinc finger protein 139, ZNF139)存在过表达[8],进一步体外实验发现ZNF139可导致胃癌细胞多药耐药(multidrug resistance, MDR)[3-4],还发现ZNF139具有促进胃癌细胞株侵袭迁移能力的作用[5]。但ZNF139在体内能否促进胃癌细胞侵袭迁移还不明确,故本研究进行了相关体内实验。
我们的前期成功制备了原位移植裸鼠的胃癌转移模型[7],本研究以不同处理的胃癌细胞株SGC7901进行原位移植后,结果发现转染了ZNF139-siRNA阳性质粒的胃癌细胞成瘤小、生长慢,且淋巴结转移率低,说明ZNF139具有促进胃癌细胞生长、转移的功能,以ZNF139为靶标采取针对性措施可能抑制胃癌转移。
为了解ZNF139在胃癌转移中直接调节的蛋白质,本研究进一步应用蛋白质组学技术对ZNF139转染前后的差异蛋白质进行了筛选鉴定,结果确定原发灶ZNF139调控的差异蛋白质为Fascin、ANXA1、hnRN-PA2/B1,转移淋巴结中差异蛋白质为ANXA5。研究发现STAT3-NF-κB-Fascin通路在胃癌细胞的侵袭迁移中发挥重要作用[9]。本研究发现经siRNA抑制ZNF139后Fascin蛋白下降,提示ZNF139可能通过促进Fascin表达促进胃癌转移。hnRNPs与肿瘤关系密切,在胃癌,肺癌,胰腺癌等肿瘤内高表达[10],本研究发现抑制ZNF139后hnRNPA2/B1蛋白质表达下调,提示ZNF139可能通过促进hnRNPA2/B1的表达促进胃癌转移。有报道ANXA1在胃癌转移过程中表达下降,为胃癌转移进展的负性标志物[11]。本研究抑制ZNF139后ANXA1蛋白质表达上调,提示胃癌细胞中的ZNF139可能通过抑制ANXA1而促进胃癌转移。研究发现ANXA5在胃癌中表达增高,与胃癌耐药有关[12]。本实验抑制ZNF139后转移淋巴结中ANXA5蛋白质表达下调,提示ZNF139可能通过上调ANXA5的表达促进胃癌淋巴结的转移。
| [1] | Liu Y, Li Y, Tan BB, et al. Technique appraisement of comparative proteomics and screening of differentiation-related protein in gastric carcinoma[J]. Hepatogastroenterology,2013, 60 (123) : 633-7. |
| [2] | Zhang ZQ, Li XJ, Liu GT, et al. Identification of annexin a1 protein expression in human gastric adenocarcinoma using proteomics and tissue microarray[J]. World J Gastroenterol,2013, 19 (43) : 7795-803. DOI: 10.3748/wjg.v19.i43.7795. |
| [3] | Li Y, Tan BB, Zhao Q, et al. Regulatory mechanism of ZNF139 in multi-drug resistance of gastric cancer cells[J]. Mol Biol Rep,2014, 41 (6) : 3603-10. DOI: 10.1007/s11033-014-3224-4. |
| [4] | 李勇, 赵群, 檀碧波, 等. 人胃癌耐药细胞株中锌指蛋白139和多药耐药基因表达的关系及意义[J]. 中国癌症杂志,2013, 23 (7) : 493-8. |
| [5] | Li Y, Tan BB, Zhao Q, et al. ZNF139 promotes tumor metastasis by increasing migration and invasion in human gastric cancer cells[J]. Neoplasma,2014, 61 (3) : 291-8. DOI: 10.4149/neo_2014_037. |
| [6] | 范立侨, 李勇, 赵群, 等. 人胃癌细胞原位移植裸鼠原发灶与肝转移灶体外化疗药敏性差异[J]. 中国普通外科杂志,2013, 22 (10) : 1280-4. |
| [7] | 赵群, 李勇, 范立侨, 等. 人胃癌细胞原位移植转移裸鼠原发灶及转移灶中锌指蛋白139的表达及其与肿瘤侵袭转移的关系研究[J]. 中国全科医学,2013, 16 (19) : 1740-3. |
| [8] | 李勇, 赵群, 檀碧波, 等. 人胃癌耐药细胞株中锌指蛋白139和MMP-2, MMP-7, 细胞间黏附因子1的表达及其意义[J]. 中华普通外科杂志,2013, 28 (6) : 468-9. |
| [9] | Yao J, Qian CJ, Ye B, et al. Signal transducer and activator of transcription 3 signaling upregulates fascin via nuclear factor-.B in gastric cancer: Implications in cell invasion and migration[J]. Oncol Lett,2014, 7 (3) : 902-8. |
| [10] | Romero-Garcia S, Prado-Garcia H, Sullivan Lopez-Gonzalez J. Transcriptional analysis of hnRNPA0, A1, A2, B1, and A3 in lung cancer cell lines in response to acidosis, hypoxia, and serum deprivation conditions[J]. Exp Lung Res,2014, 40 (1) : 12-21. DOI: 10.3109/01902148.2013.856049. |
| [11] | Yu G, Wang J, Chen Y, et al. Tissue microarray analysis reveals strong clinical evidence for a close association between loss of annexin A1 expression and nodal metastasis in gastric cancer[J]. Clin Exp Metastasis,2008, 25 (7) : 695-702. DOI: 10.1007/s10585-008-9178-y. |
| [12] | Chiang JH, Yang JS, Ma CY, et al. Danthron, an anthraquinone derivative, induces DNA damage and caspase Cascades-Mediated apoptosis in SNU-1 human gastric cancer cells through mitochondrial permeability transition pores and Bax-Triggered pathways[J]. Chem Res Toxicol,2011, 24 (1) : 20-9. DOI: 10.1021/tx100248s. |
 2016, Vol. 35
2016, Vol. 35