乳腺癌是女性最常见的恶性肿瘤之一,严重危害着女性的健康,其中三阴性乳腺癌(triple negative breast cancer, TNBC)具有发病年龄轻、易复发、易转移、预后差等病理及临床特征而引起了越来越多的关注。三阴性乳腺癌系指雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体(Her-2)表达均为阴性的乳腺癌[1]。热休克蛋白90 (heat shock protein 90, Hsp90)作为分子伴侣蛋白调节众多信号蛋白的构象成熟和稳定性,在细胞生长、分化、凋亡以及肿瘤的发展中发挥着重要作用,逐渐成为了目前抗肿瘤药物研究中重要的靶点之一[2-3]。槚如酸具有水杨酸母核结构,广泛存在于漆树科植物,特别是槚如树(Anacardium occidentale)的果实和银杏(Ginkgo biloba)的叶中,具有抗肿瘤、抗菌、基因表达调节、杀虫等广泛的生物活性[4]。研究表明,槚如酸虽然对多种肿瘤细胞具有良好的体外、体内的抗肿瘤作用,但其抗肿瘤作用机制的报道较少[5-7]。本研究以不同浓度的槚如酸作用于三阴性乳腺癌MDA-MB-231细胞,探讨槚如酸对Hsp90活性,肿瘤细胞的增殖、侵袭、迁移的影响,为今后的持续研究提供实验理论依据。
1 材料和方法 1.1 材料 1.1.1 Hsp90重组蛋白克隆酵母Hsp90全基因,在pET-28a高效表达质粒中IPTG (Isopropyl-β-Dthiogalacto-pyranoside)诱导表达,得到Hsp90-tis融合蛋白。再经6x Histidine sepharose CL-6B亲和层析柱进行纯化,可得到纯度90%以上的Hsp90-his融合蛋白[8]。
1.1.2 细胞株及细胞培养人乳腺癌MDA-MB-231细胞株,购于中科院上海细胞库。MDA-MB-231细胞复苏后,于DMEM培养液(含10%胎牛血清,3.7 g/L碳酸氢钠,1×105 IU/L青霉素,100 mg/L链霉素),置37 ℃、饱和湿度、5% CO2培养箱中培养,0.25%胰酶消化后传代培养。
1.1.3 主要试剂DMEM培养液、胰蛋白酶:Gibco公司;胎牛血清:浙江四季青公司;二甲基亚砜(DMSO):Sigma公司;Transwell小室:Corning公司;Matrigel基质蛋白:BD公司;兔抗人MMP-9,兔抗人TIMP-1:武汉博士德生物工程公司;鼠抗人β-actin、鼠抗人Hsp70:Santacruz公司;山羊抗人Hsp90α:Stressgen公司;Anacardic acid:Santacruz公司(sc-202463)。
1.2 方法 1.2.1 体外检测Hsp90 ATPase活性实验Hsp90的ATPase活性检测采用malachite green-molybdat显色反应。将高纯度的Hsp90-his融合蛋白2 μmol/L置于96孔板中,每个孔加入不同浓度的槚如酸和反应缓冲液(100 mmol/L Tris-HCl,20 mmol/L KCl,6 mmol/L MgCl2,pH 7.4)混匀后置37 ℃反应2.5 h,每个药物浓度设三个复孔。反应结束后加入80 μl malachite greenmolybdate溶液显色,并在波长620 nm测每个孔的吸光度(A)值,并计算出槚如酸对Hsp90的ATPase抑制活性。以上实验重复3次[8]。
1.2.2 ATP-琼脂糖凝胶与Hsp90α结合能力实验向含有Hsp90α蛋白1 μg的反应缓冲液100 μl中各加入不同浓度的槚如酸(0,20,200,2000 nmol/L),并置于冰中反应。反应30 min后,各反应液加入C10-偶联氨基苯ATP-琼脂糖凝胶50 μl,混匀后置4 ℃继续反应3 h。孵育后,对ATP-琼脂糖凝胶株进行依次洗脱,各洗脱液再经免疫印迹法分析不同浓度药物处理组的Hsp90抗体表达[8]。
1.2.3 MTT法取对数生长期的乳腺癌MDA-MB-231细胞,用0.25%胰蛋白酶消化制成单细胞悬液,接种于96孔板中,每孔100 μl培养液中含有5000个细胞,于5% CO2饱和湿度37 ℃培养箱中培养。培养24 h后,按不同浓度处理槚如酸,同时设阳性对照组和空白对照组,每个处理3个复孔,继续培养48 h后每孔加入10 μl浓度为5 g/l的MTT溶液继续孵育4 h,弃去培养液,每孔加入DMSO 150 μl,37 ℃孵育30 min,微量振荡器振荡10 min使结晶物充分溶解,用酶标仪在570 nm波长下检测每孔的吸光度(A)值,计算细胞存活率:细胞存活率/%=实验组A570 nm/对照组A570 nm×100%,绘制剂量效应曲线,采用Logit法计算半数抑制浓度(IC50)。以上实验重复3次。
1.2.4 Transwell体外迁移实验取对数生长期MDAMB-231细胞,消化离心,用不同浓度槚如酸的无血清培养基稀释细胞至5×105/ml,每个Transwell小室中加入100 μl,下室每孔加入含5%胎牛血清的DMEM高糖培养基600 μl,培养24 h后取出小室,用棉签擦去小室上层未迁移的细胞,4%多聚甲醛室温固定15 min,0.1%结晶紫染色15 min,各取5个400×视野显微镜下观察拍照。迁移抑制率/%=(1-实验组迁移细胞数/对照组迁移细胞数) ×100%。
1.2.5 Transwell体外侵袭实验每个Transwell小室的聚碳酸酯微孔膜铺50 μl Matrigel基质蛋白,用不同浓度槚如酸处理36 h,其余操作同细胞迁移实验。侵袭抑制率/%=(1-实验组侵袭细胞数/对照组侵袭细胞数) ×100%。
1.2.6 免疫印迹法调细胞浓度为2×105/ml接种于6孔板,2 ml/孔,24 h后开始给药。冰PBS清洗后,滤纸吸干液体后加入细胞裂解液,200 μl /孔,置冰上30 min,细胞刮下,转移至EP管内80 ℃冻存,经3次反复冻融后BCA法定量,调蛋白浓度后加上样缓冲液煮沸10 min。SDS-PAGE后转移至PVDF膜,封闭过夜后,置相关蛋白的一抗、二抗,显色分析。
1.2.7 统计学处理实验数据以均数±标准差表示,采用SPSS13.0软件对数据进行单因素方差分析,各组间比较用双侧Dunnett t检验。当P < 0.05时,差异有统计学意义。
2 结果 2.1 槚如酸体外对Hsp90 ATPase活性的影响本研究通过筛选Hsp90 ATPase活性的体外酶反应方法,发现水杨酸类化合物槚如酸具有特异性地抑制酵母Hsp90重组蛋白的ATPase活性作用。槚如酸抑制Hsp90 ATPase活性的IC50值为82.5 μmol/L,而最典型的Hsp90抑制剂格尔德霉素(GA)的IC50值为3.1 μmol/L (表 1)。另外,ATP-琼脂糖凝胶与Hsp90α结合能力实验验证了槚如酸是通过和ATP竞争性地,与Hsp90蛋白的N-末端ATP结合域结合,而显示出抑制Hsp90 ATPase活性。图 1显示,槚如酸阻碍Hsp90α蛋白与ATP-琼脂糖凝胶株结合,其结合抑制能力呈现出浓度依赖性,并且不同浓度槚如酸与DMSO给药组比较具有显著的抑制效果。

|
图 1 槚如酸的竞争性地结合能力 Figure 1 Competitive binding assay for anacardic acid |
| 表 1 格尔德霉素和槚如酸生物活性的比较 Table 1 Comparison of biological activities of geldanamcyin and anacardic acid (Mean±SD, μmol/L) |
MTT法测定结果显示,与对照组相比,不同浓度的槚如酸(0,12.5,25,50,75,100 μmol/L)处理乳腺癌MDA-MB-231细胞48 h后均有显著的细胞增殖抑制作用。MDA-MB-231细胞增殖随着槚如酸药物的浓度增加,其抑制作用越明显,IC50值为29.3 μmol/L,且呈现浓度依赖性关系(表 1)。
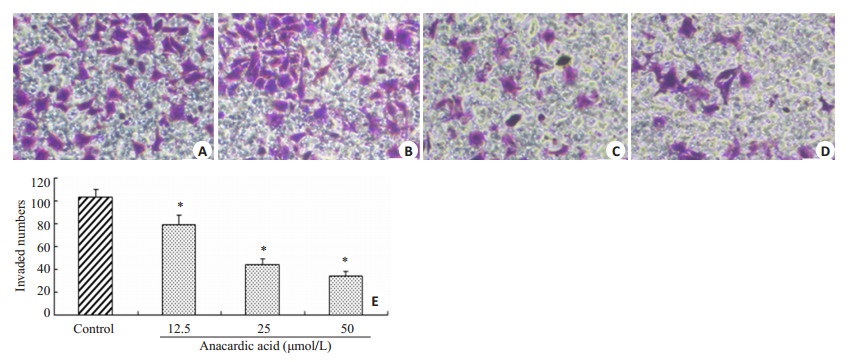
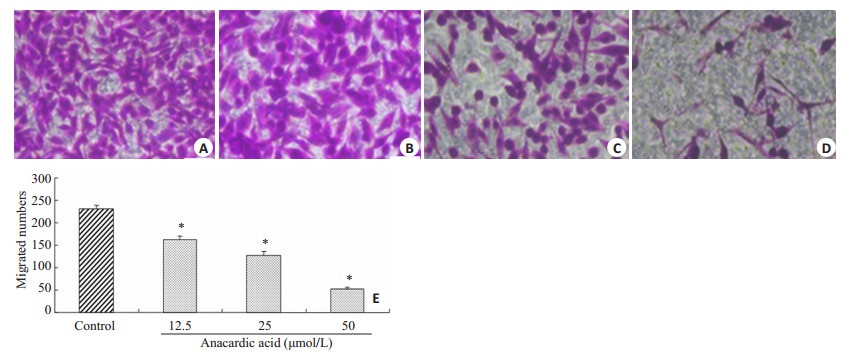
2.3 槚如酸可抑制MDA-MB-231细胞的侵袭、迁移能力通过体外Transwell小室法研究发现,不同浓度的槚如酸处理乳腺癌MDA-MB-231细胞36 h后,其MDA-MB-231细胞侵袭能力明显减弱。与对照组相比,给药组(12.5,25,50 μmol/L)的侵袭抑制率分别为:23.6%、56.6%、67.0% (P < 0.05,图 2)。槚如酸具有明显降低MDA-MB-231细胞的侵袭能力,并呈现出一定的浓度依赖性。此外,体外Transwell迁移实验研究发现,槚如酸处理乳腺癌MDA-MB-231细胞24 h后,与对照组相比,给药组(12.5,25,50 μmol/L)的迁移抑制率分别为:30.0%、45.5%、77.5% (P < 0.05,图 3)。
|
图 2 槚如酸对MDA-MB-231细胞侵袭能力的抑制 Figure 2 Anacardic acid suppressed the invasion of MDA-MB-231 cells (Original magnification: ×400). A: 0 μmol/L; B: 12.5 μmol/L; C: 25 μmol/L; D: 50 μmol/L; E: Quantitative analysis of MDA-MB-231 cell invasion after anacardic acid treatment. *P < 0.05 vs control. |
|
图 3 槚如酸对MDA-MB-231细胞迁移能力的抑制 Figure 3 Anacardic acid suppressed the migration of MDA-MB-231 cells (Original magnification: ×400). A: 0 μmol/L; B: 12.5 μmol/L; C: 25 μmol/L; D: 50 μmol/L; E: Quantitative analysis of MDA-MB-231 cell migration after anacardic acid treatment. *P < 0.05 vs control. |
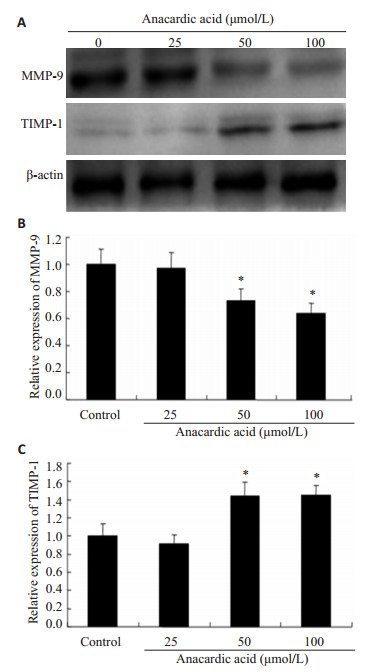
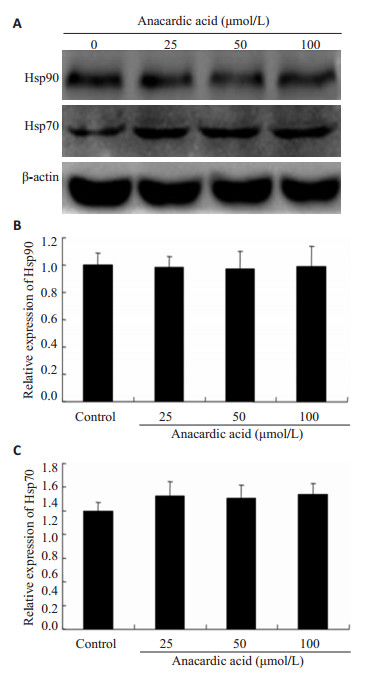
不同浓度的槚如酸(0,25,50,100 μmol/L)处理乳腺癌MDA-MB-231细胞24 h后,通过免疫印迹法观察了相关蛋白MMP-9、TIMP-1、Hsp90、Hsp70的表达情况。如图 4所示,Hsp90顾客蛋白之一,MMP-9随着药物浓度的增加,其表达依次下调,呈现出一定的浓度依赖关系。与对照组相比,给药组(25,50,100 μmol/L)的表达下调率分别为:3%、27%、36%(P < 0.05)。而TIMP-1表达随着药物浓度的增加,其表达逐渐上调,呈现出一定的浓度依赖关系。与对照组相比,给药组(25,50,100 μmol/L)的表达下调率分别为:8%、44%、45% (P < 0.05,图 4)。槚如酸作为一个小分子的Hsp90抑制剂,虽然具有显著的抑制Hsp90 ATPase活性,但对Hsp90和Hsp70表达均不产生明显的影响(图 5)。
|
图 4 槚如酸对MMP-9和TIMP-1蛋白表达的影响 Figure 4 Effects of anacardic acid on expression of MMP-9 and TIMP-1. A: Expression of MMP-9 and TIMP-1 proteins detected by Western blotting; B, C: Quantitative analysis of MMP-9 and TIMP-1 expressions in MDA-MB-231 cells. *P < 0.05 vs control. |
|
图 5 槚如酸对Hsp90和Hsp70蛋白表达的影响 Figure 5 Effects of anacardic acid on expression of Hsp90 and Hsp70. A: Expression of Hsp90 and Hsp70 proteins detected by Western blotting. B, C: Quantitative analysis of the results of Western blotting. |
Hsp90在肿瘤发生、发展的众多信号通路中起作用:包括生长与生长抑制的调控;逃避凋亡;无限制地复制;肿瘤转移和组织浸润;维持血管生成等。TNBC患者约占乳腺癌患者的15%,具有易复发、易转移等特征,并对抗Her-2的靶向药物赫赛汀及内分泌药物治疗均不敏感,目前缺乏对TNBC的规范化药物治疗指南。Hsp90在肿瘤细胞中表达比正常细胞高出2~10倍,因此Hsp90抑制剂对肿瘤细胞具有特定的选择性抗肿瘤作用[9]。最近研究表明,Hsp90抑制剂如PF-4942847、PU-71在体外体内均显示良好的抗TNBC作用,并且Ganetespib (STA-9090)已处于治疗TNBC的临床II期试验。这些研究提示Hsp90抑制剂用于治疗TNBC具有良好的应用前景[10-12]。
天然产物一直是新药研发中,发现先导化合物的重要来源之一。本研究通过对实验室拥有的天然化合物进行体外抑制Hsp90 ATPase活性筛选,发现槚如酸具有特异性抑制Hsp90 ATPase活性作用。槚如酸结构上属于水杨酸类衍生物,是典型的histone acetyltransferase抑制剂,并通过抗生长、诱导凋亡等产生抗肿瘤作用[13]。本实验结果显示,槚如酸具有抑制Hsp90 ATPase活性、抑制肿瘤细胞增殖以及侵袭转移的能力。该研究结果对寻找TNBC治疗药物过程中,发现先导化合物具有重要的指导意义。
Hsp90蛋白N-末端有一个高度保守的ATP结合位点,Hsp90发挥分子伴侣功能的作用机制包括ATP结合到N-末端结构域及随后的ATP水解。大多数Hsp90抑制剂,如GA是通过和ATP竞争性地与N-末端结合,继而通过泛素化蛋白酶体途径降解众多肿瘤相关顾客蛋白。本研究采用了2种体外方法来检测槚如酸的抑制Hsp90活性,结果证明槚如酸对酵母Hsp90 ATPase活性具有特异性的抑制作用,且可能是槚如酸与ATP竞争性地结合于Hsp90的N-末端ATP结合位点。图 1显示随着槚如酸浓度的增加,与ATP-琼脂糖凝胶结合的Hsp90α的量明显下降,即说明槚如酸阻碍Hsp90与ATP的结合。
乳腺癌是全身性恶性肿瘤,转移是乳腺癌患者死亡的重要原因,而细胞外基质(ECM)和基底膜的降解是癌细胞侵袭转移过程中的一个关键步骤。本实验通过Transwell体外侵袭迁移模型模拟在体TNBC肿瘤细胞的侵袭迁移过程,结果显示Hsp90抑制剂槚如酸可有效地抑制MDA-MB-231细胞的侵袭迁移能力,随着药物浓度的增加其抑制效果越明显,即槚如酸对肿瘤细胞的抑制作用呈现剂量-效应关系。据报道,乳腺癌单克隆抗体4C5通过抑制Hsp90与MMP2、MMP9相互作用显著地抑制乳腺癌的骨转移[14]。Hsp90顾客蛋白之一的MMP9是MMPs中的相对分子质量最大的,参与ECM的IV型、V型胶原和明胶的降解,在肿瘤的血管形成、浸润和转移过程中扮演关键角色[15]。乳腺癌的转移是多步骤多因素参与的复杂过程,本研究结果显示,在这过程中MMP-9和TIMP-1发挥着重要作用。槚如酸对乳腺癌MDA-MB-231细胞侵袭迁移能力具有显著的抑制作用,其可能机制是通过抑制Hsp90的分子伴侣功能下调MMP-9蛋白表达,同时增加肿瘤细胞自身可产生的TIMP-1的表达增加相关。有趣的是在整个过程中槚如酸对细胞内Hsp90和Hsp70蛋白表达均没有影响,即槚如酸只是抑制Hsp90 ATPase活性,对其蛋白表达均不起作用,与以往的文献报道大致吻合。
综上所述,槚如酸作为一个小分子的新型Hsp90抑制剂,具有较强的体外抗TNBC作用,即抑制Hsp90 ATPase活性,抑制肿瘤增殖、侵袭、迁移。遗憾的是本研究中仅采用了体外检测方法来探讨了槚如酸的抗TNBC作用,因此进一步的体内外药效及其作用机制研究有待于深入。
| [1] | Bryan BB, Schnitt SJ, Collins LC. Ductal carcinoma in situ with basal-like phenotype: a possible precursor to invasive basal-like breast cancer[J]. Mod Pathol,2006, 19 (5) : 617-21. DOI: 10.1038/modpathol.3800570. |
| [2] | Whitesell L, Lindquist SL. Hsp90 and the charperoning of cancer[J]. Nat Rev Cancer,2005, 5 : 761-72. DOI: 10.1038/nrc1716. |
| [3] | Sankhala KK, Mita MM, Mita AC. Heat shock proteins: a potential anticancer target[J]. Curr Drug Targets,2011, 12 (14) : 2001-8. DOI: 10.2174/138945011798829339. |
| [4] | Seijas JA, Vázouez-Tatomp MP, Martinez MM, et al. Synthesis of anacardic acids by nucleophilis substitution on 2-aryloxazolines[J]. Tetrahedron Lett,2004, 45 (9) : 1937-9. DOI: 10.1016/j.tetlet.2003.12.127. |
| [5] | Rea AI, Schmidt JM, Setzer WN, et al. Cytotoxic activity of Ozorpa insignis from Zimbabwe[J]. Fitoterapia,2003, 74 (7-8) : 732-35. DOI: 10.1016/j.fitote.2003.08.007. |
| [6] | Kubo I, Ochi M, Vieira PC, et al. Antitumor agents from the Cashew (Anacardium occidentale) apple juice[J]. J Agric Food Chem,1993, 41 : 1012-015. DOI: 10.1021/jf00030a035. |
| [7] | Schultz DJ, Wickramasinghe NS, Ivanova MM, et al. Anacardic acid inhibits estrogen receptor alpha-DNA binding and reduces target gene transcription and breast cancer cell proliferation[J]. Mol Cancer Ther,2010, 9 (3) : 594-605. DOI: 10.1158/1535-7163.MCT-09-0978. |
| [8] | Wu CZ, Moon AN, Choi O, et al. 6-Alkylsalicylic acid analogues inhibit in vitro ATPase activity of heat shock protein 90[J]. Arch Pharm Res,2010, 33 (12) : 1997-2001. DOI: 10.1007/s12272-010-1215-0. |
| [9] | Kamal A, Thao L, Sensintaffar J, et al. A hig-affinity conformation of Hsp90 confers tumor selectivity on Hsp90 inhibitors[J]. Nature,2003, 425 (6956) : 407-10. DOI: 10.1038/nature01913. |
| [10] | Mehta PP, Whalen P, Baxi SM, et al. Effective targeting of triple-negative breast cancer cells by PF-4942847, a novel oral inhibitor of Hsp90[J]. Clin Cancer Res,2011, 17 (16) : 5432-42. DOI: 10.1158/1078-0432.CCR-11-0592. |
| [11] | Caldas-Lopes E, Cerchietti L, Ahn JH, et al. Hsp90 inhibitor PU-71, a multimodal inhibitor of malignancy, induces complete responses in triple-negative breast cancer models[J]. Proc Natl Acad Sci,2009, 106 (20) : 8368-73. DOI: 10.1073/pnas.0903392106. |
| [12] | Shastry M, Yardley D. Updates in the treatment of basal/triplenegative breast cnacer[J]. Curr Opin Obstet Gynecol,2013, 25 (1) : 40-8. DOI: 10.1097/GCO.0b013e32835c1633. |
| [13] | Sun YL, Jiang XF, Chen SJ, et al. Inhibition of histone acetyltransferase activity by anacardic acid sensitizes tumor cells to ionizing radiation[J]. FEBS Lett,2006, 580 (18) : 4353-6. DOI: 10.1016/j.febslet.2006.06.092. |
| [14] | Stellas D, Hamidieh A, Patsavaudi E. Monoclonal antibody 4C5 prevents activation of MMP2 and MMP9 by disrupting their interaction with extracelluar Hsp90 and inhibits formation of metastatic breast cancer cell deposits[J]. BMC Cell Biol,2010, 11 : 15. DOI: 10.1186/1471-2121-11-15. |
| [15] | Groblewska M, Siewko M, Mcrozko B, et al. The role of matrix metalloproteinases (MMPs) and their inhibitors (TIMPs) in the development of esophageal cancer[J]. Folia Histochem Cytobiol,2012, 50 (1) : 12-9. DOI: 10.5603/FHC.2012.0002. |
 2016, Vol. 35
2016, Vol. 35
