VHL基因最早发现于常染色体显性遗传病von Hippel-Lindau的患者,它是以视网膜血管瘤、嗜铬细胞瘤、肾透明细胞癌为特征的肿瘤综合征。VHL基因位于人3号染色体短臂(3p25.3),有研究证实在肾透明细胞癌患者中,VHL基因的突变或启动子的超甲基化会导致VHL基因功能失活。VHL基因功能失活导致缺氧诱导因子(hypoxia induced factor, HIF)不能被有效的降解,从而导致缺氧诱导基因的激活,如血管内皮生长因子(VEGF)、转化生长因子α(TGF-α)、表皮生长因子(EGFR)等[1],它们与肿瘤生长有着密切的关系。
虽然对VHL基因的研究已长达20多年,但其在肾癌的发生发展中的具体分子生物学机制仍然没有完全明确。除经典的VHL/HIF信号通路外,还存在着VHL非依赖性肾癌以及HIF非依赖性肾癌等,而HIF依赖型又分为H1H2型和H2型[2]。此外,针对VHL/HIF信号通路的分子靶向药物虽然对肾癌疗效较好,但仍存在耐药及副作用的问题,因此需要寻找新的治疗靶点[3]。VHL基因的功能失活在肾透明细胞癌中普遍存在(91%)[4],且近年来有研究表明,VHL基因的功能失活还与细胞自噬、表观遗传学等分子生物学机制相关[5-7]。这些均提示,VHL基因仍然是目前肾癌研究中的重点及热点,而构建VHL基因过表达和敲低的稳定转染细胞株将有助于对VHL基因的功能及其对下游的影响作更深入的研究。
我们通过构建VHL慢病毒表达载体及干扰载体,分别稳定转染至肾癌细胞株A498(VHL失活突变)及Caki-1(VHL野生型)中,观察VHL的表达,并探讨其对肾癌细胞增殖和凋亡的影响。
1 材料与方法 1.1 材料载体质粒pZsGreen1、pLL3.7,包装质粒pMDL、pRev、pVSVG,包装细胞293T及人肾癌细胞株A498、Caki-1均为本实验室保存。限制性内切酶EcoRⅠ、BamHⅠ、HpaⅠ、XhoⅠ及T4 DNA连接酶均购自美国NEB公司。RNA提取试剂盒、无内毒素质粒提取试剂盒、DNA纯化试剂盒及PCR扩增试剂购自北京康为世纪生物科技有限公司。MTS试剂盒购自美国Promega公司。细胞凋亡试剂盒购自碧云天生物技术研究所。胎牛血清、EBSS培养基、高糖培养基、脂质体lipofectamine2000TM购自Invitrogen公司。荧光定量PCR试剂购自北京全式金生物技术有限公司。兔抗人VHL抗体购自abcam公司,碱性磷酸酶标记山羊抗兔IgG购自中杉金桥公司。
1.2 方法 1.2.1 引物设计合成参考GenBank的VHL基因序列设计出1对VHL全基因扩增引物,序列如下,上游引物:5'CCGGAATTCATGCCCCGGAGG3',下游引物:5'CGCGGATCCTCAATCTCCCATCCG3'。VHL基因干扰序列由上海吉玛制药技术有限公司设计:5'GCCTGAGAATTACAGGAGA3',Control靶序列为5'TTCTCCGAACGTGTCACGT3',在设计的寡核苷酸序列中5'端为HpaⅠ酶切位点,3'端为XhoⅠ酶切位点,中间为9个碱基的loop结构:TTCAAGAGA。序列均由Invitrogen公司合成。
1.2.2 重组慢病毒表达载体pZsGreen1-VHL的构建、鉴定和测序提取293T细胞RNA,逆转cDNA,用VHL全基因扩增引物扩增得到目的片段,分别用EcoRⅠ和BamHⅠ双酶切目的片段及pZsGreen1,经T4连接酶连接得到重组载体pZsGreen1-VHL,提取质粒经双酶切鉴定后送测序。
1.2.3 重组慢病毒干扰载体pLL3.7-shVHL的构建、鉴定和测序2对寡核苷酸链退火后与经HpaⅠ、XhoⅠ双酶切的pLL3.7质粒连接得到重组载体pLL3.7-shVHL,提取质粒经XbaⅠ、XhoⅠ双酶切鉴定后送测序
1.2.4 转染293T细胞将生长状态良好的293T细胞接种至6 cm培养皿中,待细胞密度达70%时,更换无血清无抗生素DMEM培养基,取10 μgDNA(pZsGreen1/ pLL3.7:pVSVG:pRev:pMDL=3:1:1:1)加入OptiMem至250 μl,取8 μg lipofectamine2000加入OptiMem至250 μl,轻轻混匀后室温放置5 min,将两者混匀后再室温放置20 min,将上述混合液加入培养基中轻轻混匀,6 h后换新鲜培养基5 ml,37 ℃、5% CO2孵育48 h后收集病毒。
1.2.5 感染A498及Caki-1细胞感染前1 d,取对数生长期状态良好的A498及Caki-1细胞,按每孔3×105个细胞接种于6孔板中培养,待细胞密度达70%时加入包装的慢病毒,相当于每个细胞10个病毒量,感染24 h后换液,96 h后荧光显微镜下观察细胞荧光发光。
1.2.6 荧光定量PCR鉴定分别收集感染重组慢病毒和对照未感染的细胞,提取RNA,逆转得到cDNA,后采用SYBR Green法进行荧光定量PCR。VHL引物序列,上游:5'TGTGCCATCTCTCAATGT3',下游:5'CCAGTC TCCTGTAATTCTCA3'。
1.2.7 Western-blot鉴定分别收集感染重组慢病毒和对照未感染的细胞,裂解提取细胞总蛋白,经BCA法蛋白定量,SDS-PAGE凝胶电泳样品,蛋白上样量为50 μg,半干转15 V稳压转膜17 min,经凝胶蛋白转移至聚偏氟乙烯(PVDF)膜。5%脱脂奶粉37 ℃封闭1.5 h,后加入兔抗人VHL一抗(1:2000稀释),4 ℃过夜,TBST洗膜后加入羊抗兔二抗(1:3000稀释),室温孵育2 h,TBST洗膜后与化学发光底物孵育5 min,暗室中用X线片曝光、显影、定影。用β-actin作内参验证蛋白含量。
1.2.8 MTS法检测细胞增殖实验设重组慢病毒感染组、空载体组、和未处理的阴性对照组,每组各设6个重复孔,按照每孔5000个细胞密度接种于96孔板中,在37 ℃、5% CO2孵育0、24、48、72、96 h后每孔加20 μl MTS溶液,继续培养2 h。酶标仪上选490 nm波长测定各孔吸光度(A490)值。计算6孔平均值。
1.2.9 细胞周期的检测收集各组细胞,调整细胞密度至1×108/L,预冷的70%乙醇固定2 h后加入0.5 ml碘化丙啶染色液,37 ℃避光温浴30 min,随即进行流式细胞仪检测,观察细胞周期分布情况。
1.2.10 细胞凋亡的检测收集各组细胞,调整细胞密度至1×108/L,加入5 μl膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),室温避光孵育10 min,加入5 μl碘化丙啶(PI)染色,随即进行流式细胞仪检测,观察凋亡细胞百分比。
1.2.11 统计学方法数据以均数±标准差表示,应用SPSS13.0统计软件分析,组间比较采用t检验。
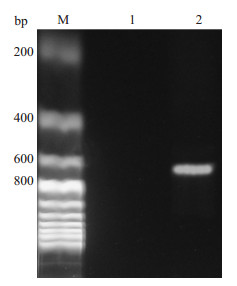
2 结果 2.1 PCR获得VHL全长基因利用293T细胞cDNA,通过PCR方法扩增出VHL的全长基因,经1%琼脂糖凝胶电泳分离后得到大小约600 bp特异性单一条带(图 1)。
|
图 1 人VHL基因的PCR扩增产物电泳图 Figure 1 Result of PCR amplification. M: 200 bp Marker; Lane2: Product of PCR amplification. |
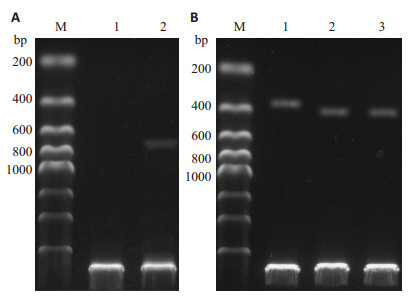
重组慢病毒载体pZsGreen1-VHL经EcoR Ⅰ、BamHⅠ双酶切后,1%琼脂糖凝胶电泳显示约600 bp左右的VHL片段(图 2A),pLL3.7-shVHL经XbaⅠ、XhoⅠ双酶切,因插入片段的影响,重组质粒与未重组质粒约有50 bp的差异(图 2B)。测序结果显示质粒构建成功。
|
图 2 双酶切鉴定 Figure 2 Result of double digestion of the vectors. A: Lane1: ZsGreen1-control, Lane 2: ZsGreen1-VHL; B: Lane1: pLL3.7, Lane2:pLL3.7-control, Lane3: pLL3.7-VHL shRNA; M: 200 bp Marker. |
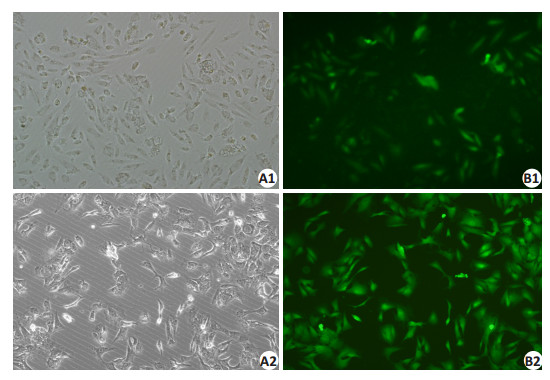
感染重组慢病毒96 h后在荧光显微镜下观察细胞,其生长状态良好。与对照组比较,感染后的细胞可见广泛绿色荧光存在,说明慢病毒的感染效率较高(图 3)。
|
图 3 慢病毒感染效率 Figure 3 Cells with virus infection. A1: A498 cells under white light; A2: Caki-1 cells under white light; B1: A498 cells under fluorescent light; B2: Caki-1 cells in fluorescent light. |
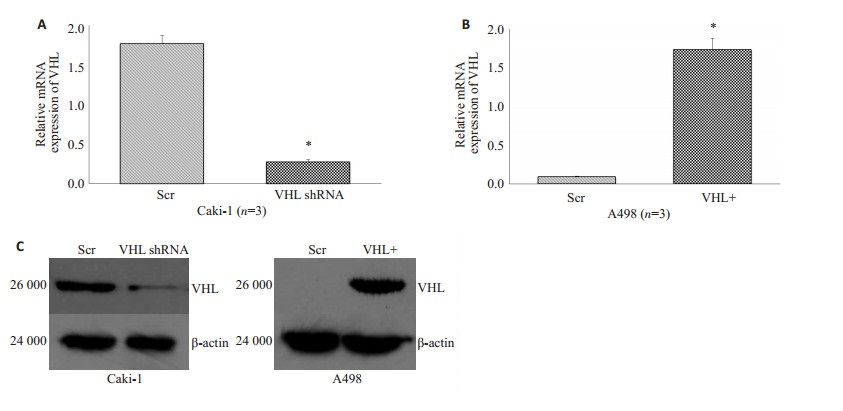
RT-PCR结果显示转染pZsGreen1-VHL的A498细胞,VHL基因在mRNA水平的表达量明显增高(图 4B);转染pLL3.7-shVHL的Caki-1细胞,VHL基因在mRNA水平的表达量明显降低(图 4A);同时,Westernblot结果也得到相同的结果,证实了VHL基因在蛋白水平表达量的变化(图 4C)。
|
图 4 过表达及干扰效果鉴定 Figure 4 Efficiency of overexpression and knockdown. A: VHL mRNA expressions in Caki-1 cells with pLL3.7-VHL shRNA infection were decreased significantly; B: VHL mRNA expressions in A498 cells with ZsGreen1-VHL infection were increased significantly; C: VHL protein expressions in Caki-1 cells with pLL3.7-VHL shRNA infection were decreased significantly, while VHL protein expressions in A498 cells with ZsGreen1-VHL infection were increased significantly. |
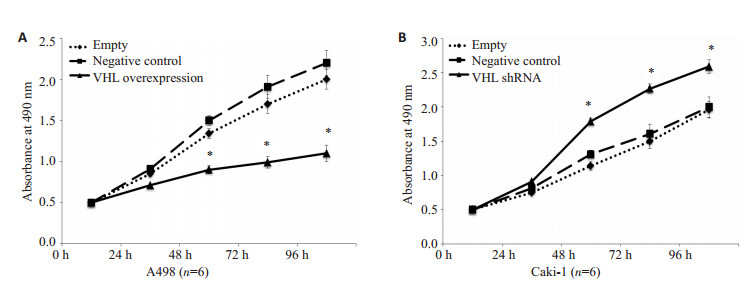
6组细胞经培养后,可见VHL基因对细胞增殖有明显的抑制作用,转染pZsGreen1-VHL的A498细胞,其增殖效应较对照组明显减缓,而转染pLL3.7-shVHL的Caki-1细胞,其增殖效应较对照组明显加快,各对照组间增殖趋势差异无统计学意义(图 5)。
|
图 5 MTS法检测细胞增殖 Figure 5 MTS assay showing the effect of VHL on cell proliferation. A: Proliferation of A498 cells infected with pZsGreen1-VHL was significantly decreased compared with control groups; B: Proliferation of Caki-1 cells infected with pLL3.7-VHL shRNA was significantly increased compared with control groups. |
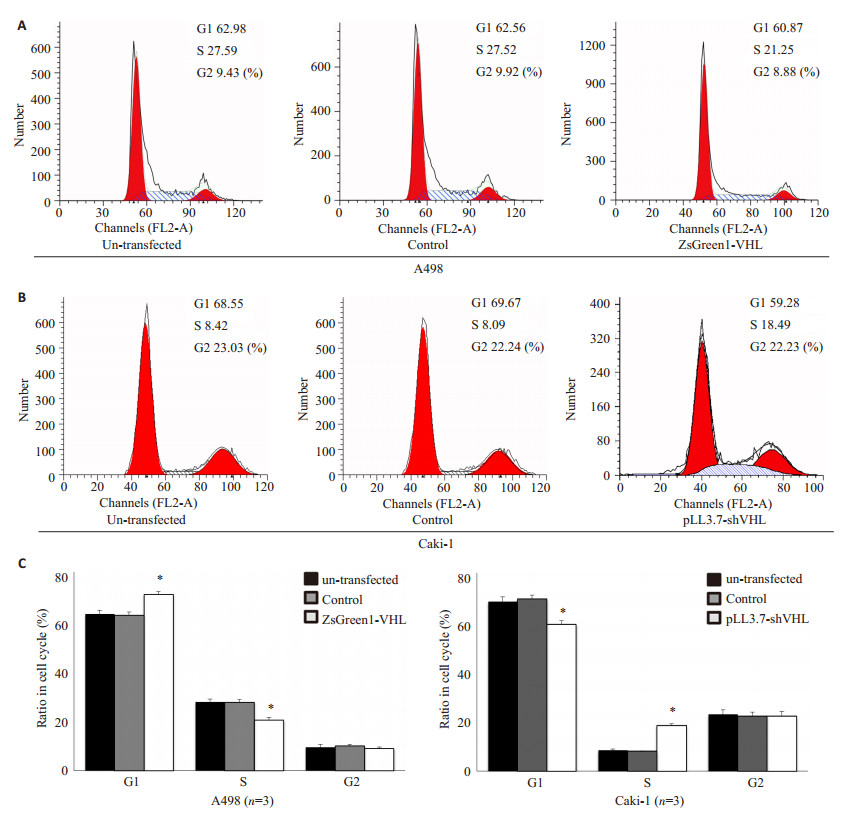
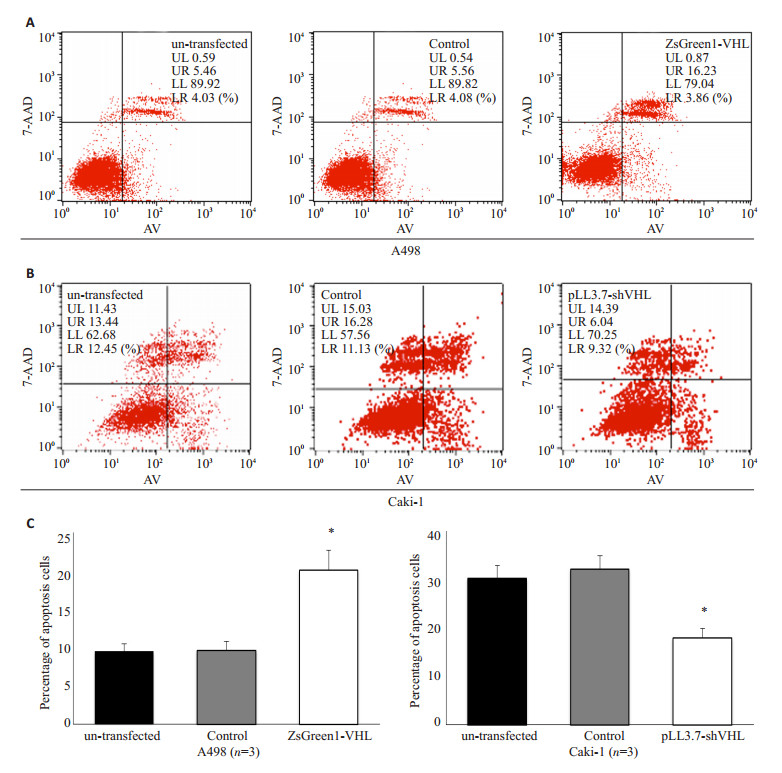
6组细胞经培养后,通过流式细胞仪分析,结果显示VHL基因使细胞呈现G0/G1到S期的阻滞,转染pZsGreen1-VHL的A498细胞G0/G1期细胞数显著增多,S期细胞数显著减少,而转染pLL3.7-shVHL的Caki-1细胞G0/G1期细胞数显著减少,S期细胞数显著增多,各对照组间差异无统计学意义(图 6);VHL基因对细胞凋亡有明显的促进作用,转染pZsGreen1-VHL的A498细胞,其细胞凋亡率明显增高,而转染pLL3.7-shVHL的Caki-1细胞,其细胞凋亡率明显下降,各对照组间凋亡率差异无统计学意义(图 7)。
|
图 6 流式细胞仪分析细胞周期 Figure 6 Flow cytometry showing the effect of VHL on cell cycle. A: A498 cells infected with pZsGreen1-VHL induced G1-S phase arrest; B: Caki-1 cells infected with pLL3.7-VHL shRNA induced G1-S phase transition; C: Quantitative analysis of the results (Mean±SD). |
|
图 7 流式细胞仪分析细胞凋亡率 Figure 7 Flow cytometry showing the effect of VHL on cell apoptosis. A: A498 cells infected with pZsGreen1-VHL showed increased cell apoptosis; B: Caki-1 cells infected with pLL3.7-VHL shRNA showed inhibited cell apoptosis; C: Quantitative analysis of the results (Mean±SD). |
我们通过本实验成功的扩增出VHL的全长基因,并设计出有效的靶向作用于VHL的shRNA序列,并分别将其成功的克隆入慢病毒载体质粒pZsGreen1及pLL3.7中,经酶切鉴定及测序证实载体构建成功。肾癌细胞株A498及Caki-1分别为VHL突变型及野生型,因此我们选取这两种细胞分别构建VHL过表达及敲低的稳定转染细胞株。我们通过3质粒系统将载体质粒包装成病毒颗粒,感染肾癌细胞株,96 h后可见广泛绿色荧光存在,RT-PCR和Western blot结果显示过表达及干扰效果明显,提示稳定转染细胞株构建成功。VHL过表达及敲低的稳定转染细胞株的构建成功为下一步的研究打下了坚实的基础,有利于VHL基因在肾癌细胞中功能的研究以及VHL基因上下游一系列变化的研究。
我们进一步通过MTS法和流式细胞仪检测了VHL基因对肾癌细胞株增殖、周期和凋亡的影响,结果显示VHL基因可使细胞周期阻滞于G0/G1期,明显抑制肾癌细胞的生长,并促进其凋亡。这一结果从现象上证实了VHL基因在肾癌的发生发展过程中起到了抑癌基因的作用,与其他研究结果一致[1]。但本试验也存在一定的局限性,并未探讨VHL基因发挥抑癌作用的具体机制,这也是我们下一步的研究重点之一。
VHL基因抑制增殖,促进凋亡的机制有很多。最经典的机制为VHL基因的功能失活使得缺氧诱导因子1α(HIF-1α)的泛素化水解过程受到抑制,HIF-1α的持续高表达导致一系列缺氧诱导基因的激活,如血管内皮生长因子(VEGF)、转化生长因子α(TGF-α)、表皮生长因子(EGFR)、碳酸酐酶IX(CA9)等[1]。近年来还有研究报道,VHL可通过ARC调节肾癌细胞的凋亡率[8],通过E2F1调节肾癌细胞的周期以及增殖能力[9]。MAPK1可作为VHL的靶基因,独立于HIF在肾癌细胞中发挥作用[10]。而JNK在VHL缺失的情况下过度活化,从而促进肾癌的发生发展,并可作为肾癌治疗的新靶点[11-12]。此外,VHL还可经细胞自噬作用[5],microRNA [5, 13-14],以及组蛋白的甲基化或去甲基化等[6-7]途径来调控肾癌细胞的周期,以及增殖、凋亡能力。
以往研究表明,VHL的功能失活仅与肾癌的增殖和凋亡有关,而与肾癌的转移侵袭能力无关,且VHL功能的失活与肾癌患者的临床预后无关。然而近年来研究表明,VHL的功能失活可能还与E-cadherin[15-16]、CXCR4 [6]以及JunB [17]相关,并通过它们促进肾癌的转移侵袭能力。还有研究表明,VHL的功能缺失会导致表观遗传学发生改变,而表观遗传学的改变与肾癌的不良预后相关[6]。因此,VHL基因与肾癌转移及其临床预后的关系也逐渐开始引起重视,具有一定的研究价值。我们在本实验中并未探讨VHL与肾癌转移及预后的关系,值得我们进一步的试验考证。
综上所述,VHL是肾透明细胞癌发生发展过程中的关键基因,其功能缺失导致下游一系列相关基因、microRNA的表达水平以及表观遗传学发生变化。因此,VHL基因过表达及敲低的稳定转染细胞株的建立将有利于研究VHL基因对肾癌细胞的功能,发现VHL基因下游发生的一系列变化,对肾透明细胞癌发生发展的具体分子生物学机制进行更进一步的研究,并为肾透明细胞癌的分子靶向治疗提供依据。
| [1] | Baldewijns MM, van Vlodrop IJ, Vermeulen PB, et al. VHL and HIF signalling in renal cel carcinogenesis[J]. J Pathol,2010, 221 : 125-38. DOI: 10.1002/path.2689. |
| [2] | Oosterwijk E, Rathmell WK, Junker KA, et al. Basic research in kidney cancer[J]. Eur Urol,2011, 60 (4) : 622-33. DOI: 10.1016/j.eururo.2011.06.048. |
| [3] | Targeted therapy for renal cell cancer: current perspectives[J]. Discov Med, 2010, 10(54): 394-405. |
| [4] | Nickerson ML, Jaeger E, Shi Y, et al. Improved identification of von Hippel-Lindau gene alterations in clear cell renal tumors[J]. Clin Cancer Res,2008, 14 (15) : 4726-34. DOI: 10.1158/1078-0432.CCR-07-4921. |
| [5] | Mikhaylova O, Stratton Y, Hall D, et al. VHL-Regulated MiR-204 suppresses tumor growth through inhibition of LC3B-Mediated autophagy in renal clear cell carcinoma[J]. Cancer Cell,2012, 21 (4) : 532-46. DOI: 10.1016/j.ccr.2012.02.019. |
| [6] | Vanharanta S, Shu W, Brenet F, et al. Epigenetic expansion of VHL-HIF signal output drives multiorgan metastasis in renal cancer[J]. Nat Med,2013, 19 (1) : 50-6. |
| [7] | Niu X, Zhang T, Liao L, et al. The von Hippel-Lindau tumor suppressor protein regulates gene expression and tumor growth through histone demethylase JARID1C[J]. Oncogene,2012, 31 (6) : 776-86. DOI: 10.1038/onc.2011.266. |
| [8] | Razorenova OV, Castellini L, Colavitti R, et al. The apoptosis repressor with a CARD domain (ARC) gene is a direct hypoxiainducible factor 1 target gene and promotes survival and proliferation of VHL-deficient renal cancer cells[J]. Mol Cell Biol,2014, 34 (4) : 739-51. DOI: 10.1128/MCB.00644-12. |
| [9] | Mans DA, Vermaat JS, Weijts BG, et al. Regulation of E2F1 by the von Hippel-Lindau tumour suppressor protein predicts survival in renal cell cancer patients[J]. J Pathol,2013, 231 (1) : 117-29. DOI: 10.1002/path.4219. |
| [10] | Arias-Gonzalez A L. ERK5/BMK1 is a novel target of the tumor suppressor VHL:implication in clear cell renal carcinoma[J]. Neoplasia,2013, 15 (6) : 649-59. DOI: 10.1593/neo.121896. |
| [11] | An J, Liu H, Magyar CE, et al. Hyperactivated JNK is a therapeutic target in pVHL-deficient renal cell carcinoma[J]. Cancer Res,2013, 73 (4) : 1374-85. DOI: 10.1158/0008-5472.CAN-12-2362. |
| [12] | Xu M, Hong M, Xie H. Histone deacetylase inhibitors induce human renal cell carcinoma cell apoptosis through p-JNK activation[J]. Nan Fang Yi Ke Da Xue Xue Bao,2013, 33 (10) : 1409-15. |
| [13] | Hirata H, Hinoda Y, Ueno K, et al. MicroRNA-1826 directly targets beta-catenin (CTNNB1) and MEK1 (MAP2K1) in VHL-inactivated renal cancer[J]. Carcinogenesis,2012, 33 (3) : 501-8. DOI: 10.1093/carcin/bgr302. |
| [14] | Neal SC, Michael MZ, Rawlings LH, et al. The VHL-dependent regulation of microRNAs in renal cancer[J], 2010, 8: 64. |
| [15] | Harten SK, Shukla D, Barod R, et al. Regulation of renal epithelial tight junctions by the von Hippel-Lindau tumor suppressor gene involves occludin and claudin 1 and is Independent of E-cadherin[J]. Mol Biol Cell,2009, 20 (3) : 1089-101. |
| [16] | He X, Zheng Z, Song T, et al. c-Abl regulates estrogen receptor alpha transcription activity through its stabilization by phosphorylation[J]. Oncogene,2010, 29 (15) : 2238-51. DOI: 10.1038/onc.2009.513. |
| [17] | Kanno T, Kamba T, Yamasaki T, et al. JunB promotes cell invasion and angiogenesis in VHL-defective renal cell carcinoma[J]. Oncogene,2012, 31 (25) : 3098-110. DOI: 10.1038/onc.2011.475. |
 2016, Vol. 35
2016, Vol. 35
