2. 湖北中医药大学,湖北 武汉 430065
2. College of Pharmacy of Hubei University of Chinese Medicine, Wuhan 430065, China
中医传统理论认为脾主运化,为后天之本,气血化生之本源,现代研究也认为,包括消化、吸收、代谢、免疫、神经、内分泌等多系统的功能均与脾(胃)有关[1],而脾虚也常表现为上述多系统的综合征。苍术性温,味甘苦,归肝脾肾三经,主要功能是燥湿健脾,临床常用于消化系统病症的治疗,具有很好的调理胃肠功能,促进胃肠动力,防治慢性胃肠疾病的作用[2]。查阅相关文献,发现国内外对苍术的研究较少,更少涉及对消化系统疾病干预机制的深层次研究。本项研究通过观察苍术提取物(Rhizome Atractylodes extract, ERA)对脾虚证模型大鼠胃粘膜损伤及胃肠免疫功能障碍的影响,评价ERA对脾虚证模型大鼠胃粘膜的保护及对胃肠免疫功能的调节作用,研究ERA调控脾虚的确切机制。
1 材料和方法 1.1 动物雄性健康SD大鼠,体质量200±20 g,购自同济医科大学实验动物中心,动物许可证号SKSF(鄂)20130105。
1.2 药物与试剂苍术提取物(ERA),批号:130711,武汉市九州通医药有限公司,通过HPLC特征图谱分析苍术醇提物中主要含有苍术素、茅术醇、B-桉叶醇、苍术定醇、苍术酮、苍术呋喃烃等活性成分,与文献一致[3-4],药品质量合格。多潘立酮片,批号:130112,西安杨森制药有限公司;生物素化羊抗大鼠IgG、IgA试剂盒,批号分别为:20120615, 20120614,亲和素-HRP,批号:121101,抗胃黏膜三叶因子1(TFF1)、Toll样受体4(TLR4)兔多克隆抗体,批号分别为:120508,120507,以上均由南京建成生物科技有限公司提供。
1.3 仪器TP-A100电子分析天平(上海君鹰衡器有限公司);GC-1500型γ放射免疫计数器(安徽中科中佳科学仪器有限公司);DG5032型酶联免疫检测仪(南京市华东电子团体医疗装备有限责任公司);XSP-300型-双目显微镜(上海蔡康光学仪器有限公司);Image-Pro Plus 5.1分析系统、Motic图像分析系统(奥林巴斯中国有限公司);moorLDI2-HIR激光多普勒微循环血流计(吉安得尔科技有限公司)。
1.4 方法 1.2.1 脾虚大鼠模型制备脾虚大鼠模型的建立参照曾益宏、刘友章等[5]创立的破气苦降加饥饱失常法,每日灌服小承气汤煎剂诱发大鼠脾虚模型。经观察,造模结束时,正常组大鼠毛发顺整;行为状态正常;活跃程度一般;睡眠正常;饮食、大便正常。而模型复制组大鼠均出现了以下变化:毛发不泽、枯乱;少动、拱背、眯眼、扎堆、兴奋性差;活跃度迟缓;嗜睡、倦卧;饮食明显减少;大便便溏。同时,造模结束时,与正常组比较,模型复制组大鼠无论体温(℃)(35.29±0.69 vs 36.92±0.41,P < 0.01)、体质量(g)(205.7±10.2 vs 249.8±12.1,P < 0.01)、活动次数(次)(14.20±3.05 vs 43.45±8.37,P < 0.01),还是尿D-木糖排泄率(20.38±3.38 vs 49.55±6.56,P < 0.01),都明显降低,由此确定脾虚模型复制成功,且成功率达到90%以上。
1.2.2 分组及给药确认大鼠模型造模成功后,将模型复制组大鼠随机分组:脾虚模型组(模型组),ERA高、中、低剂量组,多潘立酮组,10只/组,并与正常组10只大鼠一同进入实验,结束造模后次日开始灌胃给药,动物连续灌胃10 d,其中ERA高、中、低剂量组每天的剂量为20.0、10.0、5.0 g/kg,多潘立酮组为5.0 mg/kg,正常组和脾虚模型组则给予相同体积的生理盐水。
1.2.3 指标检测 1.2.3.1 大鼠肠道灌流液Ig A及血清IgG含量的测定肠灌洗液IgA的测定:最后1次灌胃给药后,所有大鼠禁食不禁水24 h,肠灌洗液灌胃4次,每次2 ml,每次间隔15 min,按文献方法[6]收集肠灌洗液,ELISA法测定肠液分泌型IgA含量。待胃黏膜血流量测定完毕后,腹主动脉采血法采血6 ml,ELISA法测定血清IgG含量。
1.2.3.2 大鼠胃黏膜血流量的测定[7]大鼠麻醉后仰姿,然后经大鼠剑突下正中剪开腹壁,充分暴露胃体,并在胃体前壁切开一0.5 cm的切口,插入激光多普勒微循环血流仪探头,分别测量胃体大小弯,胃窦等处胃黏膜血流量(GMBF)。
1.2.3.3 大鼠胸腺、脾脏指数与脾淋巴细胞(T、B)增殖率测定[8]脱颈椎处死大鼠,取胸腺和脾,计算胸腺、脾脏指数(B),计算公式是:B=脏器质量(mg)/大鼠体质量(g)×100%。
1.2.3.4 大鼠胃黏膜病理学观察选择病变的胃黏膜组织(所有大鼠均取相同部位),10%甲醛液固定,常规石蜡包埋,5 μm连续切片,HE常规染色,光镜下观察胃黏膜病理学改变并摄像。
1.2.3.5 大鼠胃黏膜组织中TFF1及结肠组织TLR4表达量的测定取胃黏膜及结肠组织,4%多聚甲醛固定,石蜡包埋,切片。按SABC法免疫组化处理,所有切片均在高倍显微镜下(同一条件)观察,阳性细胞的标准是细胞质或胞核被染为棕黄色或棕褐色。每个样本随机检测染色较好的5个高倍视野,Image-Pro Plus 5.1分析系统半定量分析,观察并计算胃黏膜腺体和上皮单位面积上TFF1及结肠组织横断面固有层单位面积上TLR4阳性细胞染色的积分光密度,以IOD值表示,5个高倍视野IOD值的均数即为该样本阳性细胞积分光密度值(IOD值)。
1.3 统计学方法数据以均数±标准差表示,应用SPSSl7.0统计软件进行单因素方差分析,均数两两比较采用q检验,显著性检验水平为α=0.05。
2 结果 2.1 大鼠胃黏膜血流量的测定与模型组比较,正常组、ERA高、中、低剂量组、多潘立酮组的胃黏膜血流量明显升高(P < 0.05或P < 0.01);与多潘立酮组比较,ERA高、中剂量组胃黏膜血流量进一步升高,差异有显著性(P < 0.05或P < 0.01);与ERA低剂量组比较,ERA高、中剂量组胃黏膜血流量明显升高(P < 0.05或P < 0.01,表 1)。
| 表 1 ERA对模型大鼠胃黏膜血流量的影响 Table 1 Effect of Rhizoma atractylodis extract on gastric mucosal blood flow in the rats (Mean±SD, n=10) |
正常组大鼠胃粘膜结构正常,层次清楚(图 1A);模型组大鼠胃黏膜及黏膜下层出血、水肿明显,粘膜变薄,大片状脱落,连续性胃黏膜中断, 粘膜上皮细胞坏死(图 1B);多潘立酮组大鼠胃粘膜部分中断,黏膜、黏膜下层部分水肿,部分可见炎细胞浸润(图 1C);ERA中剂量组胃黏膜及黏膜下层少量炎症、水肿,腺体排列较齐,部分可见炎细胞浸润(图 1E);ERA高剂量组大鼠胃黏膜、黏膜下层充血水肿轻,腺体排列整齐,有少量炎细胞浸润(图 1F)。
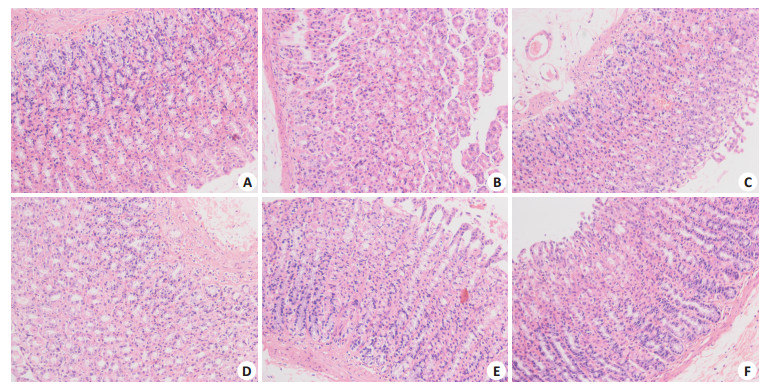
|
图 1 大鼠胃黏膜组织病理学检查 Figure 1 Histopathological examination of the gastric mucosa in different groups (HE staining, original magnification: ×200). A: Normal group; B: Model group; C: Domperidone group; D, E, F: ERA low-, middle-, high-dose group, respectively. |
与模型组比较,正常组、ERA高、中、低剂量组、多潘立酮组大鼠肠道灌流液IgA及血清IgG含量不同程度升高(P < 0.05或P < 0.01);与多潘立酮组比较,ERA高、中剂量组肠道灌流液Ig A及血清IgG含量不同程度升高(P < 0.05或P < 0.01);与ERA低剂量组比较,ERA高、中剂量组肠道灌流液Ig A及血清IgG含量进一步升高(P < 0.05或P < 0.01,表 2)。
| 表 2 ERA对模型大鼠肠道灌流液Ig A及血清IgG含量的影响 Table 2 Effect of Rhizoma atractylodis extract on intestinal lavage fluid IgA and serum IgG levels in the model rats (Mean±SD, n=10) |
与模型组比较,正常组、ERA高、中、低剂量组、多潘立酮组大鼠胸腺和脾脏指数水平不同程度升高(P < 0.05或P < 0.01);与多潘立酮组比较,ERA高、中剂量组胸腺和脾脏指数水平不同程度升高(P < 0.05或P < 0.01);与ERA低剂量组比较,ERA高、中剂量组胸腺和脾脏指数水平进一步升高(P < 0.05或P < 0.01,表 3)。
| 表 3 ERA对模型大鼠胸腺和脾脏指数水平的影响 Table 3 Effect of Rhizoma atractylodis extract on thymus and spleen indices (Mean±SD, n=10) |
TFF1主要表达在胃黏膜腺体细胞胞浆中,颜色呈棕黄色,与模型组比较,正常组、ERA高、中、低剂量组、多潘立酮组大鼠胃黏膜腺体细胞胞浆中TFF1的表达量不同程度升高(P < 0.05或P < 0.01);与多潘立酮组比较,ERA高剂量组大鼠胃黏膜腺体细胞胞浆中TFF1的表达量明显升高(P < 0.05);与ERA低剂量组比较,ERA高、中剂量组大鼠胃黏膜腺体细胞胞浆中TFF1的表达量进一步升高(P < 0.05或P < 0.01);大鼠结肠中TLR4阳性物质表达均呈棕黄、褐色分布。与模型组比较,正常组、ERA高、中、低剂量组、多潘立酮组大鼠结肠组织中TLR4表达量不同程度升高(P < 0.05或P < 0.01);与多潘立酮组比较,ERA高、中剂量组大鼠结肠组织中TLR4表达量不同程度升高(P < 0.05或P < 0.01);与ERA低剂量组比较,ERA高、中剂量组大鼠结肠组织中TLR4表达量进一步升高(P < 0.05或P < 0.01,图 2、3和表 4)。
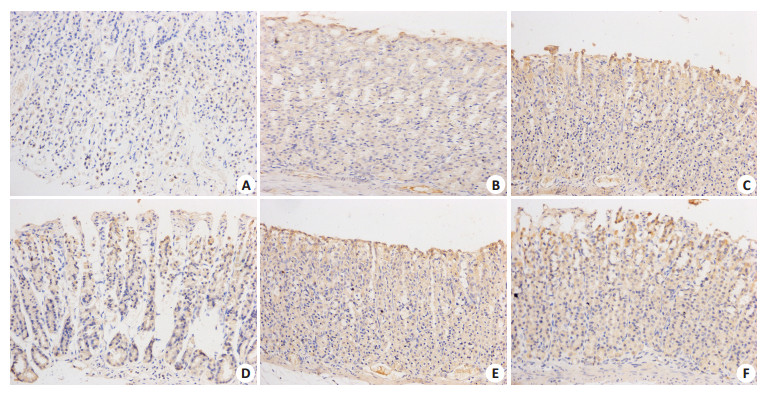
|
图 2 大鼠胃黏膜组织中TFF1免疫组化检查 Figure 2 TFF1 immunohistochemical examination of gastric mucosa tissues in different groups rats (Original magnification: × 200). A: Normal group; B: Model group; C: Domperidone group; D, E, F: ERA low-, middle-, high-dose group, respectively. |
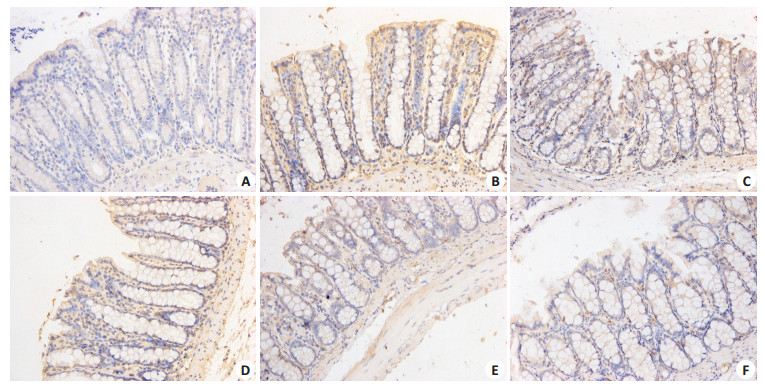
|
图 3 大鼠结肠组织中TLR4免疫组化检查 Figure 3 TLR4 immunohistochemical examination of colon tissues in different groups rats (Original magnification: × 200). A: Normal group; B: Model group; C: Domperidone group; D, E, F: ERA low-, middle-, high-dose group, respectively. |
| 表 4 ERA对模型大鼠胃黏膜组织中TFF1、结肠组织中TLR4表达量的影响 Table 4 Effect of Rhizoma atractylodis extract on TFF1 expression in the gastric mucosa tissue and TLR4 expression in the colon tissues of the model rats (Mean±SD, n=10) |
中医脾虚证主要表现为倦怠乏力,少气懒言,腹胀纳呆,面色萎黄,大便溏薄,消瘦,舌淡苔白,脉缓弱,大部分慢性疾病后期都会表现出上述脾虚证的某些证候[9],因此,目前对脾虚证的研究已成为中医研究的热点。近年来较普遍采用的脾虚证造模方法是在大黄苦寒泻下基础上改进的破气苦降加饥饱失常法[10],该法简单易行。实验中也观察到,大鼠造模的第2周,即出现明显的毛发枯乱不泽,活动减少,眯眼拱背,纳少便溏,体质量减轻等症,停止造模后1周仍未见明显恢复,上述症状与中医脾虚证表现极为类似。另外,体温、体质量、尿D-木糖排泄率也是反映脾虚证的重要指标[11]。本实验中,模型大鼠体温、体质量、尿D-木糖排泄率较正常大鼠显著降低,说明模型大鼠整体机能和小肠吸收功能都明显降低了,这与脾虚证的特征也相吻合。
正常情况下,胃黏膜损伤可自我修复。若脾气不足,可致胃黏膜血流瘀滞,相关细胞因子如TFF1的缺失,致使胃黏膜防御机能低下,最终导致胃粘膜损害[12]。本实验中,脾虚证大鼠胃粘膜血流及TFF1的表达均明显减少,从而使胃黏膜出现了实质性的损伤,而实验结果表明ERA能明显提高脾虚证大鼠胃黏膜血流量及TFF1的表达。中医认为,脾为后天之本,气血生化之源,而气主防御与胃肠道黏膜的免疫功能尤其是小肠免疫存在某种内在联系。lgG和IgA是胃肠粘膜执行免疫功能的重要分子[13]。实验中ERA治疗组大鼠血清IgG及肠道灌流液IgA含量较模型组升高明显,说明ERA对胃肠局部粘膜和机体整体的体液免疫都有很好的促进作用。另外,胸腺和脾脏对机体正常免疫功能的维持也发挥了极为重要的作用[14]。对胸腺脾脏指数进行检测,可反映ERA干预下脾虚模型大鼠机体免疫功能恢复的状况。实验结果显示,经ERA治疗后的脾虚证大鼠的胸腺、脾指数明显升高,说明ERA能有效促进脾虚证大鼠免疫系统的修复。TLR4作为一种多肽分子,与肠道黏膜天然免疫功能关系非常密切[15]。实验结果表明,脾虚证能明显抑制TLR4在小肠黏膜的表达,从而降低脾虚大鼠肠道局部天然免疫功能,而ERA可提高脾虚大鼠肠道粘膜细胞TLR4的表达,从而提高肠道的局部天然免疫能力,进而有利于胃肠道组织结构及功能的康复。
| [1] | 易受乡, 彭艳, 彭芬, 等. 艾灸对脾虚大鼠小肠上皮线粒体超微结构及呼吸链酶含量的影响[J]. 世界华人消化杂志,2011, 19 (29) : 3028-34. |
| [2] | 王丹凤, 刘玉强, 才谦. 苍术麸炒前后健脾作用研究[J]. 时珍国医国药,2013, 24 (1) : 155-6. |
| [3] | 付梅红, 朱东海, 方婧, 等. 苍术的化学、分子生药学和药理学研究进展[J]. 中国中药杂志,2009, 34 (20) : 2669-72. |
| [4] | 张金龙, 秦昆明, 徐自升, 等. 南北苍术炮制前后特征图谱及苍术素含量研究[J]. 科学技术与工程,2011, 11 (20) : 4843-7. |
| [5] | 曾益宏, 刘友章, 徐升. 益气健脾法对脾虚证大鼠红细胞膜ATPase活性的影响[J]. 四川中医,2011, 29 (2) : 24-6. |
| [6] | Harleen G, Tom HK, Helene V, et al. Measurement of specific IgA in faecal extracts and intestinal lavage fluid for monitoring of mucosal immune responses[J]. J Immunol Methods,2000, 239 (1) : 53-62. |
| [7] | Müller M, Kwapisz M, Klemm S, et al. Effects of intraoperative angiotensin-converting enzyme inhibition by quinaprilat on gastric mucosal blood flow during cardiopulmonary bypass in humans[J]. Appl Cardiopulm Pathophysiol,2010, 14 (1) : 43-5. |
| [8] | Lu YM, Zhang H. Effects of electroacupuncture on T-lymphocytes, spleen index, thymus index and lymphopoiesis levels in strenuous exercise-induced stress rats[J]. Zhen Ci Yan Jiu,2012, 37 (2) : 136-9. |
| [9] | 施旭光, 黄曼婷, 邓淙友, 等. 补中益气汤及其配伍对脾虚大鼠胃黏膜保护作用机制研究[J]. 现代中医药,2013, 33 (5) : 114-7. |
| [10] | 李聪, 谢鸣, 赵荣华. 柴疏四君汤对肝郁-脾虚-肝郁脾虚不同证候模型大鼠消化系统功能的影响[J]. 中华中医药杂志,2014, 29 (1) : 72-5. |
| [11] | 徐冬英, 陈卫卫, 李爱嫒, 等. 生三七对利血平致小鼠脾虚模型的影响[J]. 中药材,2005, 28 (9) : 71-3. |
| [12] | 刘娜, 江伟. 溃疡方对乙酸胃溃疡大鼠钻膜TFFI, EGF和EGFR的影响[J]. 河南中医,2013, 33 (10) : 1649-51. |
| [13] | 熊斌, 钱会南. 中医脾虚证与免疫功能关系研究进展[J]. 湖北中医杂志,2013, 35 (6) : 76-8. |
| [14] | Hwang SE, Kim JH, Yu HC, et al. Lymphocyte subpopulations in the liver, spleen, intestines, and mesenteric nodes: an immunohistochemical study using human fetuses at 15-16 weeks[J]. Anat Record-Adv Integ Anat Evolut Biol,2014, 297 (8) : 1478-89. DOI: 10.1002/ar.v297.8. |
| [15] | 杨钦河, 黄进, 张玉佩, 等. 疏肝健脾方药对NASH大鼠肝组织TLR4mRNA及其蛋白表达的影响[J]. 中药材,2013, 36 (1) : 78-84. |
 2016, Vol. 35
2016, Vol. 35
