干扰素α(interferon-α, IFN-α)是一种多功能的细胞因子,现已成为临床上抗病毒和抗肿瘤治疗最常用的生物药物[1-2]。IFN-α抗病毒、抗肿瘤的作用机理主要有两方面:一是诱导产生黏病毒抵抗蛋白A (MxA),2', 5'-寡腺苷酸合成酶(2', 5'-OAS)等抗病毒蛋白(AVP) [3];二是免疫调理作用。IFN-α可直接作用于T淋巴细胞,促进辅助淋巴细胞(Th)、NK细胞和树突状细胞(DC)的增殖和分化,刺激Th1类细胞因子IL-2和IFN-γ等的分泌,进而提高抗原递呈能力及机体的细胞免疫水平[4-5]。
传统的重组IFN-α通常采用基因工程生产,离不开重组蛋白的分离纯化工序,并且只能注射途径给药,存在生产成本高、用药不便的问题。有研究显示,低剂量口服IFN-α能获得较好的局部抗流感病毒感染和全身的抗病毒疗效,且毒副作用远低于注射途径给药[6-7]。近几年出现了IFN-α的喷雾剂、口含片、栓剂等新剂型,方便用药。但IFN-α口服给药是否能促进T细胞分化成熟有待进一步研究。而且喷雾剂、口含片,以及长效缓释剂等新剂型的制备依然少不了重组蛋白的分离纯化工序,价格依然昂贵,适用范围有限。因此,有必要进一步探索重组IFN-α表达和用药的新途径。
双歧杆菌是哺乳动物体内的主要益生菌群之一,具有改善肠道微生态环境、抑制致病菌生长、促进营养吸收等多方面作用[8]。双歧杆菌活菌制剂已广泛应用于肠道疾病防治。双歧杆菌有望成为基因治疗、功能蛋白表达和口服疫苗等生物治疗手段的理想宿主菌[9-10]。
本文,我们利用双歧杆菌表达重组人IFN-α,分析IFN-α基因转化双歧杆菌口服后对小鼠免疫系统的影响,探索肽类药物表达和给药的新途径。
1 材料与方法 1.1 材料 1.1.1 载体及双歧菌种大肠杆菌-双歧杆菌穿梭表达载体pBADX-s由我室构建并保存。长型双歧杆菌NCC2705来源于Nestle Research Center, France。根据双歧杆菌密码子的偏性,化学合成hIFN-α2b基因,插入到穿梭载体pBADX-s的分泌性信号肽下游BpiⅠ和XbaⅠ克隆位点,与信号肽构成融合蛋白。筛选获得重组表达载体pBADX-hIFN-α2b。
1.1.2 实验动物BALB/c小鼠,雄性,6~8周龄,24只,体质量20 g左右,SPF级,购于南方医科大学实验动物中心,合格证号SCXK粤2008-0002,24-26℃,普通饲料饮食,12 h昼/夜光照。
1.1.3 主要试剂与仪器hIFN-α2b ELISA检测试剂盒和EZ-Sep淋巴细胞分离液(达科为生物技术有限公司),PE-AntiCD3、APC-AntiCD4、FITC-AntiCD8 (Molecular Probes, Invitrogen, 美国),小鼠Th1/Th2可溶性细胞因子(IFN-γ、IL-4)流式检测试剂盒(Bender Medsystems, 奥地利),FACSCalibur流式细胞仪(美国BD公司),Flowcytomix Pro Soteware2.4检测软件(由奥地利Bender Medsystems提供),Hyclone培养基(Thermo, 美国),电转化仪(bio-rad, 美国)。hIFN-α2b单克隆抗体(上海雅吉生物)。
1.1.4 其他生化试剂均为国产分析纯。
1.2 方法 1.2.1 电转化及hIFN-α基因转化双歧杆菌的筛选鉴定常规法制备双歧杆菌感受态细胞,分别取1~5 μg空载体和重组质粒pBADX-IFN-α2b与感受态双歧杆菌混合进行电转化。转化条件为电压2.5 kV,电阻200 Ω,电容25 μF。转化后的双歧杆菌涂于含60 μg/ml氨苄青霉素的MRS选择培养平板,37 ℃厌氧培养48 h。挑选乳白色、圆形的菌落接种到液体培养基中扩大培养。采用革兰氏染色和PCR方法鉴定基因转化双歧杆菌[11]。PCR上下游引物分别设计在目的基因及下游载体上,扩增片段长度约520 bp。
1.2.2 hIFN-α2b在双歧杆菌中的表达取转化双歧杆菌接种到含60 μg/ml氨苄青霉素的MRS中,37 ℃厌氧培养至D值为0.2~0.4,用终浓度为0.2%的L-阿拉伯糖诱导表达,于0、12、24、36 h收集菌体及培养上清,用TES [10 mmolTris-HCI,30 mg/ml溶菌酶,pH=8.0]缓冲液重悬菌体,冰浴中超声粉碎。细菌与上清保存于-70 ℃备用。
1.2.3 Western blotting检测hIFN-α2b的表达分别取收集的上清和经过超声粉碎的菌体50 μl,加入等体积的2×蛋白上样缓冲液,煮沸10 min变性,10 000 r/min离心20 min,取30 μl上清上样,15% SDS聚丙烯酰胺凝胶(SDS-PAGE)电泳。用兔抗hIFN-α2b抗体检测hIFN-α2b,化学发光法显示。
1.2.4 ELISA检测hIFN-α2b的含量培养上清和血清IFN-α含量测定样本不需要处理,直接用样品稀释液稀释后加入到微孔板中。肠内容物样品先按100 μl/mg的量用磷酸缓冲液(PBS)悬浮,1000 r/min离心10 min取上清上样。操作步骤严格按试剂盒说明书进行。
1.2.5 动物实验体外扩大培养空载体和IFN-α转化双歧杆菌,用0.2% L-阿拉伯糖诱导表达24 h,收集双歧杆菌,用0.9%生理盐水重悬菌体制备成活菌悬液,调整浓度至1010/ml。24只小鼠随机分成3组,每组8只。实验(IFN)组用IFN-α转化双歧杆菌活菌灌胃,每次灌0.1 ml,隔天1次。阴性对照(NC)组用等体积等量的空载体pBADX-s转化双歧杆菌活菌灌胃。空白对照(BC)组用等体积0.9%生理盐水灌胃。3周后处死小鼠,取外周血、肠内容物,分离胸腺、脾脏组织单个核细胞。
1.2.6 流式细胞仪检测单个核细胞亚群在每份单个核细胞悬液中先加入Fc抗体室温孵育3 m封闭Fc受体,然后加入FITC-AntiCD3、APC-AntiCD4和PE-AntiCD8三种抗体,室温避光孵育30 min,1000 r/min离心5 m,用0.5 ml磷酸缓冲液(PBS)重悬,上机检测。
1.2.7 流式细胞仪检测血清IFN-γ、IL-4的浓度血清中IFN-γ、IL-12、IL-4等细胞因子用流式检测试剂盒检测,样品处理和浓度换算严格按试剂盒说明书及对应的Pro Soteware2.4软件操作说明进行。
1.2.8 统计学分析利用SPSS 13.0统计软件进行统计处理,数据以均数±标准差表示,多样本之间采用单因素ANOVA进行比较,P < 0.05为差异有统计学意义。
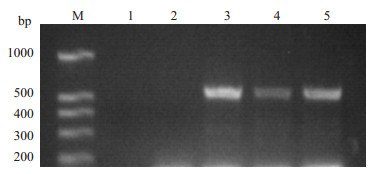
2 结果 2.1 革兰氏染色及PCR鉴定转染前后双歧杆菌革兰氏染色阳性,形态上呈现典型的长型双歧杆菌长杆、分枝的特征(图略)。PCR鉴定结果如图 1。几个转化菌落中,在500 bp多一点位置有一条清晰特异的条带,与目的扩增片段长度520 bp一致。
|
图 1 hIFN-α2b转化双歧杆菌PCR鉴定,琼脂糖凝胶(1.8%)电泳图 Figure 1 Electrophoresis of the PCR products from hIFN-α 2b-transformed Bifidobacterium (1.8% agrose gel). M: DNA marker; Lane 1: Blank control; Lane 2: Negative control (empty vector transformed Bifidobacterium); Lanes 3-5: hIFN-α2b-transformed Bifidobacterium. |
Western blotting结果显示,在L-阿拉伯糖诱导前,菌体中几乎检测不到重组hIFN-α2b的表达。经L-阿拉伯糖诱导,可以检测到hIFN-α2b表达,目的条带的分子大小与成熟IFN-α2b 22 000的理论相对分子质量一致(图 2)。此外,在诱导后12 h有重组hIFN-α 2b表达,诱导后24 h表达量最高,此后表达量下降。

|
图 2 Western blot检测hIFN-α2b在双杆菌中的表达 Figure 2 Expression of hIFN-α2b in transformed Bifidobacterium detected by Western blotting. Lane1-4: hIFN-α2b-transformed Bifidobacterium with 0.2% L-arabinose induction for 0, 12, 24, and 36 h, respectively; Lane 5: Empty vector pBADX-transformed Bifidobacterium with 0.2% L-arabinose induction for 24 h; Lane 6: Untransformed Bifidobacterium with 0.2% L-arabinose induction for 24 h. |
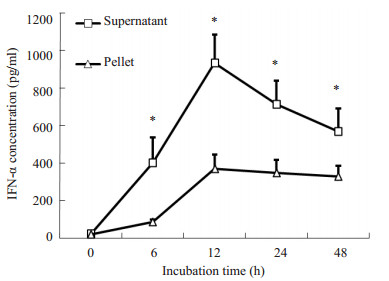
IFN-α转化双歧杆菌经L-阿拉伯糖诱导后,在培养上清和菌体中均可检测到hIFN-α2b表达。在诱导后6~48 h,培养上清的表达量高于菌体。在诱导后24 h时,IhIFN-α2b的分泌达到最大值(图 3)。培养上清表达量较高,重组hIFN-α2b蛋白主要以分泌形式表达。说明表达载体中的信号肽能有效地引导IhIFN-α2b表达并分泌到培养上清中。
|
图 3 hIFN-α2b转化双歧杆菌菌体及培养上清中IFN-α的浓度 Figure 3 Concentration of IFN-α in pellets and supernatant of transformed Bifidobacterium. *P < 0.01. |
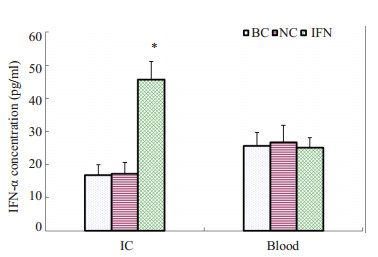
BC、NC和IFN组小鼠肠内容物中hIFN-α2b的浓度分别为(16.78±3.15、17.13±3.56、45.74±5.48) pg/ml。IFN组明显高于BC组和NC组(P < 0.01),而BC组和NC组之间无明显差异。血清中BC组、NC组和IFN组hIFN-α2b的浓度分别为(25.64±4.08、26.67±5.29、25.04±3.05) pg/ml,各组之间均无显著性差异(P>0.05,图 4)。
|
图 4 hIFN-α2b转化双歧杆菌灌胃后小鼠肠内容物(IC)和血液中IFN-α的浓度 Figure 4 Concentration of IFN-α in intestinal contents and blood after hIFN-α2b-transformed Bifidobacterium treatment. *P < 0.01 vs NC or BC. |
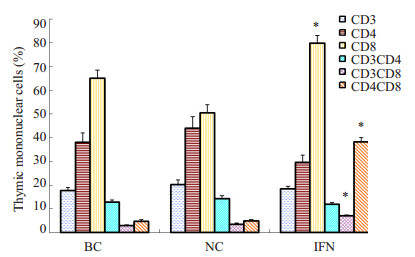
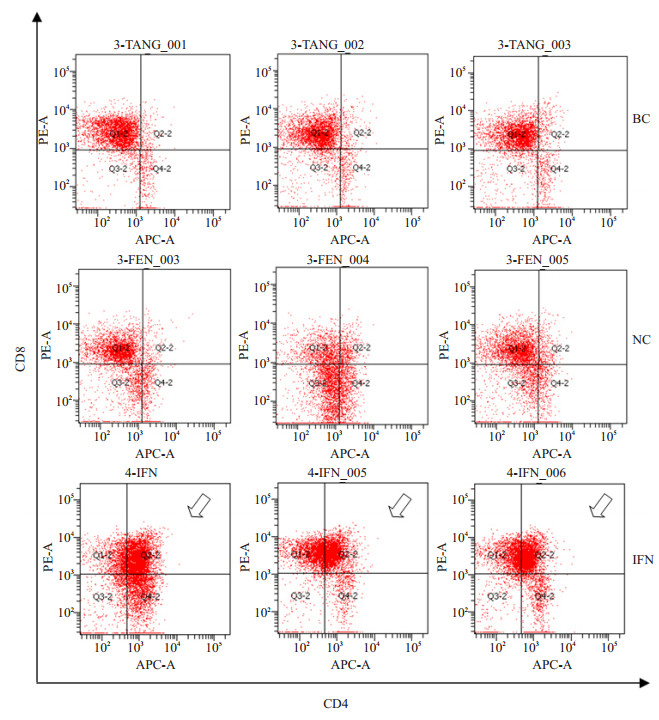
实验组和对照组胸腺淋巴细胞各亚群的百分比如图 5所示。胸腺中CD8+细胞的比例普遍较高,其中IFN组CD8 +细胞比例为79.69%±3.40%,较NC组(50.38%±3.52%)及BC组(65.05%±3.47%)显著增高(P < 0.01);IFN组CD3+CD8+比例为6.96%±0.43%,与NC组(3.40%±0.65%)或BC组(2.93%±0.47%)相比显著增高(P < 0.01);尤其突出的是CD4 + CD8 +细胞比例(8.11%±2.00%),比NC组(4.88%±0.61%)或BC组(4.73%±0.73%)增高非常显著(P < 0.01),IFN组CD4+CD8+细胞比例较BC组和NC组升高了约7.5倍(图 6)。
|
图 5 hIFN-α2b转化双歧杆菌灌胃后小鼠胸腺淋巴细胞亚群比例的变化 Figure 5 Changes in T cell subsets in the thymus after hIFN-α2b-transformed Bifidobacterium treatment. *P < 0.01 vs BC or NC. |
|
图 6 hIFN-α2b转化双歧杆菌灌胃后小鼠胸腺CD4 + CD8 +细胞散点图。箭头所示为CD4+CD8+细胞 Figure 6 Dot plot of CD4 +CD8 + cells (arrows) in the thymus after hIFN-α2b-transformed Bifidobacterium treatment. |
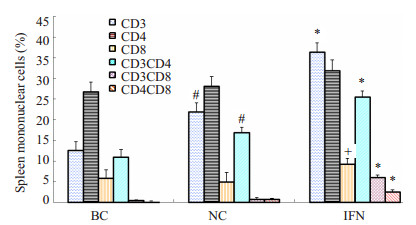
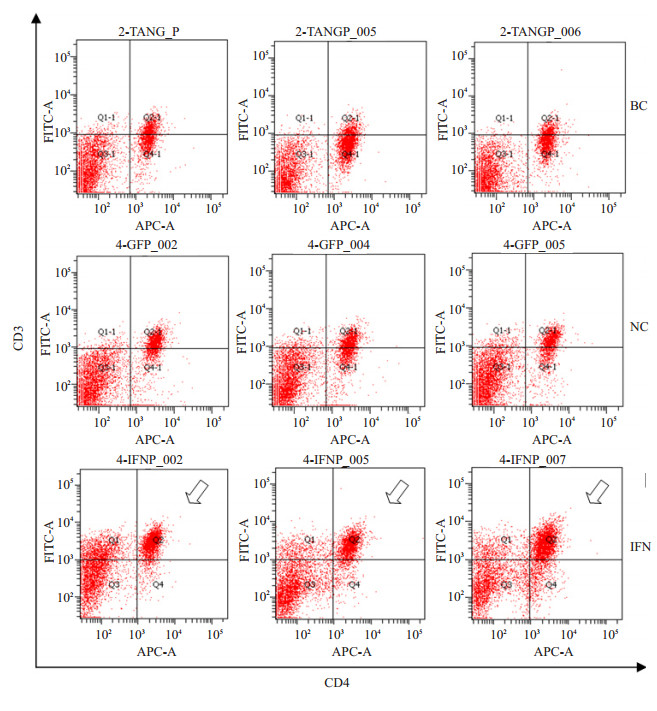
实验组和对照组脾脏淋巴细胞各亚群的百分比如图 7所示。脾脏淋巴细胞亚群的特点是CD3+、CD4+细胞比例较高,CD8+细胞比例较低。IFN组CD3+细胞比例为36.425%±2.17%,与NC组(21.91%±2.22%)和BC组(12.65%±2.04%)相比增高显著(P < 0.01);CD8+细胞(9.21%±1.45%)与NC组(5.03%±2.25%)和BC组(5.86%±1.99%)相比明显增高(P < 0.05);CD3+CD4+细胞(25.49%±1.48%),CD3+CD8+细胞(6.05%±0.31%)也都分别比NC组(16.95%±1.20%;0.7875%±0.31%)和BC组(11.04%±1.77%;0.475%±0.14%)显著增高(P < 0.01);CD4+CD8+细胞也较NC组和BC组显著增高(P < 0.01)或明显升高(P < 0.05,图 8)。
|
图 7 hIFN-α2b转化双歧杆菌灌胃后小鼠脾脏淋巴细胞亚群比例的变化 Figure 7 Changes in T cell subsets in the spleen after hIFN-α 2b-transformed Bifidobacterium treatment. *P < 0.01 vs NC or BC, +P < 0.05, IFN vs NC or BC; #P < 0.01, NC vs BC. |
|
图 8 hIFN-α2b转化双歧杆菌灌胃后小鼠脾脏CD3 + CD4+细胞散点图 Figure 8 Dotplot of CD3 + CD4 + cells (arrows) in the spleen after hIFN-α2b-transformed Bifidobacterium treatment. |
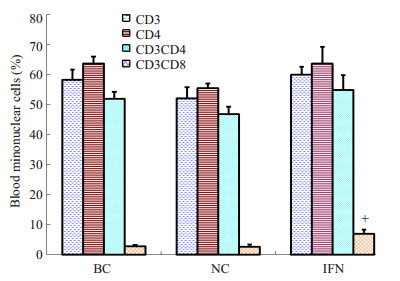
实验组和对照组血液淋巴细胞各亚群的百分比如图 9所示。血液淋巴细胞亚群的特点也是CD3+、CD4+细胞比例较高,CD8+细胞比例非常低。IFN组CD3+CD8+细胞比例为7.00±1.28,比NC组(2.65%±0.68%)和BC组(2.77%±0.42%)明显增高(P < 0.05,图 10)。
|
图 9 hIFN-α2b转化双歧杆菌灌胃后小鼠血液淋巴细胞亚群比例的变化 Figure 9 Changes in T cell subsets proportion of blood after hIFN-α2b-transformed Bifidobacterium treatment. +P < 0.05 (FN vs BC or NC). |
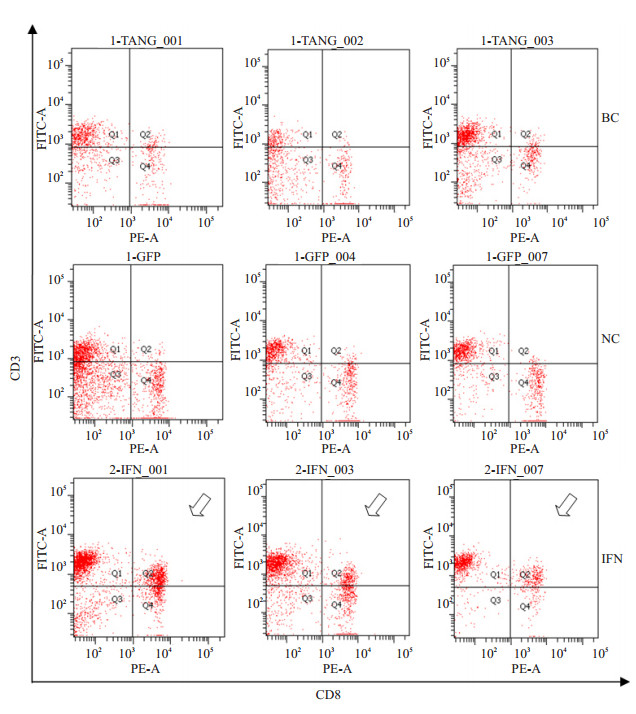
|
图 10 hIFN-α2b转化双歧杆菌灌胃后小鼠血液CD3+CD8+细胞散点图 Figure 10 Dotplot of CD3 + CD8 + cell in blood after hIFN-α2btransformed Bifidobacterium treatment. The arrows indicate the CD3+CD8+ cell area. |
经转化双歧杆菌灌胃处理1周后,各组小鼠血液细胞因子浓度见表 1。与NC组相比,IFN组小鼠的血液中IFN-γ浓度明显升高(P < 0.01),IL-2的浓度也有升高(P < 0.05)。NC组小鼠血液中IFN-γ浓度高于BC组(P < 0.05)。3组之间血液中IL-4和TNF-α浓度无统计学差异(P>0.05)。
| 表 1 转化双歧杆菌灌胃后各组小鼠血液细胞因子的浓度 Table 1 Serum levels of the cytokines in different groups after intragastric treatment with transformed Bifidobacterium |
目前,临床上使用的IFN-α多采用基因工程生产,注射途径给药,存在生产成本高、用药不便、副作用大、易产生中和抗体等缺点。我们通过构建hIFN-α2b双歧杆菌表达载体,电转化获得IFN-α2b转化双歧杆菌,目的是利用双歧杆菌来表达和分泌重组IFN-α,不需要进行重组蛋白的分离纯化,可以直接口服转化双歧杆菌活菌来进行疾病防治。Western blotting和ELISA检测结果表明,转化双歧杆菌能在体外诱导表达重组hIFN-α2b。并且,培养上清重组hIFN-α2b的含量远高于菌体,说明转化双歧杆菌主要以分泌形式表达重组hIFN-α2b。
在用hIFN-α2b转化双歧杆菌活菌给小鼠灌胃3周后,流式细胞仪对实验小鼠胸腺、脾脏和血液淋巴细胞亚型的检测结果显示:hIFN-α2b转化双歧杆菌显著提高了小鼠胸腺CD8+细胞、CD3+CD8+细胞,尤其是CD4+ CD8+细胞比例。IFN组CD4+CD8+细胞比例较BC组和NC组增高了7.5倍。不同T细胞亚群有其特有的表面分子标志,如成熟的T细胞CD3阳性(CD3+);辅助性T细胞(Th) CD3 +CD4 +;细胞毒性/抑制性T细胞(Tc) CD3+CD8+;调节性T细胞(Treg) CD25+CD4+Foxp3+。T细胞来源于骨髓的造血干细胞或前T细胞,在胸腺中分化和成熟。前T细胞在皮质区增殖,由CD4-CD8-阴性细胞分化为CD4+CD8+双阳性细胞的过渡型细胞,在髓质形成CD4+CD8-和CD4-CD8+单阴性细胞,然后进入脾脏、淋巴结等外周淋巴器官。胸腺CD4+CD8+和CD3+ CD8+细胞比例增加说明口服表达IFN-α2b的双歧杆菌可以促进T细胞增殖,使T细胞由CD4-CD8-向CD4 + CD8+转化,并进一步向CD3+CD8+成熟Tc细胞分化。
IFN-α2b转化双歧杆菌灌胃3周后,显著提高了小鼠脾脏CD3+细胞比例,CD3+CD4+细胞及CD3+CD8+细胞比例。结果表明口服IFN-α2b转化双歧杆菌能够促进T细胞成熟及分化,提高了脾脏中成熟淋巴细胞(CD3+)、Th (CD3+CD4+)和Tc细胞(CD3+CD8+)比例。此外,IFN组血液中Tc细胞的比例也较NC和BC组显著在增加。上述结果与以往重组IFN-α注射途径给药在动物实验及人体治疗实验的结果基本一致[12-14]。
IFN-α的免疫调节作用是促进Ⅰ类免疫反应,即促进Th1细胞增殖,抑制Th2亚群,刺激白介素2 (IL-2)、IFN-γ等Th1类细胞因子分泌,抑制IL-4、IL-6等Th2类细胞因子分泌[15-17]。IFN-α2b转化双歧杆菌灌胃3周后,小鼠血液中细胞因子含量测定结果显示,IFN组小鼠IFN-γ和IL-2的含量较对照组显著升高。表明口服hIFN-α2b转化双歧杆菌可以促进Th1细胞的增殖和分化,刺激Th1类细胞因子分泌。这与以往重组IFN-α注射途径给药获得的结果也是一致的。
此外,空载体(NC)组小鼠胸腺CD3+、CD4+细胞略有增高,尤其是脾脏CD3+细胞,CD3+CD4+细胞及CD3+ CD8+细胞都增加明显。说明双歧杆菌自身有促进小鼠T细胞增殖和分化、增强Th1途径介导的细胞免疫的部分作用。这与以往有关双歧杆菌有提高机体免疫力的报道是一致的[18-19]。
有研究显示,完整的小分子多肽通过肠上皮吸收进入血液循环发挥全身作用。吃菠萝后,可在人体血液中检测到有活性的菠萝蛋白酶[20]。与霍乱毒素融合的绿色荧光蛋白(GFP)可利用受体介导的内吞作用通过肠粘膜进入血液循环[21]。肠上皮有IFN受体,我们推测肠道内双歧杆菌表达的hIFN-α2b可能通过肠上皮细胞吸收进入血液循环而发挥促进T淋巴细胞增殖和成熟作用。IFN-α2b转化双歧杆菌活菌灌胃后,我们分别检测了肠道内容物和血液中IFN-α含量。肠道内容物IFN-α含量显著升高,但血液中IFN-α含量升高并不明显,不完全符合我们的推论。其原因可能与hIFN-α2b通过肠道吸收的含量太少,并且容易降解有关。
综上所述,口服hIFN-α2b转化双歧杆菌活菌可以有效促进了T淋巴细胞的增殖和成熟,增强Th1途径的细胞免疫,但其分子作用机制有待进一步探讨。以双歧杆菌为载体的IFN-α表达及肠道内给药方法不需要重组蛋白分离和纯化工序,用药方便,有望成为一种新的肽类药物生产和给药途径。
| [1] | Goodbourn S, Didcock L, Randall RE. Interferons: cell signalling, immune modulation, antiviral response and virus countermeasures[J]. J Gen Virol,2000, 81 (Pt 10) : 2341-64. |
| [2] | Perrillo R. Benefits and risks of interferon therapy for hepatitis B[J]. Hepatology,2009, 49 (5 Suppl) : S103-11. |
| [3] | Petry H, Cashion L, Szymanski P, et al. Mx1 and IP-10: biomarkers to measure IFN-beta activity in mice following gene-based delivery[J]. J Interferon Cytokine Res,2006, 26 (10) : 699-705. DOI: 10.1089/jir.2006.26.699. |
| [4] | Hervas-Stubbs S, Perez-Gracia JL, Rouzaut A, et al. Direct effects of type I interferons on cells of the immune system[J]. Clin Cancer Res,2011, 17 (9) : 2619-27. DOI: 10.1158/1078-0432.CCR-10-1114. |
| [5] | Tough DF. Modulation of T-cell function by type I interferon[J]. Immunol Cell Biol,2012, 90 : 492-7. DOI: 10.1038/icb.2012.7. |
| [6] | Bennett AL, Smith DW, Cummins MJ, et al. Low-dose oral interferon alpha as prophylaxis against viral respiratory illness: a double-blind, parallel controlled trial during an influenza pandemic year[J]. Influenza Other Respir Viruses,2013, 7 (5) : 854-62. DOI: 10.1111/irv.12094. |
| [7] | Lee CM, Chen CY, Chien RN, et al. A double-blind randomized controlled study to evaluate the efficacy of low-dose oral interferon-alpha in preventing hepatitis C relapse[J]. J Interferon Cytokine Res,2014, 34 (3) : 187-94. DOI: 10.1089/jir.2013.0074. |
| [8] | Minocha A. Probiotics for preventive health[J]. Nutr Clin Pract,2009, 24 (2) : 227-41. DOI: 10.1177/0884533608331177. |
| [9] | Yao J, Wang JY, Lai MG, et al. Treatment of mice with dextran sulfate sodium-induced colitis with human interleukin 10 secreted by transformedBifidobacterium longum[J]. Mol Pharm,2011, 8 (2) : 488-97. DOI: 10.1021/mp100331r. |
| [10] | Shao C, Tian G, Huang Y, et al. Thymosin alpha-1-transformed Bifidobacterium promotes T cell proliferation and maturation in mice by oral administration[J]. Int Immunopharmacol,2013, 15 (3) : 646-53. DOI: 10.1016/j.intimp.2012.12.031. |
| [11] | Deng Q, Zeng W, Yu Z. Signal peptide of Arabinosidase enhances secretion of interferon-alpha 2b protein by Bifidobacteria longum[J]. Arch Microbiol,2009, 91 (9) : 681-6. |
| [12] | Kolumam GA, Thomas S, Thompson LJ, et al. Type I interferons act directly on CD8 T cells to allow clonal expansion and memory formation in response to viral infection[J]. J Exp Med,2005, 202 (5) : 637-50. DOI: 10.1084/jem.20050821. |
| [13] | Monteleone G, Pender SLF, Alstead E, et al. Role of interferon-α in promoting T helper cell type 1 responses in the small intestine in coeliac disease[J]. Gut,2001, 48 : 425-9. DOI: 10.1136/gut.48.3.425. |
| [14] | Manion M, Rodriguez B, Medvik K, et al. Interferon-Alpha administration enhances CD8+T cell activation in HIV infection[J]. PLoS One,2012, 7 (1) : e30306. DOI: 10.1371/journal.pone.0030306. |
| [15] | Atan Ö, Aksu G, Özgenç F, et al. Determination of intracellular Th1/ Th2 type cytokines in lymphocytes of chronic hepatitis B patients treated withinterferon-alpha[J]. Turk J Gastroenterol,2010, 21 (4) : 401-10. DOI: 10.4318/tjg.2010. |
| [16] | Nguyen KB, Salazar-Mather TP, Dalod MY, et al. Coordinated and distinct roles for IFN-alpha beta, IL-12, and IL-15 regulation of NK cell responses to viral infection[J]. J Immunol,2002, 169 (8) : 4279-87. DOI: 10.4049/jimmunol.169.8.4279. |
| [17] | Eriksen KW, Sommer VH, Woetmann A, et al. Bi-phasic effect of interferon (IFN)-alpha: IFN-alpha up-and down-regulates interleukin-4 signaling in human T cells[J]. J Biol Chem,2004, 279 (1) : 169-76. DOI: 10.1074/jbc.M310472200. |
| [18] | Turroni F, Taverniti V, Ruas-Madiedo P, et al. Bifidobacterium bifidum PRL2010 modulates the host innate immune response[J]. Appl Environ Microbiol,2014, 80 (2) : 730-40. DOI: 10.1128/AEM.03313-13. |
| [19] | Martins AK, Martins FS, Gomes DA, et al. Evaluation of in vitro antagonism and of in vivo immune modulation and protection against pathogenic experimental challenge of two probiotic strains of Bifidobacterium animalis var, lactis[J]. Arch Microbiol,2010, 192 (12) : 995-1003. DOI: 10.1007/s00203-010-0626-0. |
| [20] | Castell JV, Friedrich G, Kuhn CS, et al. Intestinal absorption of undegraded proteins in men: Presence of bromelain in plasma after oral intake[J]. Am J Physiol Gastrointest Liver Physiol,1997, 273 (1) : G139-46. |
| [21] | Limaye A, Koya V, Samsam M, Daniell H. Receptor-mediated oral delivery of a bioencapsulated green fluorescent protein expressed in transgenic chloroplasts into the mouse circulatory system[J]. FASEB J,2006, 20 : 959-61. DOI: 10.1096/fj.05-5134fje. |
 2016, Vol. 35
2016, Vol. 35
