胰岛素抵抗(insulin resistance, IR)是指胰岛素作用的靶器官对外源性或内源性胰岛素作用的敏感性降低,为维持正常血糖,机体代偿性地增加胰岛素分泌,引起高胰岛素血症。IR是多种疾病,如代谢综合征、心血管疾病、慢性肾脏疾病、多囊卵巢综合症以及多种恶性肿瘤的共同危险因素。近年来越来越多的流行病学及基础研究也提示IR与肺动脉高压(pulmonary arterial hypertension, PAH)的发生发展密切相关[1-4]。本文就IR与PAH的关系及相关机制做以下综述。
1 IRIR状态下,胰岛素抑制肝脏葡萄糖生成及促进外周葡萄糖清除的能力受损,胰岛β细胞代偿性超量分泌胰岛素以克服IR和高血糖水平,由此产生的高胰岛素血症是IR的重要标志。IR的发生与胰岛素受体、受体前和受体后信号转导异常有关。此外,衰老、缺乏锻炼、肥胖等也会导致IR的发生。IR不仅是多种病理生理状态及疾病,如糖耐量异常、脂代谢紊乱、肥胖(尤其是中心性肥胖)、高血压等的共同基础,也是2型糖尿病发的关键因素[5]。
2 PAHPAH是肺高压的一种重要类型,是由不同病因引起的一种常见临床综合征。临床常见的PAH包括特发性PAH、家族性PAH、相关因素引起的PAH(如结缔组织病、HIV感染、药物或毒素、先天性心脏病等)以及肺栓塞相关的PAH。虽然各种类型的PAH其初始发病原因不同,但均有着共同的发病机制,包括:(1)肺血管紧张性增高,这与缩血管物质如内皮素-1(endothelin-1, ET-1)产生过多,细胞内Ca2+浓度增加,以及扩血管物质如NO产生减少相关;(2)肺血管重塑,主要包括肺血管结构细胞如血管内皮细胞(endothelial cells, ECs)、平滑肌细胞(smooth muscle cells, SMCs)、成纤维细胞的异常增殖和迁移,以及细胞外间质的异常聚集;(3)原位血栓形成,肺血管内皮功能受损导致血小板的黏附聚集,引起原位微血栓形成。上述病理变化的最终结果是导致肺血管功能及结构异常,肺血管阻力增加,引起肺动脉压力升高[6]。
3 IR与PAH近来的基础研究及流行病学调查发现IR与PAH关系密切,可能是PAH发生发展的一个重要危险因素。Hansmann等[1]首先在动物模型上发现IR与PAH相关。研究者选取载脂蛋白E(apolipoproteinE, apoE)基因缺陷apoE -/-小鼠为研究对象,在高脂饮食喂养后,小鼠出现IR和PAH,而给予胰岛素增敏剂罗格列酮处理,小鼠对胰岛素的敏感性提高,PAH及右心室的肥厚也得到完全逆转。West等[3]在骨形态生成蛋白2型受体(bone morphogenetic protein receptor-2, BMPR-2)基因诱导突变小鼠模型上发现,小鼠在诱导早期即表现出IR,进一步喂养高脂饮食后,小鼠IR程度加重,并出现PAH。另有动物实验表明肥胖的IR大鼠肺动脉对血管收缩剂的反应性降低,导致大鼠肺动脉的收缩舒张障碍[4]。流行病学的资料也显示PAH患者较正常人更易合并IR(45.7% vs 21.5%),IR可能是PAH进展和恶化的危险因素[2]。在非糖尿病的PAH患者中也可见到56%的被研究者存在糖耐量异常(HbA1c≥6.0%),且这些患者往往合并严重的右心衰竭和较差的活动耐量[7]。
4 IR与PAH相关的机制 4.1 高胰岛素血症与PAH 4.1.1 胰岛素信号通路的异常胰岛素的生物学效应与其作为一种配体与胰岛素受体结合,通过一系列信号级联反应而发挥生理或病理作用相关。胰岛素与其受体结合后主要通过以下两条信号通路发挥作用:(1)引起胰岛素受体底物(insulin receptor substrates, IRS)磷酸化,激活磷脂酸肌醇-3激酶/丝氨酸-苏氨酸蛋白激酶(phosphatidylinositol 3-kinase/serine-threonine protein kinase B, PI3K/Akt)信号通路,介导细胞多种代谢效应以及细胞生长和蛋白翻译;(2)激活Shc蛋白,活化有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路,参与细胞有丝分裂、增殖等。正常情况下,胰岛素通过上述信号通路直接刺激血管ECs合成NO和ET-1,维持血管功能,并参与细胞的正常生长(图 1)。在IR状态下,高浓度胰岛素使IRS的第307位丝氨酸(负性调控位点)发生磷酸化,选择性地使IRS/PI3K/Akt通路活性减低,磷酸化的内皮型一氧化氮合酶(eNOS)减少,NO合成降低,致血管紧张性增高[8-10]。而MAPK信号通路未受阻或活性增强,致使血管ECs合成和释放ET-1增加,NO/ET-1的比例失平衡,血管的紧张性明显增高[8-9, 11];并促进血管SMCs的异常增殖和迁移,导致血管重塑(图 1)。而且,高浓度胰岛素能明显增加血小板分化生长因子-BB(platelet-derived growth factor-BB, PDGF-BB)及其他生长因子对血管SMCs的促增殖作用,其也是通过MAPK途径实现的[11-12]。
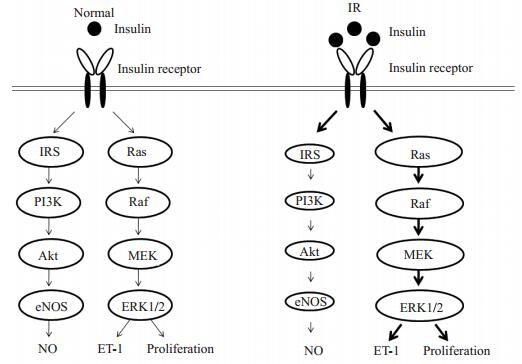
|
图 1 胰岛素作用于血管细胞的信号通路 Figure 1 Insulin signaling pathways in vascular cells. |
胰岛素与胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)具有40%~50%的氨基酸序列同源性,二者具有相似的细胞膜受体,使其相互作用于对方受体发挥生物学效应[13]。早在1989年,Badesch [14]即发现IGF-1具有较强的促肺动脉SMCs(PASMCs)合成胶原纤维的作用。Dempsey[15]进一步发现IGF-1可刺激小牛PASMCs的增殖,且不依赖于蛋白激酶C(protein kinase C, PKC)途径,但PKC的激动剂可增强IGF-1的促增殖效应。Pluteanu [16]发现IGF-1亦可通过激活PI3K/Akt信号通路增加Cav3.1 T-型Ca2+通道的mRNA表达水平,促进细胞外Ca2+内流,启动细胞周期,促进PASMCs的增殖。IGF-1也能通过激活ECs内多个信号通路,如MAPK/ ERKs以及PI3K/Akt,直接或间接地促进κ基因结合核蛋白(nuclear factor-κ-gene binding, NF-κB)的转录,刺激小牛肺动脉ECs(PAECs)的迁移[17]。
4.2 脂代谢紊乱与PAHIR状态下,胰岛素抑制游离脂肪酸(free fatty acids, FFA)释放的作用减弱,导致FFA增多,甘油三酯合成增加以及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)减少。FFA可选择性抑制血管ECs中胰岛素激活的PI3K/Akt信号通路,降低eNOS的表达水平[9]。且FFA及其代谢物可诱导IR恶化,进一步升高血浆FFA水平,加重血管ECs的损伤,形成恶性循环。HDL-C除可刺激胆固醇的反向转运,还具有抗氧化、抗炎和抗凝,减少内皮功能的损伤,增加前列环素半衰期等作用,推测其水平降低可促进PAH的发生。目前的研究亦已证实HDL-C在PAH患者中表达水平明显降低[18-19],但在疾病预后预测方面存在争议。apoE是人体血浆脂蛋白重要组成部分,与肥胖、糖耐量异常及IR形成有关[20]。apoE-/-小鼠在高脂饮食喂养后出现IR和PAH [1]。进一步研究发现apoE通过与低密度脂蛋白受体相关蛋白(low-density lipoprotein receptorrelated protein, LRP)结合,内化并降解LRP-PDGFR-β-PDGF-BB复合体。apoE缺乏时,大量的PDGF-BB信号可激活MAPK通路和诱导生长促进基因的表达,刺激PASMCs的增殖和迁移,导致PAH的发生。而给予重组的apoE可抑制PDGF-BB诱导的PASMCs增殖和生长[21]。apoE为研究IR和PAH相关机制提供另一条重要线索。
4.3 炎症反应与PAHIR及相关的代谢病理变化伴有慢性、低度的炎症反应,多种炎症因子包括白细胞介素-1/6(interleukin-1/ 6,IL-1/6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、C反应蛋白(C-reactive protein, CRP)、巨噬细胞趋化蛋白-1(macrophage chemotactic protein-1, MCP-1)及非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)等表达增加[22]。上述炎症因子亦直接参与到PAH发生发展的全过程[23]。PAH患者体内TNF-α水平明显升高。采用TNF-α拮抗剂可显著降低PAH大鼠模型的平均肺动脉压力,改善肺血流动力学,抑制肺血管重塑和PAH的形成[24]。CRP在PAH患者体内也明显上升,可用于预测疾病的严重程度和治疗反应[25]。CRP可刺激PASMCs产生IL-6和MCP-1,激活NF-κB信号通路,启动细胞增殖过程[26]。IL-1/6水平在PAH患者中亦显著升高,其循环水平与疾病预后有着明显的相关性。IL-1/6可刺激肺血管ECs和SMCs活化,进而导致PAH的发生和右心室肥大[23]。MCP-1由肺血管ECs和SMCs产生。MCP-1缺乏小鼠在慢性缺氧的诱导下可出现肺血管发育异常,最终自发地发展为PAH [27]。ADMA为eNOS的抑制剂,可调控血管内皮功能和NO的释放,直接影响肺动脉压力,其血清水平亦与肺血管疾病的严重程度具有良好的相关性[28]。
4.4 氧化应激与PAH在IR状态下,FFA及血糖的升高可导致线粒体产生大量活性氧簇(reactive oxygen species, ROS),破坏线粒体功能,引起氧化应激反应。氧化应激可阻断胰岛素作用通路,进一步加重IR程度,形成恶性循坏[29]。氧化应激反应与PAH的发生也有着紧密的联系。研究已发现ROS可损伤血管内皮功能,抑制eNOS的活性,导致NO合成或利用度降低,并能促进ET的合成和释放,导致血管紧张性增高[9, 10, 30]。ROS还能通过激活ERK1/ 2诱导血小板和巨噬细胞产生PDGF,以及增强血管紧张素Ⅱ对表皮生长因子的磷酸化等途径,促进PASMCs的增殖和迁移,诱发肺血管重塑[30]。ROS亦可激活基质金属蛋白酶(matrix metallo proteinase, MMP),诱导细胞外基质沉积,导致肺血管细胞外重塑的发生[31]。
4.5 BMP-2/BMPR-2与PAHBMPR-2是一种转换生长因子β超家族成员,其配体为骨形态生成蛋白-2(bone morphogenetic protein-2, BMP-2),该信号通路主要调控胚胎发育、组织稳态及细胞增殖等。已知BMPR-2基因突变出现于70%以上遗传性PAH病例中,是遗传性PAH的主要机制之一。但仅有20%的BMPR-2基因突变携带者最终发展为PAH,遗传或环境因素可形成“第二次打击”,导致疾病的发生[3, 32]。West等[3]研究发现携带BMPR-2基因突变的小鼠,IR可加剧小鼠PAH的表型,说明IR及并发的异常代谢环境可能在BMPR-2突变的基础上,导致PAH的产生和进展。该研究亦指出PAH患者体内的代谢紊乱可能是促使疾病发生的一个重要原因。过去的研究还发现IL-6与BMP构成了一条负反馈环路,即IL-6可促进BMP表达,而BMP水平升高又可抑制IL-6的产生。该环路也进一步提示BMP-2/BMPR-2异常可导致对IL-6等炎症因子抑制作用的减弱,在炎症反应的“第二次打击”下促使PAH的发生发展[33](图 2)。
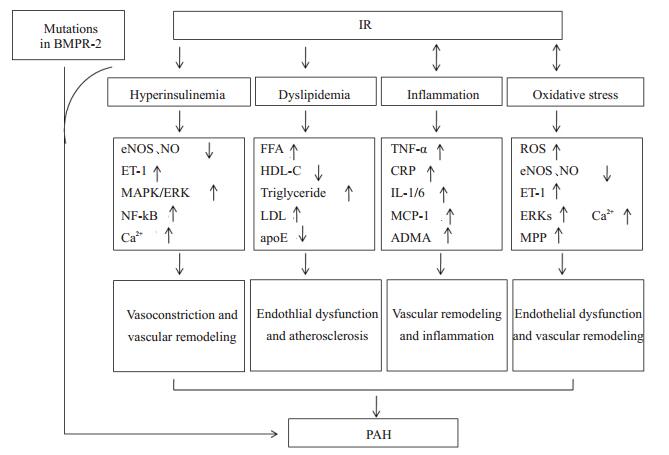
|
图 2 IR与PAH的相关机制 Figure 2 Mechanisms by which IR promotes the development of PAH. |
PAH病因和发病机制复杂,给临床防治带来诸多困难。上述文献回顾提示IR是PAH发生的一个重要危险因素,因此改善IR的多种措施可能也对PAH的治疗有益。已有较多研究表明体育锻炼可改善PAH患者的6分钟步行距离、生活质量评分、氧耗峰、氧脉搏、心率、静息时肺动脉收缩压以及最大负荷量[34]。虽然多种机制参与其中,但IR的改善可能为重要原因之一。噻唑烷二酮类药物为公认的胰岛素增敏剂,通过与过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activat-ed receptor-γ, PPAR-γ)结合,提高胰岛素敏感性。该药物也能通过激活PPAR-γ抑制小鼠PASMCs的增殖,并能抑制循环中某些炎性因子的合成,如IL-1/6、MCP-1、ET-1、ADMA等,具有潜在的治疗PAH作用[1, 5, 21]。他汀类药物可降低IR程度[35],调整血脂紊乱,也可抑制SMCs增殖、诱导其凋亡,改善血管内皮功能,抑制炎症反应,提高心肺血管生理功能,在PAH动物模型和小规模PAH临床试验中已证实其治疗的有效性[26, 36]。
6 小结IR及其伴发的高胰岛素血症、血脂异常、炎症反应及氧化应激可通过多种机制参与PAH的发生、发展。因此,改善IR对预防和治疗PAH具有重要意义。然而,IR与PAH的相关机制尚存在诸多不明之处,进一步明确机制并寻找有效靶点可望有助于降低PAH发生的风险。
| [1] | Hansmann G, Wagner RA, Schellong S, et al. Pulmonary arterial hypertension is linked to insulin resistance and reversed by peroxisome proliferator-activated receptor-gamma activation[J]. Circulation,2007, 115 (10) : 1275-84. |
| [2] | Zamanian RT, Hansmann G, Snook S, et al. Insulin resistance in pulmonary arterial hypertension[J]. Eur Respir J,2009, 33 (2) : 318-24. |
| [3] | West J, Niswender KD, Johnson JA, et al. A potential role for insulin resistance in experimental pulmonary hypertension[J]. Eur Respir J,2013, 41 (4) : 861-71. DOI: 10.1183/09031936.00030312. |
| [4] | Moral-Sanz J, Menendez C, Moreno L, et al. Pulmonary arterial dysfunction in insulin resistant obese Zucker rats[J]. Respir Res,2011, 12 (1) : 1-10. DOI: 10.1186/1465-9921-12-1. |
| [5] | Pugh ME, Hemnes AR. Metabolic and hormonal derangements in pulmonary hypertension: from mouse to man[J]. Int J Clin Pract,2010, 64 (168) : 5-13. |
| [6] | Chan SY, Loscalzo J. Pathogenic mechanisms of pulmonary arterial hypertension[J]. J Mol Cell Cardiol,2008, 44 (1) : 14-30. DOI: 10.1016/j.yjmcc.2007.09.006. |
| [7] | Pugh ME, Robbins IM, Rice TW, et al. Unrecognized glucose intolerance is common in pulmonary arterial hypertension[J]. J Heart Lung Transpl,2011, 30 (8) : 904-11. |
| [8] | Fulton DJ. Mechanisms of vascular insulin resistance a substitute Akt?[J]. Circ Res,2009, 104 (9) : 1035-7. DOI: 10.1161/CIRCRESAHA.109.198028. |
| [9] | Pansuria M, Xi H, Li L, et al. Insulin resistance, metabolic stress, and atherosclerosis[J]. Front Biosci (Schol ED),2012, 4 : 916-31. |
| [10] | Avogaro A, de Kreutzenberg SV, Fadini GP. oxidative stress and vascular disease in diabetes:is the dichotomization of insulin signaling still valid?[J]. Free Radic Biol Med,2008, 44 (6) : 1209-15. DOI: 10.1016/j.freeradbiomed.2007.12.021. |
| [11] | Potenza MA, Addabbo F, Montagnani M. Vascular actions of insulin with implications for endothelial dysfunction[J]. Am J Physiol Endocrinol Metab,2009, 297 (3) : E568-77. DOI: 10.1152/ajpendo.00297.2009. |
| [12] | Wang XK, Yu CQ, Zhang B, et al. The injurious effects of hyperinsulinism on blood vessels[J]. Cell Biochem Biophys,2014, 69 (2) : 213-8. DOI: 10.1007/s12013-013-9810-6. |
| [13] | Slaaby R, Schaffer L, Lautrup-Larsen I, et al. Hybrid receptors formed by insulin receptor (IR) and insulin-like growth factor I receptor (IGF-IR) have low insulin and high IGF-1 affinity irrespective of the IR splice variant[J]. J Biol Chem,2006, 281 (36) : 25869-74. DOI: 10.1074/jbc.M605189200. |
| [14] | Badesch DB, Lee PK, Parks WC, et al. Insulin-like growth factoristimulates elastin synthesis by bovine pulmonary arterial smooth muscle cells[J]. Biochem Biophys Res Commun,1989, 160 (1) : 382-7. DOI: 10.1016/0006-291X(89)91667-7. |
| [15] | Dempsey EC, Stenmark KR, Mcmurtry IF, et al. Insulin-like growth factor-i and protein kinase-c activation stimulate pulmonary-artery smooth-muscle cell-proliferation through separate but synergistic pathways[J]. J Cell Physiol,1990, 144 (1) : 159-65. DOI: 10.1002/(ISSN)1097-4652. |
| [16] | Pluteanu F, Cribbs LL. Regulation and function of Cav3.1 T-type Calcium channels in IGF-I-stimulated pulmonary artery smooth muscle cells[J]. Am J Physiol Cell Physiol,2011, 300 (3) : 517-25. DOI: 10.1152/ajpcell.00107.2010. |
| [17] | Liu W, Liu Y, Lowe Jr WL. The role of phosphatidylinositol 3-kinase and the mitogen-activated protein kinases in insulin-like growth factor-I-mediated effects in vascular endothelial cells 1[J]. Endocrinology,2001, 142 (5) : 1710-9. |
| [18] | Heresi GA, Aytekin M, Newman J, et al. Plasma levels of highDensity lipoprotein cholesterol and outcomes in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med,2010, 182 (5) : 661-8. DOI: 10.1164/rccm.201001-0007OC. |
| [19] | Cracowski JL, Labarère J, Renversez JC, et al. Plasma levels of high-density lipoprotein cholesterol are not associated with survival in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med,2012, 186 (1) : 107. |
| [20] | Gao JH, Katagiri H, Ishigaki Y, et al. Involvement of apolipoprotein E in excess fat accumulation and insulin resistance[J]. Diabetes,2007, 56 (1) : 24-33. DOI: 10.2337/db06-0144. |
| [21] | Hansmann G, De Jesus Perez VA, Alastalo TP, et al. An antiproliferative BMP-2/PPAR gamma/apoE axis in human and murine SMCs and its role in pulmonary hypertension[J]. J Clin Invest,2008, 118 (5) : 1846-57. DOI: 10.1172/JCI32503. |
| [22] | Lazar MA. The humoral side of insulin resistance[J]. Nat Med,2006, 12 (1) : 43-4. DOI: 10.1038/nm0106-43. |
| [23] | Price LC, Wort SJ, Perros F, et al. Inflammation in pulmonary arterial hypertension[J]. Chest,2012, 141 (1) : 210-21. DOI: 10.1378/chest.11-0793. |
| [24] | Wang Q, Zuo XR, Wang YY, et al. Monocrotaline-induced pulmonary arterial hypertension is attenuated by TNF-alpha antagonists via the suppression of TNF-alpha expression and NF-kappa B pathway in rats[J]. Vascul Pharmacol,2013, 58 (1/2) : 71-7. |
| [25] | Quarck R, Nawrot T, Meyns B, et al. C-reactive protein a new predictor of adverse outcome in pulmonary arterial hypertension[J]. J Am Coll Cardiol,2009, 53 (14) : 1211-8. DOI: 10.1016/j.jacc.2008.12.038. |
| [26] | Li J, Li JJ, He JG, et al. Atorvastatin decreases c-reactive proteininduced inflammatory response in pulmonary artery smooth muscle cells by inhibiting nuclear factor-kappab pathway[J]. Cardiovasc Ther,2010, 28 (1) : 8-14. DOI: 10.1111/cdr.2010.28.issue-1. |
| [27] | Yu Y, Mao L, Piantadosi CA, et al. CCR2 deficiency, dysregulation of notch signaling, and spontaneous pulmonary arterial hypertension[J]. Am J Respir Cell Mol Biol,2013, 48 (5) : 647-54. DOI: 10.1165/rcmb.2012-0182OC. |
| [28] | Arrigoni FI, Vallance P, Haworth SG, et al. Metabolism of asymmetric dimethylarginines is regulated in the lung developmentally and with pulmonary hypertension induced by hypobaric hypoxia[J]. Circulation,2003, 107 (8) : 1195-201. DOI: 10.1161/01.CIR.0000051466.00227.13. |
| [29] | Bloch-Damti A, Bashan N. Proposed mechanisms for the induction of insulin resistance by oxidative stress[J]. Antioxid Redox Signal,2005, 7 (11/12) : 1553-67. |
| [30] | Demarco VG, Whaley-Connell AT, Sowers JR, et al. Contribution of oxidative stress to pulmonary arterial hypertension[J]. World J Cardiol,2010, 2 (10) : 316-24. DOI: 10.4330/wjc.v2.i10.316. |
| [31] | Dasgupta J, Kar S, Liu R, et al. Reactive oxygen species contol senescence-associated matrix metallopmteinase-1 through c-Jun-Nteminal kinase[J]. J Cell Physio,2010, 225 (1) : 52-62. DOI: 10.1002/jcp.22193. |
| [32] | Park SH, Chen WC, Hoffman C, et al. Modification of hemodynamic and immune responses to exposure with a weak antigen by the expression of a hypomorphic BMPR2 gene[J]. PLoS One,2013, 8 (1) : e55180. DOI: 10.1371/journal.pone.0055180. |
| [33] | Hagen M, Fagan K, Steudel W, et al. Interaction of interleukin-6 and the bmp pathway in pulmonary smooth muscle[J]. Am J Physiol Lung Cell Mol Physiol,2007, 292 (6) : 1473-9. DOI: 10.1152/ajplung.00197.2006. |
| [34] | Gruenig E, Lichtblau M, Ehlken N, et al. Safety and efficacy of exercise training in various forms of pulmonary hypertension[J]. Eur Respir J,2012, 40 (1) : 84-92. DOI: 10.1183/09031936.00123711. |
| [35] | Madhu V, Aslam M, Galav V, et al. Atorvastatin prevents type 2 diabetes mellitus-An experimental study[J]. Eur J Pharmacol,2014, 728 : 135-40. DOI: 10.1016/j.ejphar.2014.01.069. |
| [36] | Li XL, Guan RJ, Li JJ. Attenuation of monocrotaline-induced pulmonary arterial hypertension in rats by rosuvastatin[J]. J Cardiovasc Pharmacol,2012, 60 (2) : 219-26. DOI: 10.1097/FJC.0b013e31825cce63. |
 2015, Vol. 35
2015, Vol. 35
