肿瘤的发生和发展是个多因素多步骤的过程,而各个因素之间的相互作用是通过不同的信号转导通路来实现的。体内外的各种刺激均会激活细胞内不同的信号转导通路,其中PI3K/AKT/mTOR是与细胞增殖和细胞凋亡关系最密切的信号转导通路之一,也是参与乳腺癌发展的重要信号转导通路[1-2]。而在这条信号转导通路中,mTOR作为一种具有丝/苏氨酸激酶活性的磷脂酰肌醇激酶相关蛋白激酶家族中的一种蛋白,与细胞的生长,细胞周期的调节,细胞的凋亡有密切的关系[3],与蛋白的转录与翻译关系密切[4-5]。在该信号转导通路中起重要调节作用,最终调控细胞周期和细胞凋亡。本研究通过脂质体介导转染pcDNA3.1-mTOR导入人乳腺癌MCF-7细胞中,观察转染后mTOR蛋白,磷酸化AKT,PTEN表达的变化;以及它们对MCF-7细胞生长作用的影响,从而探讨PI3K/AKT/mTOR信号转导通路中,mTOR蛋白的变化对乳腺癌细胞的影响及对该条信号转导通路中AKT和PTEN的负反馈作用。
1 材料与方法 1.1 材料细胞由人乳腺癌细胞株MCF-7购自上海麦莎生物有限公司。质粒与菌株pcDNA3.1-mTOR为本人制备,DH5α由实验室保存。兔抗磷酸化AKT(p-FAK,Ser-473)单克隆抗体、兔抗mTOR多克隆抗体及兔抗mTOR多克隆抗体均为Abcam产品,深圳晶美公司代理。Lipofectamine2000脂质体转染试剂盒购自美国Invitrogen,质粒大提试剂盒为Qiagen产品。
1.2 实验方法 1.2.1 细胞培养乳腺癌细胞在10% FBS(胎牛血清)的培养基中种植,37 ℃,5% CO2饱和湿度培养箱中培养。
1.2.2 脂质体介导转染细胞通过脂质体介导把DNA转染入悬浮或贴壁细胞中。分离稳定转染体:在完全培养基中孵育48~72 h后,用胰酶消化细胞并用合适的选择培养基重铺细胞。每2~4 d更换培养基,持续培养2~3周。
1.2.3 质粒的鉴定和扩增质粒pcDNA3.1 -mTOR及空载质粒转化感受态细胞DH5α,37 ℃培养24 h;挑选阳性克隆,培养90 min提取质粒;限制性内切酶HindⅢ和XbaⅠ,酶切后进行琼脂糖凝胶电泳鉴定;扩增质粒并提取纯化。
1.2.4 mTOR基因过表达的检测PCR检测mTOR的表达。
1.2.5 Western blot(免疫印迹)转染48 h后,收集细胞,提取总蛋白进行电泳,转膜,一抗4 ℃过夜,二抗室温2 h,增强化学发光法(ECL)显影。
1.2.6 细胞生长细胞转染后接种于6孔板培养,隔日换培养基。每种细胞7个孔。每日取1种细胞1孔进行计数,连续观察7 d。绘制细胞生长曲线。
1.2.7 细胞凋亡分析收集转染后48 h的各实验组及对照组细胞,冷磷酸缓冲液洗涤2遍,1 ml 70%冷乙醇固定过夜处理,碘化丙啶(PI)染色,流式细胞仪检测凋亡率和细胞周期。ModFit软件分析。
1.3 统计学分析处理SPSS19.0进行t检验和相关性分析。
2 结果 2.1 质粒转染后表达质粒的鉴定pcDNA3.1-mTOR,空载质粒及脂质体转染细胞后,PCR鉴定转染成功(图 1)。
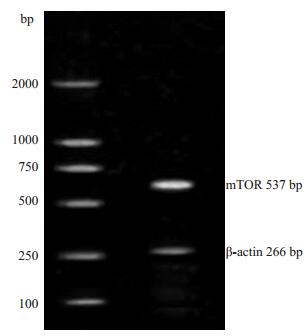
|
图 1 转染后PCR鉴定图 Figure 1 PCR for verification of mTOR transfection in the cells. |
转染mTOR,空载质粒及未转染组细胞生长图见图 2,从图 2明显可见转染野生型mTOR组细胞的生长可速度明显增快,而未转染组和转染空载体质粒组增快变化不显著。
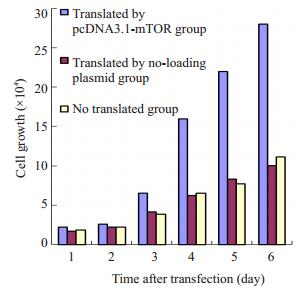
|
图 2 三组细胞生长图 Figure 2 Cell growth in the 3 groups after transfection. |
转染mTOR基因后,其表达明显升高,与转染空质粒后有明显差异;转染mTOR后,AKT也随之表达增加而PTEN的表达明显下降,与其他2组有明显差异(图 3)
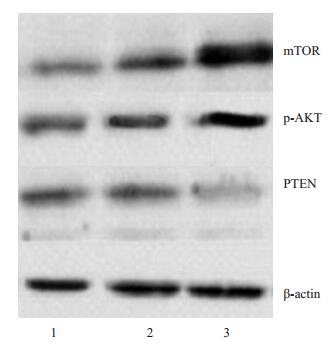
|
图 3 转染后mTOR,AKT及PTEN蛋白的表达图 Figure 3 Expression of the mTOR, AKT, and PTEN proteins in the cells after transfection. Lane 1: Non-transfected cells; Lane 2: Cells transfected with the non-loaded plasmid; Lane 3: Cells transfected with pcDNA3.1-mTOR. |
流式细胞术检测可见,mTOR转染组的细胞凋亡率达(8.2±1.3)%,与对照组相比明显升高(P < 0.01)。转染空质粒组的细胞凋亡率(4.3±0.8)%,与对照组相比变化不显著(表 1)。
| 表 1 转染前后流式细胞检测比较 Table 1 Cell cycle distribution and cell apoptosis of the cells in the 3 groups detected by flow cytometry |
mTOR信号转导通路在调节细胞的凋亡、增生、分化等活动中起着重要作用,与恶性肿瘤的发生、发展关系密切。mTOR信号转导通路与PI3K/AKT信号转导通路的密切的关系越来越受到重视。AKT的磷酸化使mTOR活化,使P70S6K、4E-BP1活化,4E-BP1磷酸化后失活,使之与eIF-4E分离,并与其他翻译起始因子结合,启动蛋白质的合成[1-2, 6]。
本研究将携带有mTOR的质粒导入MCF-7细胞中,发现细胞的mTOR蛋白的表达增强,磷酸化AKT的表达明显增强;而转染未携带有mTOR质粒的MCF-7细胞mTOR的表达不增强,AKT的表达也无明显改变。说明mTOR对PI3K/AKT/mTOR信号转导通路具有明显的负反馈作用。转染前后肿瘤细胞的凋亡率有显著意义的改变也提示mTOR可促进肿瘤细胞的生长。此结果与国内外的的报道一致[7-8]。而转染前后PTEN蛋白相应的改变说明,mTOR与PTEN呈明显负相关。有文献说明,AKT的活化直接磷酸化mTOR使之活化后作用于下游与翻译有关的P70S6K,EIF4E及翻译抑制蛋白4E-BPs,并能直接磷酸化PTEN,激活蛋白的转录,从而在转录水平和翻译水平上对肿瘤细胞的蛋白进行调节[9-10]。甚而有研究发现,mTOR的特异性抑制剂可以促进PTEN蛋白的表达,从而抑制肿瘤地增长[11-12]。
本试验对抑癌基因PTEN和基因mTOR表达的相关性研究,进一步证明PTEN作为一种重要的抑癌基因,在体外对乳腺癌细胞有重要的影响。其主要的作用机制,可能通过PI3K/AKT/mTOR信号转导通路,调控mTOR的表达,利用mTOR对蛋白转录和翻译的重要调控作用,影响乳腺癌细胞的生长;也说明,mTOR对PTEN具有负反馈的调节作用。这个结果提高了我们对呈网络状的信号转导通路相互作用的认识,为寻找肿瘤细胞药物治疗的靶点提供了理论基础;也为mTOR特异性的抑制剂在乳腺癌治疗中的作用提供了理论基础。
| [1] | Lu J, Sun D, Gao S, et al. Cyclovirobuxin D induces AutophagyAssociated cell death via the Akt/mTOR pathway in MCF-7 human breast cancer cells[J]. J pharmacol Sci,2014, 125 (1) : 74-82. DOI: 10.1254/jphs.14013FP. |
| [2] | Eva Madrid. Targeting the PI3K/AKT/mTOR pathway in estrogen receptor-positive breast cancer[J]. Cancer Treat Rev,2014, 40 (7) : 44-7. |
| [3] | Jensen PB, Hunter T, Shah SA, et al. FRAP-p70s6K signaling is required for pancreatic cancer cell proliferation[J]. J Surg Res,2001, 97 : 123-30. DOI: 10.1006/jsre.2001.6145. |
| [4] | Cantrell DA. Phosphoinositide3-kinase signalling pathways[J]. J Cell Sci,2001, 114 : 1439-45. |
| [5] | Testa JR, Bellacosa A. Akt plays a central role in tumori-genesis[J]. PNAS,2001, 98 : 10983-5. DOI: 10.1073/pnas.211430998. |
| [6] | Mills GB, Lu YL, Kohn EC. Linking molecular therapeutics to molecular diagnostics: Inhibition of the FRAP/RAFT/TOR component of the PI3K pathway preferentially blocks PTEN mutant cells in vitro and in vivo[J]. Proc Natl Acad Sci U S A,2001, 98 (18) : 10031-3. DOI: 10.1073/pnas.191379498. |
| [7] | Grewe M, Gansauge F, Schmid RM, et al. Regulation of cell growth and cyclin D1 expression by the constitutively active FRAP-p70 (s6K) pathway in human pancreatic Cancer cells[J]. Cancer Res,1999, 59 (15) : 3581-7. |
| [8] | Huang S, Liu LN, Hosoi H, et al. P53/p21cip1 cooperate in enforcing rapamycin induced G1 arrest and determine the cellular response to rapamycin[J]. Cancer Res,2001, 61 : 3373-81. |
| [9] | Kawasaki K, Smith RJ, Hsieh CM, et al. Activation of the phosphatidylinositol3-kinase/protein kinase Akt pathway mediates nitric oxideinducedendothelial cell migration and angiogenesis[J]. Mol Cell Biol,2003, 23 (16) : 5726-37. DOI: 10.1128/MCB.23.16.5726-5737.2003. |
| [10] | Debnath J, Walker SJ, Brugge JS. Akt activation disrupts mammary acinar architecture and enhance sproliferation in an mTORdependent manner[J]. J Cell Biol,2003, 163 (2) : 315-26. DOI: 10.1083/jcb.200304159. |
| [11] | Zeng ZZ, Yellaturu CR, Neeli I, et al. 5(S)-hydroxyeicosatetraenoic acid stimulates DNA synthesisin human microvascular endothelial cells via activationof Jak/STAT and phosphatidylinositol 3-kinase/ Akt signaling, leading to induction of expression of basic fibroblast growth factor[J]. J Biol Chem,2002, 277 : 41213-9. DOI: 10.1074/jbc.M204508200. |
| [12] | Nagata D, Mogi M, Walsh K. AMP-activated proteinkinase (AMPK) signaling in endothelial cells is essential for angiogenesis in response to hypoxic stress[J]. J Biol Chem,2003, 278 (33) : 31000-6. DOI: 10.1074/jbc.M300643200. |
 2015, Vol. 35
2015, Vol. 35
