脑血管疾病是常见高发疾病,临床上常采用药物治疗、外科手术及介入溶栓治疗等治疗措施来恢复缺血区脑组织的血液供应,缺血组织在短时间内立即恢复血流供应有利于缺血组织的恢复,但在实际情况中,很难在短时间内恢复缺血区血流供应。因此在长时间缺血后恢复血液再灌注会导致进一步的组织损伤和功能障碍,这种现象称为缺血再灌注损伤。在缺血再灌注损伤过程中,脑部数量最多的星形胶质细胞会发生严重损伤,脑缺血后星形胶质细胞的存活会影响神经元的存活和突触的重塑,它通过释放谷氨酸造成兴奋性氨基酸毒性、释放炎性因子及增加缝隙连接等,加重神经细胞的损伤,另一方面,星形胶质细胞又可以通过产生抗氧化物质释放神经营养因子、降低水通道蛋白、促进红细胞生成素帮助神经元恢复损伤。因此,星形胶质细胞对神经元的损伤及恢复有重要作用。
在缺血再灌注过程中,Src蛋白激酶呈激活状态[1-2]。Src激酶属于酪氨酸蛋白激酶,是可感知NMDA等受体激活并向胞内传递信号的核心蛋白激酶,广泛参与星形胶质细胞和神经元的增殖、分裂、存活等生理活动[3-5]。本研究观察Src家族酪氨酸蛋白激酶的抑制剂PP2对星形胶质细胞缺氧/复氧损伤是否具有的神经保护作用及可能机制。本课题组利用原代星形胶质细胞进行体外培养,采用缺氧/再复氧处理模拟在体脑缺血再灌注, 并寻找有效的抗缺血再灌注损伤的措施。
1 材料与方法 1.1 材料 1.1.1 动物清洁级SD大鼠,雌雄不限,由江苏大学实验动物中心提供。实验动物许可证号:SYXK (苏) 2008-0024。
1.1.2 试剂PP2,MTT,二甲基亚砜(DMSO),胰蛋白酶,Src激酶一抗,均为Sigma产品;胎牛血清,DMEM/ F12培养基均为Gibco产品,Bax、Bcl-2单克隆抗体均来自BOSTER;辣根酶标记山羊抗兔lgG、辣根酶标记山羊抗小鼠lgG均来自北京中杉金桥;PI/Annexin V试剂盒为BD公司产品。其他常用试剂均为国产分析纯级。
1.2 方法 1.2.1 星形胶质细胞原代培养、纯化[6]取新生24 h SD大鼠,取大脑皮层,剪碎至糜状,0.125%胰酶37 ℃消化15 min,每5 min振荡1次,加入含10%胎牛血清的DMEM/ F12培养液终止消化,离心,加培养液吹打形成细胞悬液,利用差速贴壁法接种细胞,放入培养箱25 min后,吸取上清液移至一次性塑料培养瓶中,放置于37 ℃、5% CO2培养箱中培养。第2天更换培养液,之后每3 d换液1次,培养7~10 d,倒置显微镜下观察细胞生长情况,待细胞生长至融合状态后,置于37 ℃恒温摇床中250 r/min振荡18 h,弃上清液后,进行传代培养。待细胞生长稳定后,进行星形胶质细胞特异性蛋白GFAP免疫荧光染色,进行细胞纯度鉴定,取纯度在95%以上的细胞进行研究。
1.2.2 实验分组及缺氧/复氧模型的建立实验分为正常对照组、缺氧/复氧组及PP2+缺氧/复氧组。将星形胶质细胞接种于细胞培养板中,用含10%胎牛血清的DMEM/ F12培养基,在37 ℃、5% CO2培养相中培养24 h。缺氧/复氧处理:用未加血清的无糖DMEM培养基替换含10%胎牛血清的DMEM-F12(1:1)培养基,置缺氧培养箱(94% N2,5% CO2,1%O2)内培养8 h,再将培养液换为含10%胎牛血清的DMEM-F12(1:1)培养基,放入37 ℃、5% CO2培养箱继续培养24 h。PP2+缺氧/复氧组于缺氧/复氧前给予终浓度为10 µmol/L的PP2预处理24 h。
1.2.3 星形胶质细胞鉴定将传代后的星形胶质细胞按1.0×105/ml的密度接种于12孔培养板内,37 ℃、5% CO2培养箱孵育24 h,GFAP染色鉴定。用4%多聚甲醛室温固定15 min,5% BSA溶液在37 ℃条件下孵育2 h。加一抗(兔抗GFAP胶质纤维酸性蛋白多克隆抗体,按1: 100稀释),放入4 ℃冰箱孵育过夜后,加入二抗(FITC标记的山羊抗兔IgG多克隆抗体,按1:100稀释),放入湿盒,避光,37 ℃孵育1 h。DAPI染料染色2 min,显微镜下观察染色情况并拍照,以出现阳性染色为准。
1.2.4 MTT法测定星形胶质细胞存活率将星形胶质细胞按每孔200 μ(l细胞密度为5×104/ml)接种于96孔板,每组设置5个复孔。检测每组不同处理后星形胶质细胞的细胞存活率。终止培养前4 h,每孔加MTT15 μl(5 g/L),弃上清液,加入二甲基亚砜150 μl/孔,微量振荡器震摇10 min,全自动定量绘图酶标仪测定每孔的570 nm波长处吸光度D570。以上实验重复3次。
1.2.5 流式细胞术法检测星形胶质细胞凋亡情况取对数生长期细胞,按每孔细胞10×104/ml,接种于12孔板,每孔接种细胞1 ml,同时设立阴性对照组。按照实验分组处理后,胰酶消化细胞,离心,PBS洗涤3遍。收集细胞约1~5×104。吹打细胞悬浮于300 µl Binding Buffer悬浮液中,加入3 µl AnnexinV-FITC混匀,静置5 min,加入3 µl PI,混匀,室温避光反应5~15 min。用BD公司C6流式细胞仪检测各组细胞凋亡情况。Annexin V阳性、PI阴性(右下象限)代表细胞早期凋亡情况。
1.2.6 Western blotting法检测星形胶质细胞Src激酶、Bax和Bcl-2的蛋白表达分别收集正常对照组、缺氧/复氧组及PP2+缺氧/复氧组星形胶质细胞,加适量细胞裂解液裂解细胞,提取蛋白,然后进行标准蛋白定量(Bio-rad DC assay);制备12% SDS-PAGE凝胶;将需检测蛋白标本上样,电泳,转膜,封闭,孵抗体,其中各抗体稀释度依次为:一抗(抗Src激酶抗体,1:2000;抗Bax蛋白抗体,1:200;抗Bcl-2蛋白抗体,1:200),二抗(辣根酶标记山羊抗兔lgG、辣根酶标记山羊抗小鼠lgG,1:10 000),内参β-actin(1:15 000)。Bio-Rad凝胶成像系统采集图像,用Bio Imaging system(Gene Genius)对Src、Bax、Bcl-2和β-actin条带进行灰度扫描分析,求得各组条带与β-actin的比值,再将各组比值与空白对照组相比。
1.3 统计学方法实验结果使用SPSS13.0软件进行分析,两组之间计量资料比较进行t检验;多组之间计量资料比较进行ANOVA分析;组间比较采用LSD法;P < 0.05认为有统计学意义,统计图表采用Sigma Plot 10.0绘制。
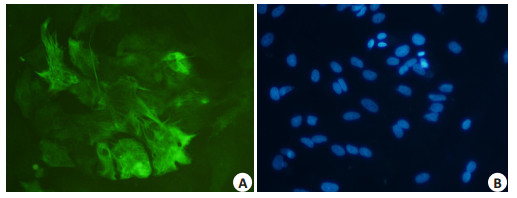
2 结果 2.1 星形胶质细胞GFAP鉴定结果应用免疫荧光方法,在荧光显微镜下观察,GFAP标记阳性者呈绿色荧光,即为星形胶质细胞,通过DAPI核染可见细胞核为蓝色(图 1)。在多个标本上从上、下、左、右4个方向分别选取四个视野进行观察、计数阳性细胞,荧光显微镜下占光镜下所有细胞比例95%以上,可用于后续相关实验的使用。
|
图 1 星形胶质细胞GFAP免疫荧光染色 Figure 1 Immunofluorescence staining of cultured rat astrocytes.A: Immunofluorescence staining of GFAP; B: DAPI staining of the nuclei. |
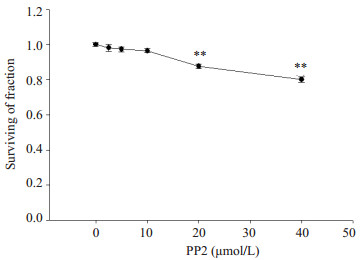
单独用PP2处理星形胶质细胞24 h,在0~10 µmol/L浓度范围内细胞存活率为96%~99%(P > 0.05),对细胞存活率无影响(图 2)。
|
图 2 PP2对星形胶质细胞存活率的影响 Figure 2 Effect of PP2 pretreatment for 24 h on the viability of cultured astrocytes (n=3). **P < 0.01 vs 0 µmol/L PP2 group. |
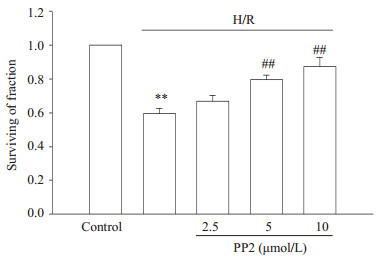
MTT结果(图 3)显示星形胶质细胞经过缺氧/复氧处理后,细胞存活率较正常对照组显著降低(59.41±3.20)%,而分别用2.5、5、10 µmol/L PP2预处理后,细胞存活率分别为(66.89±3.54)%、(79.44±2.97)%、(87.12±5.60)%,较单独缺氧/复氧组细胞存活率增加(P < 0.01),并在10 µmol/L时这种作用最为明显,因此选用PP2浓度10 µmol/L作为接下来实验用药物浓度。
|
图 3 PP2对星形胶质细胞缺氧/复氧后细胞存活率的影响 Figure 3 Effect of PP2 on survival of the astrocytes exposed to hypoxia/reoxygenation (H/R). Bars represent Mean±SD (n=3). **P < 0.01 vs control group; ##P < 0.01 vs H/R group. |
图 4显示Src激酶抑制剂PP2(10 µmol/L)预处理缺氧/复氧组后对Src激酶蛋白表达的影响。缺氧/复氧组Src激酶蛋白表达(1.372±0.108)高于空白对照组(P < 0.01),而PP2+缺氧/复氧组的Src激酶蛋白表达(0.885±0.122)明显低于缺氧/复氧组(P < 0.01)。
|
图 4 PP2对星形胶质细胞缺氧/复氧后Src激酶表达的影响 Figure 4 Effect of PP2 on expression of Src kinase in astrocytes exposed to hypoxia/reoxygenation (H/R). Bars represent Mean±SD (n=3). **P < 0.01 vs control group. ##P < 0.01 vs H/R group. |
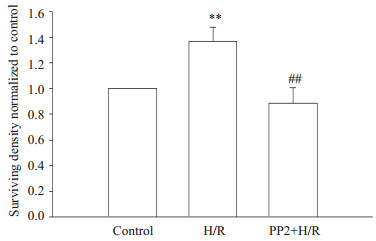
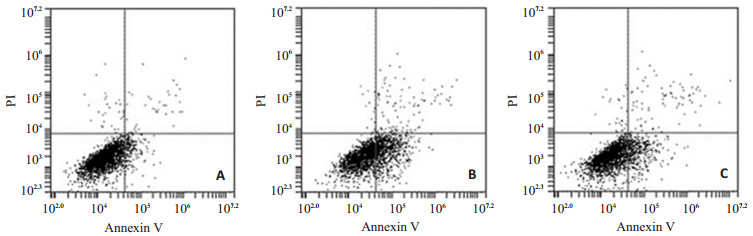
图 5结果显示,各组星形胶质细胞凋亡率分别为9.01%±0.4%,33.80%±1.34%和19.10%±0.912%。经过缺氧/复氧后,细胞凋亡明显增加,而经过10 µmol/L PP2预处理后,能显著降低由缺氧/复氧所致细胞凋亡的增加(P < 0.01)。
|
图 5 PP2对星形胶质细胞缺氧/复氧后细胞凋亡率的影响 Figure 5 Effect of PP2 on apoptosis of astrocytes exposed to hypoxia/reoxygenation. A: Control group; B: H/R group; C: PP2+H/R group. |
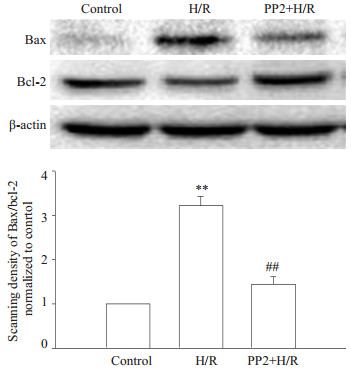
图 6显示了用Src激酶抑制剂PP2(10 µmol/L)预处理缺氧/复氧组后对Bax和Bcl-2蛋白表达的影响。缺氧/复氧组Bax/Bcl-2蛋白表达比值(3.220±0.209)与空白对照组相比显著增加(P < 0.01);PP2+缺氧/复氧组Bax/Bcl-2蛋白表达比值为(1.442±0.165)与缺氧复氧组相比,蛋白比值降低(P < 0.01)。
|
图 6 PP2对星形胶质细胞缺氧/复氧后蛋白Bax/Bcl-2的影响 Figure 6 Effect of PP2 on Bax/Bcl-2 ratio in astrocytes exposed to hypoxia/reoxygenation. Bars represent Mean±SD (n=3). **P < 0.01 vs control group; ##P < 0.01 vs H/R group. |
脑缺血/再灌注损伤会导致严重的脑功能障碍,其机制较为复杂,目前发现主要与兴奋性氨基酸毒性作用、细胞内钙超载、自由基过度形成、炎性反应等多种机制有关,通过这些机制最终导致神经细胞凋亡。因此本实验采用MTT,流式细胞术和Western blotting法探讨Src激酶抑制剂PP2对星形胶质细胞缺氧/复氧损伤的保护作用及可能机制。
Src家族酪氨酸蛋白激酶(src family of protein tyrosine kinase, Src PTKs)是一类膜结合的非受体酪氨酸蛋白激酶,现已知Src家族有9个成员,其中Src、Fyn、Yes、Lyn、Lck在哺乳动物中枢神经系统中均有较高表达。Src PTKs在脑缺血情况下激活进而激活NMDA受体[7],Ca2+通道以及K+通道[8-9]。其中,NMDA受体主要由NR1亚基和NR2亚基(NR2A-NR2D)组成[10-11],是受配基调节的离子通道,对Ca2+具有通透性,可被Mg2+电压依赖性阻断,NMDA受体过度兴奋介导的迟发性神经细胞损伤可能在脑缺血损伤中起主要作用[12]。而Src可以通过磷酸化NR 1/NR 2亚基使NR功能上调。有文献报道,在使用了Src激酶抑制剂PP2后可降脑缺血梗死区域[13]。本研究中缺氧/复氧组的Src激酶表达增加,用PP2+缺氧/复氧组可明显抑制Src激酶的表达,使其活性降低,并且在流式细胞术实验中,用PP2处理后可降低由缺氧/复氧导致的细胞凋亡,说明PP2有可能是通过抑制Src激酶的表达从而降低细胞凋亡。
脑缺血/再灌注导致的细胞凋亡的发生是一个由基因调控的主动死亡过程。目前已发现有3类细胞凋亡相关基因:即凋亡过程中表达的基因、促进凋亡的基因及抑制凋亡的基因。其中,Bcl-2为最重要的调控细胞凋亡基因,分为促进细胞凋亡的基因和抑制细胞凋亡的基因。Bax为Bcl-2家族中最重要的促凋亡基因,Bcl-2为Bcl-2家族中重要的抗凋亡基因,Bax可通过与Bcl-2结合阻断其抗凋亡作用[14-15]。研究表明,Bax的表达并不受Bcl-2蛋白过度表达的影响,虽然Bcl-2蛋白不能通过影响Bax蛋白表达来促进神经元的存活,但是Bcl-2蛋白能够减少细胞色素C(cyt-c)和抑制caspase-3的酶活性来抑制神经细胞的凋亡[16]。在脑缺血再灌注的损伤机制中,由谷氨酸介导的兴奋性细胞毒性起关键作用,它可以通过细胞凋亡或者细胞坏死的方式,最终导致神经细胞死亡。而NMDA属于谷氨酸离子型受体,是介导神经毒性最主要的受体,Src激酶可以作用于该受体,引起NMDA受体功能上调,加重神经细胞凋亡。因此我们可以通过Bax和Bcl-2蛋白表达变化来观察药物PP2干预Src激酶后星形胶质细胞凋亡情况。通过我们的实验结果可以发现,PP2+缺氧/复氧组的Bax与Bcl-2蛋白表达较缺氧/复氧组分别降低和增加,说明抗凋亡起主要作用,PP2有可能使细胞内在抗凋亡机制激活,使得细胞凋亡降低。
综合以上研究结果,PP2能显著降低由缺氧/复氧所导致的星形胶质细胞凋亡,增加细胞存活率,而这种保护作用有可能与抑制Src激酶表达和影响Bax/Bcl-2比值有关。通过我们的实验分析,希望可为Src激酶抑制剂治疗脑缺血/再灌注损伤提供一定的实验和理论基础。
| [1] | Du CP, Gao J, Tai JM, et al. Increased tyrosine phosphorylation of PSD-95 by Src family kinases after brain ischaemia[J]. Biochem J,2009, 417 (1) : 277-85. DOI: 10.1042/BJ20080004. |
| [2] | Zhang F, Guo AL, Liu CL, et al. Phosphorylation and assembly of glutamate receptors after brain ischemia[J]. Stroke,2013, 44 (1) : 170-U294. DOI: 10.1161/STROKEAHA.112.667253. |
| [3] | Yeatman J T. A Renaissance for SRC[J]. Nat Rev Cancer,2004, 4 (6) : 470-80. DOI: 10.1038/nrc1366. |
| [4] | Sandilands E, Serrels B, Mcewan DG, et al. Autophagic targeting of Src promotes Cancer cell survival following reduced FAK signalling[J]. Nat Cell Biol,2012, 14 (1) : 51-60. |
| [5] | Yu XM, Groveman BR. Src family kinases in the nervous system[J]. FEBS J,2012, 279 (1) : 1. DOI: 10.1111/j.1742-4658.2011.08423.x. |
| [6] | Dong S, Tong X, Liu H, et al. Protective effects of pomegranate polyphenols on cardiac function in rats with myocardial ischemia/ reperfusion injury[J]. Nan Fang Yi Ke Da Xue Xue Bao,2012, 32 (7) : 924-7. |
| [7] | Guo J, Wu HW, Hu G, et al. Sustained activation of Src-family tyrosine kinases by ischemia: a potential mechanism mediating extracellular signal-regulated kinase cascades in hippocampal dentate gyrus[J]. Neuroscience,2006, 143 (3) : 827-36. DOI: 10.1016/j.neuroscience.2006.08.031. |
| [8] | Fadool DA, Holmes TC, Berman K, et al. Tyrosine phosphorylation modulates current amplitude and kinetics of a neuronal voltagegated Potassium Channel[J]. J Neurophysiol,1997, 78 (3) : 1563-73. |
| [9] | Liu Y, Yan JZ, Gu YH, et al. Depolarization induces NR2A tyrosine phosphorylation and neuronal apoptosis[J]. Can J Neurol Sci,2011, 38 (6) : 880-6. DOI: 10.1017/S0317167100012476. |
| [10] | Cull-Candy S, Brickley S, Farrant M. NMDA receptor subunits: diversity, development and disease[J]. Curr Opin Neurobiol,2001, 11 (3) : 327-35. DOI: 10.1016/S0959-4388(00)00215-4. |
| [11] | Brabet I, Parmentier ML, De Colle C, et al. Comparative effect of L-CCG-I, DCG-IV and gamma-carboxy-L-glutamate on all cloned metabotropic glutamate receptor subtypes[J]. Neuropharmacology,1998, 37 (8) : 1043-51. DOI: 10.1016/S0028-3908(98)00091-4. |
| [12] | Liang D, Dawson TM, Dawson VL. What have genetically engineered mice taught us about ischemic injury[J]. Curr Mol Med,2004, 4 (2) : 207-25. DOI: 10.2174/1566524043479194. |
| [13] | Takenaga Y, Takagi N, Murotomi K, et al. Inhibition of Src activity decreases tyrosine phosphorylation of occludin in brain capillaries and attenuates increase in permeability of the blood-brain barrier after transient focal cerebral ischemia[J]. J Cereb Blood Flow Metab,2009, 29 (6) : 1099-108. DOI: 10.1038/jcbfm.2009.30. |
| [14] | Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics[J]. Dev Cell,2011, 21 (1) : 92-101. DOI: 10.1016/j.devcel.2011.06.017. |
| [15] | Dong L, Fan Y, Shao X, et al. Vitexin protects against myocardial ischemia/reperfusion injury in Langendorff-perfused rat hearts by attenuating inflammatory response and apoptosis[J]. Food Chem Toxicol,2011, 49 (12) : 3211-6. DOI: 10.1016/j.fct.2011.09.040. |
| [16] | Rodrigues T, de Franca LP, Kawai C, et al. Protective role of mitochondrial unsaturated lipids on the preservation of the apoptotic ability of cytochrome C exposed to singlet Oxygen[J]. J Biol Chem,2007, 282 (35) : 25577-87. DOI: 10.1074/jbc.M700009200. |
 2015, Vol. 35
2015, Vol. 35
