2. 西安交通大学医学院第一附属医院影像中心, 陕西 西安 710061
2. Imaging Center, First Affiliated Hospital of Xi'an Jiaotong University College of Medicine, Xi'an 710061, China
替莫唑胺(Temozolomide, TMZ)是目前脑胶质瘤治疗中一线的治疗方案。由于细胞毒性作用,TMZ可以诱导不同类型的细胞程序性死亡,如凋亡[1]、自体吞噬[2]及衰老[3]等。我们注意到,在针对不同的脑胶质瘤细胞系,TMZ诱导的细胞程序性死亡是不尽相同的,甚至在诱导同一种细胞株的过程中,出现不同形式的程序性死亡[4]。尽管一些研究也显示TMZ可以抑制脑胶质瘤C6细胞的增殖,但并未深入的探讨其可能的机制。因此,我们的研究观察TMZ对大鼠脑胶质瘤C6细胞株的作用,并探讨其可能的分子机制。
1 材料和方法 1.1 材料大鼠脑胶质瘤C6细胞株购自中科院细胞库,替莫唑胺购自Sigma,DMEM培养基购自Gibco,胎牛血清购自杭州四季青公司,免疫组化和Western blotting所用一抗均购自Santa Cruz,碱性磷酸酶标记的二抗购自中国武汉博士德公司,电化学发光试剂盒购自Pierce,Tunnel凋亡检测试剂盒购自Promega,Hochest33342染色液购自Sigma,所有其他化学试剂购自Sigma。
1.2 方法 1.2.1 细胞培养大鼠脑胶质瘤细胞株C6细胞用含10%胎牛血清的DMEM培养液培养,培养条件为37 ℃、5% CO2的孵箱内培养。当细胞70%~90%融合时,用1.25%胰酶和0.2% EDTA的混合液消化传代。
1.2.2 TMZ干预和MTT检测取生长状态良好的各组细胞,消化后制成细胞悬液,96孔板内培养,每孔2×104,含10%胎牛血清的培养基内培养,终体积0.2 ml。细胞贴壁正常,每孔中更换含TMZ的培养基。TMZ的浓度分别为0、50、100、200、400、800 μg/ml。分别作用12、24、48 h后取出培养板,加入20 μl MTT(终浓度0.5 mg/ml),37 ℃孵育4 h,离心后弃上清,加入200 μl DMSO,震荡20 min,标本完全溶解后,酶标仪测570 nm处吸光度值。
1.2.3 HE染色细胞爬片后,95%乙醇固定,苏木素染液染色。洗涤后,浸入伊红染液染色,吹干或自然晒干细胞爬片后,中性树胶封片。光镜观察TMZ处理前后细胞形态学变化。
1.2.4 Hochest33342染色加入TMZ处理爬片细胞,加入0.5 ml 4%福尔马林溶液固定,洗涤后加入0.5 ml Hochest33342染色,滴加抗荧光淬灭封片液,荧光显微镜下观察。比较TMZ处理前后细胞核改变。
1.2.5 原位末端转移酶标记技术(Tunnel法)细胞爬片固定洗涤后,按50 μl/cm2滴加反应液(每50 μl反应液含TdT酶0.5 μl,标记的-dUTP 1 μl),置湿盒中37 ℃孵育1 h。依次进行FITC标记和PI复染,置暗盒中用荧光显微镜观察,选用蓝色激发光(波长488 nm),所有的细胞核均被PI着色,显示出红色荧光,而凋亡细胞被特异地标记上FITC,显示出黄绿色荧光。
1.2.6 免疫组化细胞爬片4%多聚甲醛固定,依次0.5% Txiton X-100和3% H2O2处理。血清封闭后,一抗(PBS按比例稀释)在37 ℃孵育1~2 h或4 ℃过夜,试剂盒中的生物素化,37 ℃下孵育20 min,SABC湿盒内37 ℃孵育20 min,DAB显色,苏木素复染,脱水透明后封片观察。本研究针对凋亡相关蛋白进行染色,阳性表达均为肿瘤胞浆内出现棕黄色颗粒为阳性。
1.2.7 Western blotting细胞经胰酶消化,磷酸盐缓冲液(PBS,0.01 mol/L, pH 7.2)漂洗后,转移到1.5 ml EP管内。用1% NP-40液裂解细胞,4 ℃静置30 min,15 000 r/min离心10 min,提取上清总蛋白。用考马斯亮蓝G-250定量,沸水变形10 min。每孔30 μg上样,8%~12%聚丙烯酰胺凝胶(SDS-PAGE)80 V电压下分离。用25 V电压将凝胶上的蛋白半干转至硝酸纤维素膜上。5%脱脂奶粉将膜封闭2 h后,加入一抗(按说明稀释),4 ℃孵育过夜,TBS充分漂洗后加入二抗(按说明稀释)孵育2 h。化学发光法显色,胶片显像。
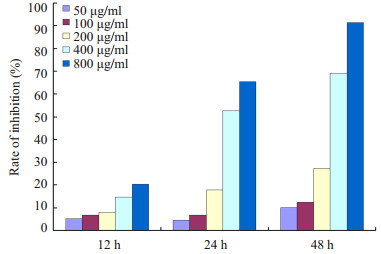
2 结果 2.1 不同浓度替莫唑胺作用不同时间点对大鼠脑胶质瘤C6细胞的抑制效应MTT显示TMZ对大鼠脑胶质瘤C6细胞的增殖具有抑制效应,而这种抑制效应呈现出时间和剂量依赖特点(图 1)。随着TMZ作用浓度提高和作用时间的延长,抑制率逐步增加,在800 μg/ml组作用48 h高达91.4%。此外,研究结果也筛选出最佳的作用浓度和作用时间。在后续的研究当中,我们选择400 μg/ml作用24 h作为作用浓度和作用时间。400 μg/ml作用24 h抑制率为52.6%,这样的选择避免对增殖抑制的过高或过低造成对实验结果的不良影响。
|
图 1 不同浓度替莫唑胺作用不同时间点抑制率 Figure 1 Cell growth inhibition rate after treatment with different concentrations of TMZ for different time lengths. |
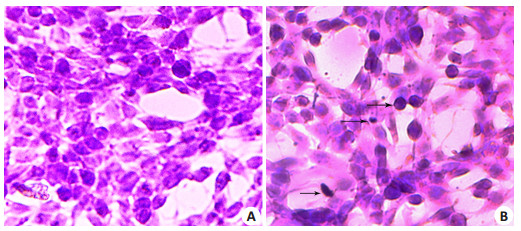
HE染色显示400 μg/ml TMZ处理细胞24 h细胞形态学变化(图 2)。处理前正常细胞经染色后仍保持细胞原有的生长形状,核规整,染成均一蓝色(图 2A)。而处理后凋亡细胞变圆变小,细胞核固缩、碎裂,染色体被染成深蓝色或蓝黑色,染色质靠边,凝集,细胞膜皱折、卷曲,凋亡小体形成(图 2B)。图 2B中黑色箭头所示,分别代表核浓缩、凋亡小体和核边集。
|
图 2 400 μg/ml TMZ处理细胞24 h细胞形态学变化 Figure 2 Morphological changes of the cells before (A) and after (B) treatment with 400 μg/ml TMZ for 24 h (HE staining, original magnification: ×400). |
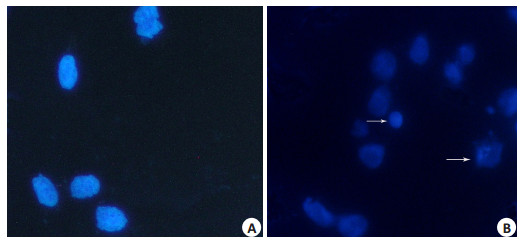
Hochest33342染色显示凋亡诱导前后细胞核的改变(图 3)。处理前细胞核大小一致,染色均匀(图 3A)。而400 μg/ml TMZ处理细胞24 h细胞后,细胞核大小不一,胞核内可见空洞形成,固缩变小,甚至崩溃。染色质聚集,靠边,可见凋亡小体形成(图 3B)。图 3B中白色箭头所示,分别代表凋亡小体和核碎裂。
|
图 3 400 μg/ml TMZ处理细胞24 h细胞Hochest33342染色结果 Figure 3 Hochest33342 staining of the cells before (A) and after (B) after treatment with 400 μg/ml TMZ for 24 h (Original magnification: ×400). |
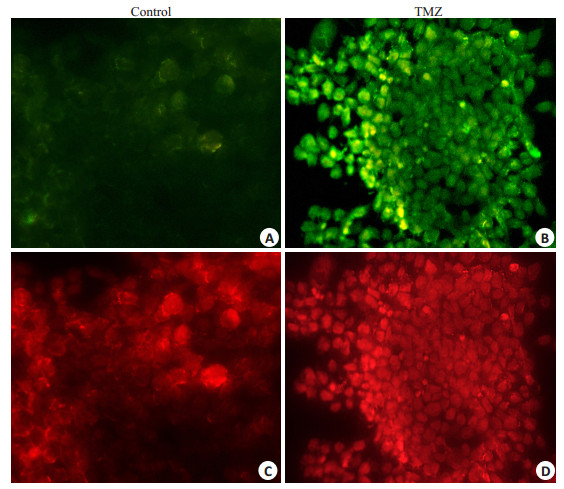
原位末端转移酶标记技术显示400 μg/ml TMZ处理细胞24 h对大鼠脑胶质瘤C6细胞的凋亡诱导效应(图 4)。在蓝色激发光(波长488 nm),诱导前后所有的细胞核均可被PI着色,显示出红色荧光。而只有经过TMZ处理后的凋亡细胞被特异地标记上FITC,显示出绿色荧光。
|
图 4 400 μg/ml TMZ处理细胞24 h细胞Tunnel检测结果 Figure 4 Tunnel staining of the cells before and after after treatment with 400 μg/ml TMZ for 24 h (Original magnification: ×400). A and C: The control group; B and D: The TMZ group. |
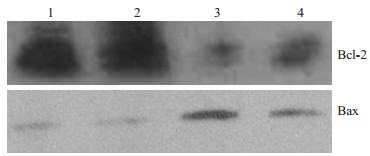
在观察TMZ对大鼠脑胶质瘤C6细胞的凋亡诱导效应的基础上,我们进一步研究了这种诱导效应的可能的分子学机制。应用Western对凋亡相关蛋白进行定量分析。结果(图 5)显示促凋亡蛋白Bax表达水平上调,凋亡抑制蛋白Bcl-2表达的下调。除此之外,我们还对caspase-3、caspase-8、caspase-9、caspase-12的表达进行了检测,未发现主要的caspase家族的表达变化。因此,我们推测TMZ对大鼠脑胶质瘤C6细胞的凋亡诱导效应可能是caspase非依赖的。
|
图 5 400 μg/ml TMZ处理细胞24 h细胞Western结果 Figure 5 Expression of Bcl-2 and Bax in the cells treated with 400 μg/ml TMZ for 24 h. Lanes 1 and 2: Before treatment; Lanes 3 and 4: After treatment. |
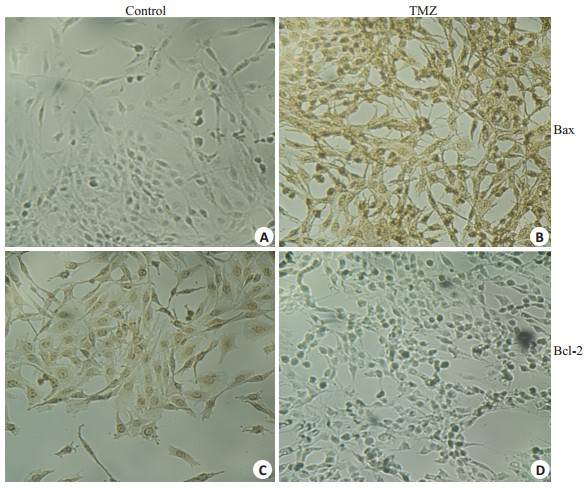
应用免疫组化观察了诱导过程中凋亡相关蛋白的表达变化。免疫组化的结果(图 6)表明400 μg/ml TMZ处理细胞24 h后,促凋亡蛋白Bax表达水平上调,凋亡抑制蛋白Bcl-2表达下调。
|
图 6 400 μg/ml TMZ处理细胞24 h细胞免疫组化结果 Figure 6 Immunohistochemical staining of the cells before (control) and after (TMZ) treatment with 400 μg/ml TMZ for 24 h (Original magnification: ×200). A and B: Expression of Bax in the control and TMZ groups, C and D: Expression of Bcl-2 in the control and TMZ groups. |
恶性脑胶质瘤是常见的脑肿瘤,发病率占全部原发性脑肿瘤的50%以上。致死率高,中位生存时间仅为12~15月。在治疗上,单纯的手术效果不佳,常辅以放化疗。由于TMZ副作用小,可有效延长生存时间,因此常作为脑胶质瘤标准的化疗药物应用于临床[5]。
TMZ作用于脑胶质瘤的主要机制在于DNA甲基化和错配修复失败,从而是细胞处于G2-M期,细胞发生程序性坏死[6]。如前所述,当TMZ作用于不同的细胞株,可以观察到不同形式的细胞程序性坏死。在我们的研究当中,观察了TMZ对大鼠脑胶质瘤C6细胞株的作用机制。首先验证了TMZ对C6细胞的增殖抑制作用,结果也显示了这种抑制效应呈现为时间和剂量依赖性,并根据MTT的研究结果,筛选出用于下一步研究的最佳作用时间和作用浓度。当应用400 μg/ml TMZ处理细胞24 h后,发现C6细胞出现程序性死亡,HE染色和Hochest33342染色表现为细胞形态和细胞核的异常,有凋亡小体的形成。结果显示TMZ通过诱导C6细胞程序性死亡而发挥细胞毒性作用。Tunnel的结果也证实了这一点。我们应用蛋白印迹进一步对这种作用的机制进行研究发现,未见主要的凋亡蛋白caspase-3、caspase-8、caspase-9、caspase-12的异常表达,但蛋白印迹和免疫组化均发现凋亡抑制蛋白Bcl-2表达下调和促凋亡蛋白Bax表达上调。我们推测TMZ对C6细胞的程序性死亡诱导效应可能是通过caspase非依赖通路形成的。
细胞程序性死亡涵盖多种形式,其中最为经典的是caspase介导的细胞凋亡。这种方式主要为细胞通过线粒体途径、死亡受体途径和内质网途径分别激活caspase-9、caspase-8、caspase-12,最终切割激活caspase-3,从而导致细胞凋亡。但越来越多表明,这只是细胞程序性死亡的一种形式[7-8]。Xiang等[9]早在1996年便发现caspase抑制剂不能抑制Bax诱导的Jurkat细胞系的死亡。因此,细胞程序性死亡的机制是复杂多样的,除此之外,还有caspase非依赖性途径。
Bcl-2家族是另一大类参与细胞程序性坏死的凋亡调控蛋白。Bcl-2家族的主要作用是控制线粒体内外膜的通透性,因此是线粒体凋亡途径的主要调控者[6]。Bcl-2家族分为3类:促凋亡蛋白(如Bak和Bax)、抗凋亡蛋白(如Bcl-2和Bcl-x)及Bim、Bid等BH3-only蛋白[10]。我们的研究结果显示Bax蛋白表达上调以及Bcl-2蛋白表达下调,说明了Bcl-2家族在TMZ诱导的大鼠脑胶质瘤C6细胞中扮演重要的角色。
已有研究显示Bcl-2家族在caspase非依赖性的细胞程序性坏死中所起的作用,其机制包括以下两个方面:首先,通过激活细胞质中的Bax,使Bax结合到线粒体外膜上,形成多聚体孔道导致线粒体膜电势的丧失;其次,促使凋亡诱导因子(apoptosis-inducing factor, AIF)从线粒体内膜转移到膜间隙中并被切割为tAIF,tAIF经Bax形成的孔道进入胞质,最终进入到细胞核内,使染色质凝集和DNA断裂,最后引起细胞程序性坏死[11]。其他研究也显示AIF所引起的细胞程序性坏死不能被caspase抑制剂阻断,因此是caspase非依赖的[12]。此外,Bcl-2家族可以调控细胞色素C的释放。细胞色素C的异常可以引起呼吸链功能障碍而导致活性氧(ROS)的产生。ROS的生成与另外一个DNA切割蛋白EndoG的释放紧密相关。EndoG所介导的细胞死亡往往被认为是caspase非依赖的[13]。
本研究显示TMZ诱导的大鼠脑胶质瘤C6细胞株程序性死亡不同于其他细胞株,呈现为caspase非依赖性,但是其具体的死亡形式以及可能的分子传导通路仍需要进一步研究。
| [1] | Roos WP, Batista LF, Naumann SC, et al. Apoptosis in malignant glioma cells triggered by the temozolomide-induced DNA lesion O6-methylguanine[J]. Oncogene,2007, 26 (2) : 186-97. DOI: 10.1038/sj.onc.1209785. |
| [2] | Kanzawa T, Germano IM, Komata T, et al. Role of autophagy in temozolomide-induced cytotoxicity for malignant glioma cells[J]. Cell Death Differ,2004, 11 (4) : 448-57. DOI: 10.1038/sj.cdd.4401359. |
| [3] | Gunther W, Pawlak E, Damasceno R, et al. Temozolomide induces apoptosis and senescence in glioma cells cultured as multicellular spheroids[J]. Br J Cancer,2003, 88 (3) : 463-9. DOI: 10.1038/sj.bjc.6600711. |
| [4] | Knizhnik AV, Roos WP, Nikolova T, et al. Survival and death strategies in glioma cells: autophagy, senescence and apoptosis triggered by a single type of Temozolomide-induced DNA damage[J]. PLoS One,2013, 8 (1) : e55665. DOI: 10.1371/journal.pone.0055665. |
| [5] | Ramirez YP, Weatherbee JL, Wheelhouse RT, et al. Glioblastoma multiforme therapy and mechanisms of resistance[J]. Pharmaceuticals,2013, 6 (12) : 1475-506. DOI: 10.3390/ph6121475. |
| [6] | Thomas RP, Recht L, Nagpal S. Advances in the management of glioblastoma: the role of temozolomide and MGMT testing[J]. Clin Pharmacol,2013, 5 : 1-9. |
| [7] | Hassen S, Ali N, Chowdhury P. Molecular signaling mechanisms of apoptosis in hereditary non-polyposis colorectal cancer[J]. World J Gastrointest Pathophysiol,2012, 3 (3) : 71-9. DOI: 10.4291/wjgp.v3.i3.71. |
| [8] | Wong RS. Apoptosis in cancer: from pathogenesis to treatment[J]. J Exp Clin Cancer Res,2011, 30 (1) : 1-14. DOI: 10.1186/1756-9966-30-1. |
| [9] | Xiang J, Chao DT, Korsmeyer SJ. BAX-induced cell death May not require interleukin 1B-converting enzyme-like proteases[J]. Proc Natl Acad Sci U S A,1996, 93 (25) : 14559-63. DOI: 10.1073/pnas.93.25.14559. |
| [10] | Kouri FM1, Jensen SA, Stegh AH. The Role of Bcl-2 family proteins in therapy responses of malignant astrocytic gliomas: Bcl2L12 and beyond[J]. Sci World J,2012 : 838916. DOI: 10.1100/2012/838916. |
| [11] | Moubarak RS, Yuste VJ, Artus C, et al. Sequential activation of poly (ADP-ribose) polymerase 1, calpains, and bax is essential in apoptosis-inducing factor-mediated programmed necrosis[J]. Mol Cell Biol,2007, 27 (13) : 4844-62. DOI: 10.1128/MCB.02141-06. |
| [12] | Carter BZ, Kornblau SM, Tsao T, et al. Caspase-independent cell death in AML: caspase inhibition in vitro with pan-caspase inhibitors or in vivo by XIAP or Survivin does not affect cell survival or prognosis[J]. Blood,2003, 102 (12) : 4179-86. DOI: 10.1182/blood-2003-03-0960. |
| [13] | Liu PL, Yuh LC, Yung HC, et al. Wood smoke extract induces oxidative stress-mediated caspase-independent apoptosis in human lung endothelial cells: role of AIF and EndoG[J]. Am J Physiol Lung Cell Mol Physiol,2005, 289 (5) : 739-49. DOI: 10.1152/ajplung.00099.2005. |
 2015, Vol. 35
2015, Vol. 35
