2. 重庆医科大学 生物医学工程学院 省部共建超声医学工程国家重点实验室, 重庆 400016
2. State Key Laboratory of Ultrasound Engineering in Medicine Co-founded by Chongqing and the Ministry of Science and Technology, College of Biomedical Engineering, Chongqing Medical University, Chongqing 400016, China
恶性黑色素瘤(malignant melanoma, MM)是来源于黑色素细胞的一种恶性肿瘤,恶性程度高,侵袭性强,早期可发生转移,易复发,死亡率高。在我国, 虽然其发病率较低,但近年有明显上升趋势,每年新发病例约2万例[1]。目前,早期患者通过手术治疗,多数能够治愈;但对于已经失去手术机会进展期患者,化疗和放疗通常效果不佳[2-3]。因此对失去手术机会的黑色素瘤,寻找合适的替代治疗方法尤为重要。
高强度聚焦超声(HIFU)作为热疗的一种特殊手段,是一种适形治疗实体肿瘤的非侵入性治疗技术,主要是通过利用超声波的穿透性和可聚焦性,将超声换能器发射的无数束低能量的超声波准确聚焦于体内靶组织,焦点能量得到千、万倍放大,在焦点处产生瞬间的高温、空化及机械效应,采用由点成线、由线成面、由面成体的适形扫描方式,治疗体内一定范围内任意形状的肿瘤组织,是肿瘤综合性治疗手段之一,因其无创、靶向特点引起了国内外医学界的广泛关注。目前在临床应用HIFU治疗的肿瘤包括前列腺癌、胰腺癌等[4-6]。但目前临床上还未将黑色素瘤列入HIFU治疗适应症中;同时,对于应用HIFU治疗高转移性肿瘤的基础研究较少。我们采用HIFU处理黑色素瘤的小鼠皮下移植瘤模型,分阶段观察处理后黑色素瘤细胞在小鼠体内的转移能力,以了解HIFU治疗除直接杀伤肿瘤细胞外,对残留癌细胞的转移能力有无影响,为HIFU技术应用于黑色素瘤、乃至其它高转移性实体瘤的治疗提供实验依据和奠定理论基础。
1 材料与方法 1.1 细胞株和实验动物B16-F10小鼠黑色素瘤细胞株,来源于C57/BL6J小鼠,由我校超声医学工程重庆市市级重点实验室王嫣教授馈赠。C57/BL6J小鼠,鼠龄6~8周,体质量20~25 g,雌性,由重庆医科大学实验动物中心提供,饲养于恒温(25~27 ℃)、恒湿(45%~50%),符合无特定病原(SPF)的独立换气净化笼具(individually ventilated cages, IVC)环境中。
1.2 材料及其试剂RPMI 1640培养基和胎牛血清购于Hyclone公司;链霉素、青霉素购于Sigma公司;RNA提取试剂盒Trizol购于Invitrogen公司;M-MLV逆转录酶,Real-time PCR试剂盒购于Takara公司;引物由Invitrogen公司合成。苏木素伊红(HE)染色试剂盒购于碧云天公司,其他试剂均为国内分装或国产分析纯。
1.3 实验方法 1.3.1 小鼠黑色素瘤模型的建立及分组采用RPMI 1640培养基(Gibco公司),含10%的胎牛血清(Hyclone公司),常规培养于含5% CO2的37 ℃孵箱中,收集对数生长期的细胞,用配成单个的细胞悬液并调节细胞数量为1× 106/100μl,1%戊巴比妥钠麻醉后,将小鼠右侧颈背部鼠毛剃掉,75%乙醇消毒后,无菌条件下在小鼠右颈背部皮下注射100 μl瘤细胞悬液,建立小鼠黑色素瘤模型。7~10 d后可扪及皮下结节,待肿瘤最长径长至7~10 mm时进行实验,随机分成假照组和HIFU组,每组40只。
1.3.2 HIFU辐照及其治疗过程[7-9]CZF型聚焦超声波治疗仪,由重庆海扶医疗科技股份有限公司研制,该系统包括主机,超声换能器和治疗探头。治疗头频率为0.94 MHz,功率为4.5 W,焦距6~8 mm,输出调制后为连续扫描模式。其利用超声波作能源,从体外分散发射多束超声波,再通过超声换能器的凹球面进行自聚焦在一个点上,通过热能转化,形成一个高能治疗点,进而杀死肿瘤细胞。治疗过程:荷瘤鼠去毛备皮,用1%戊巴比妥钠按照腹腔注射麻醉,麻醉显效后,采用循环脱气水作声耦合剂,开启功率源,采用点扫描,以“点-面-体”的方式,由深至浅逐渐覆盖整个肿瘤组织扫描扫描范围包括肿瘤边缘2 mm内,1次治疗时间为10 s,间隔时间10 s,总治疗时间约120 s。假照组治疗程序与HIFU组治疗相同,但功率源开关关闭,时间同样为120 s(图 1)。
|
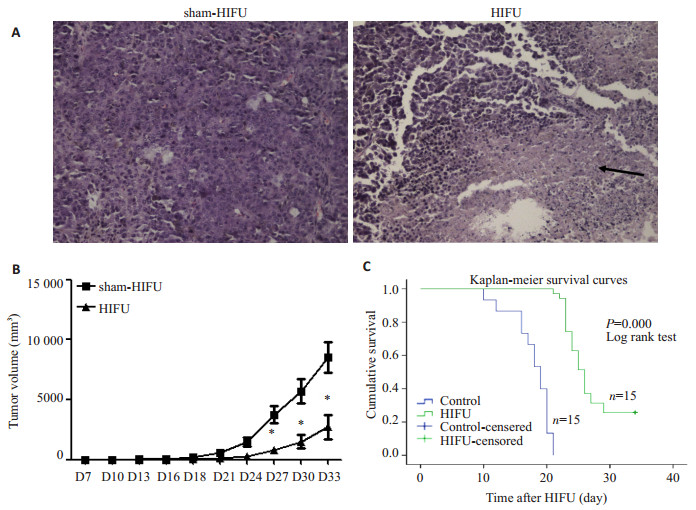
图 1 HIFU处理对荷瘤鼠大体生存指标的影响 Figure 1 Effect of HIFU on survival of the melanoma-bearing mice. A: HE staining of the tumor tissue in the two groups (Original magnification: ×200); B: Tumor growth curves in the mouse model; C: Cumulative survival curves in the two groups. |
HIFU治疗后14 d,取HIFU组和假照组的两组小鼠各10只,尾静脉注射100 μl B16-F10细胞悬液(1×106个细胞),再次接种肿瘤细胞。尾静脉注射后第7天颈椎脱臼法处死小鼠,剥离肺组织并计数肺表面转移结节总数,计算肿瘤转移抑制率。肿瘤转移抑制率=(假照组平均转移结节数-HIFU组平均转移结节数)/假照组平均转移结节数×100%。
1.3.4 肿瘤生长曲线记录所有小鼠在细胞接种后1周左右可扪及明显皮下瘤,用数码游标卡尺测量肿瘤长径(a,mm),短径(b,mm),每3 d 1次,按照公式V=a*b2* 0.5计算体积大小,待肿瘤最长径长至7~10 mm时进行辐照,治疗后继续每3 d 1次测量肿瘤体积。
1.3.5 肿瘤组织的包埋、固定、切片及HE染色将两组各15只自然死亡后不久较新鲜的小鼠肿瘤组织放入4%的福尔马林液中固定24 h,经80%、90%、100%乙醇脱水后,置于60 ℃蜡盒内浸蜡,包埋后切片,切片流水洗2 min,蒸馏水洗1 min;哈里斯苏木紫染5~7 min,水洗2 min;0.5%盐酸分化至细胞核染色清晰,水洗,并浸于水中至核变蓝;伊红液染色3 min,水洗30 s~1 min;80%乙醇浸洗7 s、90%乙醇、无水乙醇I、无水乙醇II浸洗1 min;二甲苯浸洗5 min。中性树胶封片。
1.3.6 全血RNA提取及逆转录取HIFU或者假照处理后即刻(5只)、7 d(5只)和14 d(5只)小鼠用1%戊巴比妥钠腹腔麻醉,采用小鼠眼球摘除法取小鼠全血样本,用柠檬酸钠作为抗凝剂。为避免血液样本被毛发、皮肤污染,弃去第一滴血液,收集余下的血液,采用Trizol法(Invitrogen)提取全血的总RNA,分光光度计法测量RNA的浓度和纯度,凝胶电泳鉴定RNA的完整性。取1ug RNA按照Takara逆转录试剂盒说明书,用随机引物逆转录合成cDNA。
1.3.7 实时荧光定量PCR以上述各组小鼠血液的cDNA为模版,采用SYBR Green I染料法,以GAPDH为内参基因,对于全血中黑色素瘤细胞的三个标志物的相对表达量进行检测,它们分别是黑色素瘤相关抗原A3(MAGE-A3),T细胞1识别的黑色素瘤抗原(MART1)以及同源转化成对框基因转录因子(PAX3)。按照试剂说明书配好反应体系,上机(Bio-rad)进行real-time PCR扩增和检测。反应体系: premix SYBR Green I荧光反应液10 μl,上下游引物各0.8 μl,样品模板2 μl,用灭菌水补足20 μl体系。PCR扩增反应条件:95 ℃预变性3 min,循环内95 ℃变性10 s,52 ℃退火30 s,延伸70 ℃ 30 s。PCR反应设置40个循环,并在每个循环延伸末端点收集荧光信号,绘制扩增曲线;并且对65 ℃到95 ℃升温整个过程进行全程荧光信号收集,绘制融解曲线。MAGE-A3正向引物序列为GATGACTGATGTCCAGGGTATGC,反向引物序列为GCACAAAC TCCTCAGAGATGAGC;MART-1正向引物序列为CTGCTTATCGGCTGCTGGTA,反向引物序列为ACGGGCTGATGGGATTTCT,PAX3正向引物序列为CCAACCATATCCGCCACAA,反向引物序列为TCTTAGAGACGCAACCATGGG,内参GAPDH正向引物序列为GGCTGCCCAGAACATCAT,反向引物序列为CGGACACATTGGGGGTAG。
1.3.8 统计学分析采用SPSS 17.0软件进行统计分析,各实验均独立重复3次,符合正态分布的计量资料用均数±标准差表示,两组间比较采用t检验分析,不符合正态分布的用非参数检验,α=0.05为检验水准。
2 结果 2.1 HIFU处理延长小鼠生存期。两组小鼠各15只分别按上述实验方法(1.3.2)进行处理。HIFU组小鼠在辐照后1 d反应迟钝,毛蓬乱无光泽, 进食量减少,随后逐渐正常,而假照组小鼠全程无异常。取肿瘤组织HE染色可见,如图 1A所示,假照组肿瘤组织仍可见典型的肿瘤形态:肿瘤细胞大小不一,形态多样,呈圆形、梭形或多角形,细胞核深染,细胞质较少。HIFU组肿瘤组织辐照靶区内大部分细胞结构消失、相互融合成均质红染片状物,可见中性粒细胞浸润。
两组小鼠皮下瘤体积在HIFU处理后即刻并无明显差异,但从HIFU后第20天开始出现显著差异(P < 0.05,n=15),HIFU组瘤体积明显小于假照组,如图 1B所示。从生长曲线也可以看出,HIFU处理后小鼠皮下瘤体积增长速度明显变慢。
采用Kaplan-Meier法计算出两组小鼠的生存率。各组中位生存时间及95%可信区间(CI)分别为:假照组19.00 d和17.14~20.86 d,HIFU组26.00 d和24.76~27.25 d。采用Log-rank检验比较生存曲线(图 1C),结果显示两组生存曲线的差异有显著性(P < 0. 001,n=15),HIFU组生存率高于假照组。
2.2 HIFU处理降低黑色素瘤的肺转移在小鼠B16-F10黑色素瘤皮下移植瘤模型中,假照组15只荷瘤小鼠有3只发现肉眼可见的肺转移结节,转移率20%(3/15);HIFU组15只荷瘤小鼠中仅1例有肉眼可见转移灶,转移率为6.7%(1/15)。
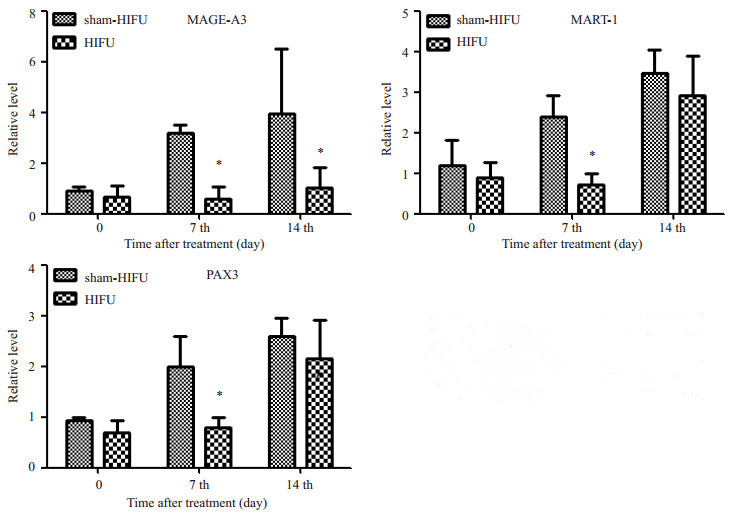
2.3 HIFU处理减少小鼠血循环中黑色素瘤细胞的数目为了研究HIFU辐照对黑色素瘤细胞转移的前期步骤(即脱离原发灶进入血流的过程)有无影响,我们分别在HIFU后即刻、HIFU后7 d和HIFU后14 d分别取各组小鼠全血,每组每个时间点5只小鼠,检测各组小鼠血液中黑色素瘤的3个代表性标志物MAGE-A3、MART1和PAX3的表达量,以监测入血的循环黑色素瘤细胞数目。实时荧光定量PCR结果如图 2所示:在辐照后即刻,3个标志物的相对表达量无明显差异;随着病程的进展,假照组的循环黑色素瘤细胞在明显增加,HIFU处理组也有增加,但是相对缓慢。其中,在辐照后第7天,HIFU组这3个标志物都显著低于假照组(P < 0.05);在辐照后第14天的HIFU组的MAGE-A3依然明显低于假照组(P < 0.05),其余两个指标也依然低于假照组,但无统计学意义。
|
图 2 HIFU处理对血液中循环黑色素瘤细胞的三个标志物的影响 Figure 2 Effect of HIFU treatment on the levels of the 3 markers for circulating melanoma cells detected by qRT-PCR. |
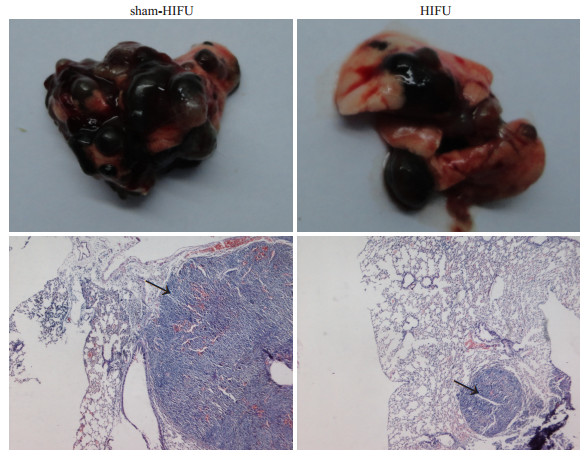
在HIFU处理后14 d通过尾静脉注射B16-F10细胞,观察HIFU辐照组中癌细胞在肺部定植能力的改变。在尾静脉注射后第7天,处死并解剖小鼠,取出肺脏,肉眼可见两组小鼠肺部均有黑色转移灶(图 3)。假照组小鼠肺表面的黑色点状转移结节数为45.8±7.6/鼠,HIFU组的转移结节数26.4±6.6/鼠,其差异有显著性(P < 0.05,n=10);之前的HIFU辐照对新移植的B16-F10细胞肺转移部定植能力的抑制率为42.4%。
|
图 3 B16-F10细胞在HIFU处理过的荷瘤小鼠体内肺部定植形成转移灶的能力降低 Figure 3 Effect of HIFU treatment on colonization of retransplanted B16-F10 cells in the lung tissue to form pulmonary metastases. Upper: Gross observation of the lungs of mice after intravenous inoculation of B16-F10 melanoma cells; Lower: Histological sections of the lungs (arrows indicate the metastasis nodules) (Original magnification: ×40). |
HIFU是利用超声发生器分散发射高能超声波,并在体内将超声波能量聚焦在选定的脏器组织区域内,在焦点区域形成瞬间高温,从而杀灭肿瘤而周围组织极少或不受损伤[10]。以其产生的热效应、空化效应、机械效应等多种生物学效应机制,在肿瘤治疗方面正引起越来越广泛的注意。HIFU引起肿瘤组织的病理改变以凝固性坏死为主,同时伴有细胞的变性和凋亡[11-12]。此外,辐照后的肿瘤细胞表面抗原暴露能够刺激宿主免疫,增加宿主抗肿瘤能力,这是目前其他治疗方式所不能比拟的[13]。并且,体外研究表明聚焦超声可抑制细胞的迁移和粘附能力[14]。但对活体内肿瘤转移情况的影响研究不多。
肿瘤转移是一个连续渐进的多因素多步骤动态的过程,其基本过程为:原发灶肿瘤细胞大量增殖;肿瘤细胞从原发灶脱落,侵袭基底膜,进而侵入血管、淋巴管或体腔;少数肿瘤细胞在循环系统中存活,随血流、淋巴流迁移到另一远隔部位或器官;肿瘤细胞与靶器官的毛细血管壁发生黏附,穿出血管形成微小转移灶,形成与原发瘤同样类型的继发瘤[15]。
在本研究中,我们在小鼠B16-F10黑色素瘤皮下瘤模型中发现HIFU治疗能在一定程度上抑制自发性转移的发生率,但是由于皮下瘤自发性转移的发生率不高,可能并未能完全体现辐照后的治疗作用;同时,肿瘤转移这一生物学现象是个多步骤多因素的连续过程,因此我们将HIFU治疗对恶性黑色素瘤细胞转移能力的影响采用以下两个方法来进一步验证:(1)HIFU辐照对黑色素瘤细胞从原发部位脱落进而入血流这个生物学过程有无影响;(2)HIFU辐照对已经脱离了原发灶进入血流的瘤细胞在肺部定植形成转移灶的能力有无影响。
近年来,随着对循环肿瘤细胞研究的深入,循环肿瘤细胞用来辅助肿瘤早期诊断实时监测治疗效果指导个体化治疗和早期发现肿瘤复发转移及判断肿瘤的预后成为研究热点[16-18]。我们选用3个黑色素瘤特异性的标记分子来监测血液中循环黑色素瘤细胞,它们是MART1、MAGE-A3和PAX3。MART1是分化抗原,仅表达于黑色素细胞和黑色素瘤细胞。MAGE-A3是肿瘤特异性抗原,它们特异性地表达于肿瘤细胞,而不表达于正常组织(除睾丸外)。PAX3在正常的皮肤细胞、痣和黑色素瘤细胞中均有表达,在黑色素母细胞的分化、迁移、增殖以及进一步分化成黑色素细胞的过程中均起到了重要的作用[19],因此又被称成为黑色素细胞特异因子[20];另外,PAX3在黑色素细胞瘤和痣中的表达量远高于正常皮肤细胞,PAX3已经作为黑色素细胞瘤的一种鉴别的标记蛋白[21]。我们发现HIFU组这3个标志物的水平明显降低,这可能是因为:(1)大部分原发灶的肿瘤细胞在接受HIFU辐照后凝固性坏死,直接减少了机体肿瘤的总负荷;(2)坏死后的肿瘤细胞释放出多种危险信号,如ATP和HSP60等[22],激活机体的局部特异性抗肿瘤免疫反应,细胞毒淋巴细胞通过穿孔素/颗粒酶、FasL两大途径诱导未死亡的肿瘤细胞出现凋亡[23-24],又进一步减少了机体内的肿瘤细胞负荷,进而减少残存肿瘤细胞脱离原发灶。
HIFU处理之后,尾静脉注射相同肿瘤细胞以模拟转移现象的后半部分,发现辐照治疗后血循环中的肿瘤细胞在肺部定植形成肉眼可见转移灶的能力有所降低(图 3)。这可能是因为HIFU辐照后诱发机体的特异性抗肿瘤免疫,对于同种肿瘤细胞的再次刺激有一定的抵抗力,例如可诱发针对同源肿瘤细胞的特异性细胞毒T淋巴细胞(CTL),进而激发细胞介导的抗肿瘤免疫反应[25-28],将循环中的瘤细胞破坏;也不能排除HIFU后肺局部变得不利于瘤细胞的定植。真正的机制有待下一步的实验来证实。
综上,我们在小鼠B16-F10黑色素瘤模型中对转移的两个步骤的研究都表明HIFU处理能减少原发灶残留的瘤细胞的脱落入血和减少血循环中瘤细胞在肺部的定植。因此,HIFU处理除可以直接破坏瘤细胞外,还可减少残留癌细胞的远隔器官转移,为临床上推广应用HIFU治疗黑色素瘤提供了有力的实验依据。
| [1] | 郭军. 恶性黑色素瘤治疗的新进展[J]. 临床肿瘤学杂志,2007, 12 (12) : 881-4. |
| [2] | Markovic SN, Erickson LA, Rao RD, et al. Malignant melanoma inthe 21st century, part 2: staging, prognosis, and treatment[J]. Mayo Clin Proc,2007, 82 (4) : 490-513. DOI: 10.4065/82.4.490. |
| [3] | Markovic SN, Erickson LA, Rao RD, et al. Malignant melanoma in the 21st century, part 1: epidemiology, risk factors, screening, prevention, and diagnosis[J]. Mayo Clin Proc,2007, 82 (3) : 364-80. DOI: 10.1016/S0025-6196(11)61033-1. |
| [4] | 毛英, 方廖琼, 刘隆兴, 等. 高强度聚焦超声联合吉西他滨对裸鼠胰腺癌皮下移植瘤的疗效[J]. 南方医科大学学报,2013 (12) : 1713-7. |
| [5] | Blana A, Walter B, Rogenhofer S, et al. High-intensity focused ultrasound for the treatment of localized prostate cancer: 5-year experience[J]. Urology,2004, 63 (2) : 297-300. DOI: 10.1016/j.urology.2003.09.020. |
| [6] | Ge HY, Miao LY, Xiong LL, et al. High-intensity focused ultrasound treatment of late-stage pancreatic body carcinoma: optimal tumor depth for safe ablation[J]. Ultrasound Med Biol,2014, 40 (5) : 947-55. DOI: 10.1016/j.ultrasmedbio.2013.11.020. |
| [7] | 夏纪筑, 冉立峰, 谢方林, 等. 高强度聚焦超声治疗后荷瘤鼠脾淋巴细胞的免疫治疗作用[J]. 中国超声医学杂志,2012, 28 (1) : 13-6. |
| [8] | 谢勋鹏, 冉立峰, 伍烽, 等. 高强度聚焦超声治疗后荷瘤鼠的免疫变化及特异性抗肿瘤作用[J]. 中国免疫学杂志,2008, 24 (4) : 320-3. |
| [9] | Mao Y, Fang L, Ai L, et al. An in vivo study of the effects on serum glucose, amylase and histopathology of the feline pancreatic tissue treated by focused ultrasound[J]. PLoS One,2014, 9 (2) : e88815. DOI: 10.1371/journal.pone.0088815. |
| [10] | 李传行, 徐国良, 黎建军, 等. 高强度聚焦超声在肿瘤治疗中的应用[J]. 癌症,2002, 21 (3) : 333-5. |
| [11] | Wu F, Chen WZ, Bai J, et al. Pathological changes in human malignant carcinoma treated with high-intensity focused ultrasound[J]. Ultrasound Med Biol,2001, 27 (8) : 1099-106. DOI: 10.1016/S0301-5629(01)00389-1. |
| [12] | Kennedy JE. High-intensity focused ultrasound in the treatment of solid tumours[J]. Nat Rev Cancer,2005, 5 (4) : 321-7. DOI: 10.1038/nrc1591. |
| [13] | Wu F, Zhou L, Chen WR. Host antitumour immune responses to HIFU ablation[J]. Int J Hyperthermia,2007, 23 (2) : 165-71. DOI: 10.1080/02656730701206638. |
| [14] | Alter A, Rozenszajn LA, Miller HI, et al. Ultrasound inhibits the adhesion and migration of smooth muscle cells in vitro[J]. Ultrasound Med Biol,1998, 24 (5) : 711-21. DOI: 10.1016/S0301-5629(98)00030-1. |
| [15] | Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges[J]. Nat Med,2006, 12 (8) : 895-904. DOI: 10.1038/nm1469. |
| [16] | Bonnomet A, Brysse A, Tachsidis A, et al. Epithelial-to-mesenchymal transitions and circulating tumor cells[J]. J Mammary Gland Biol Neoplasia,2010, 15 (2) : 261-73. DOI: 10.1007/s10911-010-9174-0. |
| [17] | Hou JM, Krebs M, Ward T, et al. Circulating tumor cells as a window on metastasis biology in lung cancer[J]. Am J Pathol,2011, 178 (3) : 989-96. DOI: 10.1016/j.ajpath.2010.12.003. |
| [18] | 乔媛媛. 循环肿瘤细胞及其与肿瘤转移复发的相关性研究[J]. 现代肿瘤医学,2011, 19 (9) : 1877-80. |
| [19] | Medic S, Ziman M. PAX3 across the spectrum: from melanoblast to melanoma[J]. Crit Rev Biochem Mol Biol,2009, 44 (2/3) : 85-97. |
| [20] | Galibert MD, Yavuzer U, Dexter TJ, et al. Pax3 and regulation of the melanocyte-specific tyrosinase-related protein-1 promoter[J]. J Biol Chem,1999, 274 (38) : 26894-900. DOI: 10.1074/jbc.274.38.26894. |
| [21] | Medic S, Ziman M. PAX3 expression in normal skin melanocytes and melanocytic lesions (naevi and melanomas)[J]. PLoS One,2010, 5 (4) : e9977. DOI: 10.1371/journal.pone.0009977. |
| [22] | Hu Z, Yang XY, Liu Y, et al. Release of endogenous danger signals from HIFU-treated tumor cells and their stimulatory effects on APCs[J]. Biochem Biophys Res Commun,2005, 335 (1) : 124-31. DOI: 10.1016/j.bbrc.2005.07.071. |
| [23] | 朱学强, 伍烽, 周强, 等. 高强度聚焦超声治疗乳腺癌的机理研究[J]. 四川医学,2004, 25 (9) : 971-3. |
| [24] | 罗文, 周晓东, 巩萧音, 等. HIFU消融后兔肝细胞凋亡与增殖的研究[J]. 中国超声医学杂志,2007, 23 (4) : 250-2. |
| [25] | Van Leenders GJ, Beerlage HP, Ruijter ET, et al. Histopathological changes associated with high intensity focused ultrasound (HIFU) treatment for localised adenocarcinoma of the prostate[J]. J Clin Pathol,2000, 53 (5) : 391-4. DOI: 10.1136/jcp.53.5.391. |
| [26] | Chan T, Chen Z, Hao S, et al. Enhanced T-cell immunity induced by dendritic cells with phagocytosis of heat shock protein 70 genetransfected tumor cells in early phase of apoptosis[J]. Cancer Gene Ther,2007, 14 (4) : 409-20. DOI: 10.1038/sj.cgt.7701025. |
| [27] | Wu F, Wang ZB, Cao YD, et al. Expression of tumor antigens and heat-shock protein 70 in breast cancer cells after high-intensity focused ultrasound ablation[J]. Ann Surg Oncol,2007, 14 (3) : 1237-42. DOI: 10.1245/s10434-006-9275-6. |
| [28] | Madersbacher S, Gröbl M, Kramer G, et al. Regulation of heat shock protein 27 expression of prostatic cells in response to heat treatment[J]. Prostate,1998, 37 (3) : 174-81. DOI: 10.1002/(ISSN)1097-0045. |
 2015, Vol. 35
2015, Vol. 35
