2. 复旦大学附属儿科医院临床检验中心, 上海 201102 ;
3. 昆明医科大学第一附属医院康复科, 云南 昆明 650032
2. Clinical Laboratory Center, Children's Hospital of Fudan University, Shanghai 201102, China ;
3. Department of Rehabilitation, First Affiliated Hospital of Kunming Medical University, Kunming 650032, China
内毒素又称脂多糖(lipopolysaccharide, LPS),是革兰阴性菌细胞壁主要成分,可引起人或动物内毒素血症,并诱发感染性休克[1],导致多器官损害及功能衰竭。内毒素血症是重症监护危重病人死亡的主要原因之一,而心脏是内毒素血症时最常受累器官之一[2-3],但内毒素血症时心肌损伤的具体作用机制目前并不十分清楚。
miRNA是生物体内长度约为19~25个核苷酸的非编码小RNA,在心血管发育,心肌梗死,心肌肥大和心肌纤维化等心血管疾病中起重要作用,被认为是心血管功能关键调节者及心血管疾病预防、诊断和治疗的潜在靶标[4-6]。
因此,本研究应用分子生物技术分析内毒素血症大鼠心肌组织miRNA表达谱的变化,旨在为后续研究miRNA在内毒素血症心肌损伤中的作用奠定实验基础。
1 材料与方法 1.1 材料健康雄性SD大鼠20只,体质量250~280 g(SPF级,由昆明医科大学实验动物中心提供)。脂多糖(LPS,Escherichia coli 0111:B4)和M-MLV反转录酶购自Sigma,Trizol Reagent购自Invitrogen,PolyA聚合酶购自美国NEB,RiboLockTM RNase inhibitor购自Thermo Fisher Scientific,dNTP(10 mmol/L)购自大连TAKARA。
1.2 方法 1.2.1 动物分组及实验模型制作20只健康雄性SD大鼠随机分为对照组(n=10)和LPS组(n=10)。LPS组每只大鼠按照体质量(kg)腹腔注射LPS10 mg/kg,对照组腹腔注射同等剂量的生理盐水[7]。给予LPS后24 h颈椎脱臼处死大鼠,无菌手术取心脏组织。每只大鼠的心脏组织分为2份,一份经过修剪后放置于2.5%戊二醛固定液(电镜专用)中4 ℃保存,用于透射电镜观察(复旦大学上海医学院电镜室提供);另一份置于1.5 ml EP管中,-80 ℃保存,用于总RNA提取。
1.2.2 透射电镜生物样品准备颈椎脱臼处死大鼠,暴露所需组织后,快速用锋利剪刀剪下一小块组织,立即浸润在固定液内休整,用刀片从非剪切面端(因为剪切面端有心肌细胞损伤)开始,把组织剪切成薄片,再切成4~5小块,样品组织块不超过1 mm3。用牙签或镊子轻轻挑起组织块转移至预冷的固定液内,送往电镜室观察。休整应在2~3 min内完成。
1.2.3 心肌组织总RNA提取将适量心肌组织敲碎后加入1 ml Trizol,使用匀浆器在冰上充分研磨,4 ℃冰箱内放置15 min。每1 ml Trizol中加200 ml氯仿,上下颠倒混匀使之充分混合,室温放置2~3 min,4 ℃ 12 000 g离心15 min;吸取上层水相转移到新EP管中,加入500 μl异丙醇,-20 ℃冰箱内放置15 min沉淀RNA,4 ℃ 12 000 g离心10 min,弃上清,此时可见白色斑状RNA沉于管底。用75%乙醇(DEPC水配置)洗涤沉淀,4 ℃ 7500 g离心5 min,弃上清,并重复洗涤1次。RNA沉淀在室温干燥10~20 min后加入DEPC水溶解RNA,使用Nanodrop ND-1000测定RNA浓度。1%的琼脂糖凝胶电泳证实RNA无降解,反转后用于TLR4、TNF-α、IL-1β及miRNA表达检测。
1.2.4 miRNA表达谱分析利用Exiqon公司的LNATM microRNA Array检测LPS组及正常对照组心肌组织miRNA表达情况。为保证结果的重复性和可靠性,每组取3个样本进行微阵列芯片杂交。用Significance Analysis of Microarrays(SAM, version3.0)软件对芯片数据进行分析,再以FDR控制在5%以内,Fold change大于2或小于0.5为筛选条件挑选出差异表达miRNA,并进行数据分类及整理。
1.2.5 miRNA表达水平检测(1)总RNA的加尾反应:为了检测miRNA的表达水平,首先利用E.coli polyA聚合酶(NEB)为1.0 μg的总RNA进行加尾反应,冰上配置反应混合液,37 ℃孵育20 min;(2)总RNA反转录:紧接上一步加尾反应后,在原管中加入2 μl mid TRT反转录引物(1 μg/μl);70 ℃加热5 min,立即放于冰上2 min;依次加入: 5 × MMLV buffer(Promega),20.0 μl;dNTP(10 mmol/L,TAKARA),1.0 μl;ImPromII(Promega),1.5 μl;RNase inhibitor(Thermo),0.5 μl;RNase Free H2O 77 μl。轻轻混匀后,30 ℃,15 min;37 ℃,15 min;42 ℃,30 min;然后置80 ℃,5 min。参考文献[8-9],利用加尾法为miRNA设计反转录引物及定量PCR的上下游引物,并利用普通PCR的方法检测miRNA的引物特异性;(3)实时荧光定量PCR检测miRNA表达:以U6为内参,使用ABI7500定量PCR仪,按照TAKARA的SYBR Green实时荧光定量PCR法检测相应miRNA的相对表达水平。反应条件如下:95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,40个循环。反应结束后,首先观察溶解曲线,判断PCR特异性。以2-△ △ CT作为计算公式,计算miRNA的相对表达量。
1.2.6 统计分析使用SPSS17.0软件进行统计处理,计量资料以均数±标准差表示,两组间比较采用student's t检验。以P < 0.05为差异有统计学意义。
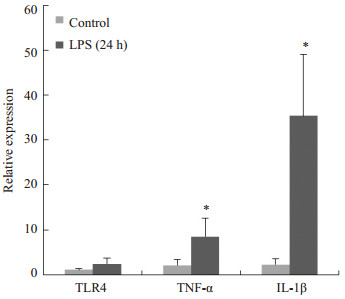
2 结果 2.1 内毒素血症大鼠心肌组织中TLR4、TNF-α、IL-1β的表达水平LPS释放入血后,可诱导巨噬细胞、树突状细胞释放TLR4、TNF-α、IL-1β等炎性因子。这些细胞因子能够导致炎症,过度的炎症反应可引起全身炎症反应综合症(systemic inflammatory respome syndrome, SIRS)的发生,导致多脏器功能障碍。Real-time PCR结果显示,与注射生理盐水的对照组大鼠相比,LPS腹腔注射24 h大鼠心肌组织中TLR4、TNF-α、IL-1β的表达水平均明显升高,尤其是TNF-α、IL-1β,差异具有显著性(图 1),提示内毒素血症大鼠模型构建成功。
|
图 1 内毒素血症大鼠心肌组织中TLR4、TNF-α、IL-1β表达变化 Figure 1 Expression levels of TLR4, TNF-α and IL-1β in the myocardial tissue in rats with endotoxemia (24 h). Compared with the control group, *P < 0.05. |
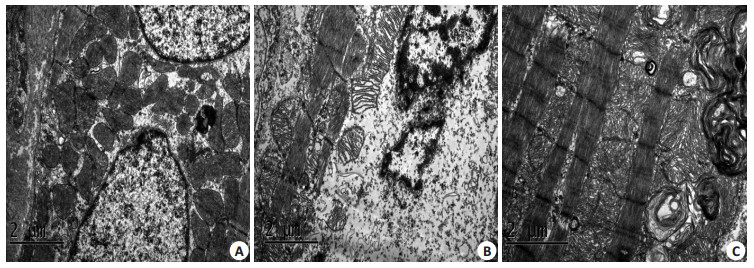
透射电子显微镜下观察LPS处理24 h大鼠心肌组织超微结构变化,结果显示:与对照相比,LPS组大鼠心肌细胞胞核肿胀,核膜不光滑;胞质中线粒体发生明显水肿,线粒体嵴排列紊乱,部分线粒体膜破坏;自噬泡增多(图 2)。
|
图 2 内毒素血症大鼠心肌组织超微结构变化 Figure 2 Ultrastructural changes of the myocardial tissue in rats with endotoxemia (2 μm, original magnification: ×10 000). A: Myocardium of rats in control group; B, C: Myocardium of rats in LPS group. |
miRNA差异表达分析显示:与正常对照组相比,LPS组大鼠心肌组织中共筛选出79个差异表达显著的miRNA(Fold change大于2或小于0.5),其中52个为上调miRNA,27个为下调miRNA。按照差异倍数由高到低排序后,挑选出LPS组心肌组织中上调最明显的10个miRNA,分别为miR-194-3p,miR-21-3p,miR-344a-3p,miR-465-3p,miR-501-5p,miR-3596c,miR-185-3p,miR-186-3p,miR-877,miR-3592;并挑选出下调最明显的10个miRNA,包括miR-208b-3p,miR-547-3p,miR-141-3p,miR-28-5p,miR-335,miR-199a-5p,miR-322-5p,miR-3585-5p,miR-532-5p,miR-339-3p(表 1)。
| 表 1 内毒素血症大鼠心肌组织差异表达显著的miRNA Table 1 Significant differential expression of miRNAs in the myocardial tissue in rats with endotoxemia |
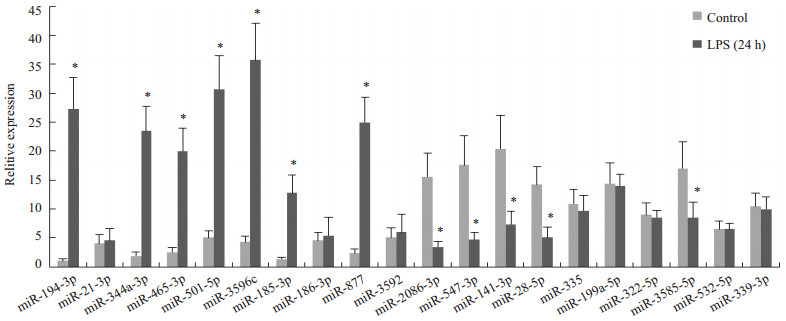
Real-time PCR结果显示:在筛选出的20个候选miRNA中,有12个miRNA(包括7个上调miRNA和5个下调miRNA)在正常对照组与LPS组心肌组织中的表达量确实存在显著性差异,提示这12个miRNA可能与LPS致心肌损伤的作用相关;其余8个候选miRNA的定量PCR结果与芯片结果并不一致,在实验组与对照组间差异无显著性(图 3)。
|
图 3 内毒素血症大鼠心肌组织中候选miRNA表达水平 Figure 3 Verification of the expressions of selected miRNAs in the myocardium of rats with endotoxemia. Compared with the control group, *P < 0.05. |
内毒素血症是临床常见危重病症,可以出现在多系统的多种疾病中,通常导致致死性感染性休克、多器官功能衰竭(MODS)、弥漫性血管内凝血(DIC)等,病死率极高[10]。内毒素血症并发MODS时,心脏往往受累,直接影响患者预后[11-12]。因此,防治内毒素性心肌损伤对降低内毒素血症患者的死亡率具有十分重要的意义。然而,内毒素血症心肌损伤发病机制十分复杂,限制了其临床治疗方法的进展。因此,寻找各种有效的研究策略,加强对内毒素血症患者心肌损伤机制的了解,变得至关重要。
LPS为革兰氏阴性细菌细胞壁的主要成分,是内毒素血症时引发心肌损害和心功能障碍的重要病因[1]。研究表明LPS可与血浆内毒素结合蛋白结合,激活CD14和Toll样受体4(TLR4),而产生TNF-α、IL-1β、IL-6等炎症细胞因子,引起心脏炎症反应,直接导致心肌结构损害[13-15]。我们的研究结果显示:内毒素血症大鼠心肌细胞出现胞质空泡,线粒体水肿、结构破坏;心肌组织中TLR4、TNF-α、IL-1β表达水平均明显高于对照组大鼠。这些结果提示心肌细胞损伤和线粒体结构破坏可能与TLR4、TNF-α、IL-1β的作用有关。
众所周知,线粒体不仅为生理活动提供能量,还参与调控许多重要的细胞过程,如信号传导,细胞分化、生长和凋亡,钙稳态及活性氧产生等[16-17]。因此,若其形态结构完整性破坏,可导致线粒体功能障碍,进而引起各种疾病的发生。由此,我们推测:心肌线粒体结构破坏导致心肌能量代谢障碍和活性氧产生,以及TLR4介导产生大量TNF-α、IL-1β引起心脏炎症反应,可能是本研究中内毒素血症时心肌损伤发生的重要原因,但这一系列反应背后的调控机制仍需探索。
miRNA是生物体内长度约为19~25个核苷酸的非编码小RNA分子,通过与靶基因3'UTR区结合,可抑制mRNA的翻译或促进mRNA降解[18-19]。新近研究证明miRNA作为心脏和血管结构和功能的重要调控者,在心脏发育及多种病理过程中发挥重要作用[4-6]。本研究通过探索内毒素血症大鼠心肌组织中miRNA表达变化,力图寻找与内毒素性心肌损伤密切相关的miRNA,从而揭示内毒素血症心肌损伤的潜在机制。我们通过miRNA芯片初步筛选了内毒素血症大鼠心肌组织中表达差异显著的miRNA。芯片结果显示,内毒素血症大鼠心肌组织中2倍以上显著上调的miRNA有52个,2倍以上显著下调的miRNA有27个,提示与正常心肌组织相比,内毒素性损伤心肌组织具有独特的miRNA表达谱,也说明了miRNA可能参与了内毒素血症心肌损伤的发生机制。进一步,我们利用实时定量PCR对候选miRNA进行扩大样本验证,证实12个候选miRNA在内毒素损伤心肌组织中表达量具有显著差异,包括7个上调miRNA:miR-194-3p,miR-344a-3p,miR-465-3p,miR-501-5p,miR-3596c,miR-185-3p,miR-877;5个下调miRNA:miR-208b-3p,miR-547-3p,miR-141-3p,miR-28-5p,miR-3585-5p。
其中,表达量明显升高的miR-194已有研究报道为P53响应miRNA,可作为急性心肌梗死后心力衰竭的预测指标[20]。另外,Sellier等[21]研究指出miR-185可能与先天性心脏病圆锥动脉干畸形的发生相关。此外,在下调的miRNA中,已有报道miR-141在糖尿病心肌病中参与调控线粒体磷酸盐载体蛋白Slc25a3的表达,进而影响线粒体能量的产生[22]。Bostjancic等[23]通过对MI患者梗死区心肌组织研究发现miR-208可能参与了梗死区域的心室重构。
除了上述4种在心血管疾病中作用明确的miRNA外,其余8个miRNA在心血管疾病中的作用机制尚未见相应研究。且这12个miRNA是否参与了内毒素血症心肌损伤的发生发展,目前均未见相关报道。因此,有必要进一步对筛选出的差异表达miRNA进行功能学探索,为内毒素血症心肌损伤的发病机制研究以及预防和治疗提供新的途径。
| [1] | Lin WJ, Yeh WC. Implication of toll-like receptor and tumor necrosis factor alpha signaling in septic shock[J]. Shock,2005, 24 (3) : 206-9. DOI: 10.1097/01.shk.0000180074.69143.77. |
| [2] | Beraud AS, Guillamet CV, Hammes JL, et al. Efficacy of transthoracic echocardiography for diagnosing heart failure in septic shock[J]. Am J Med Sci,2014, 347 (4) : 295-8. DOI: 10.1097/MAJ.0b013e318297d616. |
| [3] | Niederbichler AD, Westfall MV, Su GL, et al. Cardiomyocyte function after burn injury and lipopolysaccharide exposure: singlecell contraction analysis and cytokine secretion profile[J]. Shock,2006, 25 (2) : 176-83. DOI: 10.1097/01.shk.0000192123.91166.e1. |
| [4] | Li J, Cao Y, Ma XJ, et al. Roles of miR-1-1 and miR-181c in ventricular septal defects[J]. Int J Cardiol,2013, 168 (2) : 1441-6. DOI: 10.1016/j.ijcard.2012.12.048. |
| [5] | Huang JH, Sun W, Huang H, et al. miR-34a modulates angiotensin II-Induced myocardial hypertrophy by direct inhibition of ATG9A expression and autophagic activity[J]. PLoS One,2014, 9 (4) : e94382. DOI: 10.1371/journal.pone.0094382. |
| [6] | Nishi H, Sakaguchi T, Miyagawa SA, et al. Impact of microRNA expression in human atrial tissue in patients with atrial fibrillation undergoing cardiac surgery[J]. PLoS One,2013, 8 (9) : e73397. DOI: 10.1371/journal.pone.0073397. |
| [7] | 杜小燕, 覃华, 韩艳, 等. 红景天苷对LPS诱导大鼠心肌损伤的保护作用及机制研究[J]. 科学技术与工程,2013, 2 (2) : 281-5. |
| [8] | 张旗, 何湘君, 潘秀英. RNA加尾和引物延伸RT-PCR法实时定量检测microRNA[J]. 北京大学学报:医学版,2007, 39 (1) : 87-91. |
| [9] | Zhang J, Du YY, Lin YF, et al. The cell growth suppressor, mir-126, targets IRS-1[J]. Biochem Biophys Res Commun,2008, 377 (1) : 136-40. DOI: 10.1016/j.bbrc.2008.09.089. |
| [10] | Marshall JC, Foster D, Vincent JL, et al. Diagnostic and prognostic implications of endotoxemia in critical illness: results of the MEDIC study[J]. J Infect Dis,2004, 190 (3) : 527-34. DOI: 10.1086/jid.2004.190.issue-3. |
| [11] | Vieillard-Baron A, Caille V, Charron CA, et al. Actual incidence of global left ventricular hypokinesia in adult septic shock[J]. Crit Care Med,2008, 36 (6) : 1701-6. DOI: 10.1097/CCM.0b013e318174db05. |
| [12] | Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction[J]. Crit Care Med,2007, 35 (6) : 1599-608. DOI: 10.1097/01.CCM.0000266683.64081.02. |
| [13] | Akira S, Takeda K, Kaisho T. Toll-like receptors: critical proteins linking innate and acquired immunity[J]. Nat Immunol,2001, 2 (8) : 675-80. DOI: 10.1038/90609. |
| [14] | Fallach R, Shainberg A, Avlas O, et al. Cardiomyocyte toll-like receptor 4 is involved in heart dysfunction following septic shock or myocardial ischemia[J]. J Mol Cell Cardiol,2010, 48 (6) : 1236-44. DOI: 10.1016/j.yjmcc.2010.02.020. |
| [15] | Carlson DL, Willis MS, White DJ, et al. Tumor necrosis factoralpha-induced caspase activation mediates endotoxin-related cardiac dysfunction[J]. Crit Care Med,2005, 33 (5) : 1021-8. DOI: 10.1097/01.CCM.0000163398.79679.66. |
| [16] | Chen JQ, Cammarata PP, Baines CP. Regulation of mitochondrial respiratory chain biogenesis by estrogens/estrogen receptors and physiological, pathological and pharmacological implications[J]. Biochim Biophys Acta,2009, 1793 (10) : 1540-70. DOI: 10.1016/j.bbamcr.2009.06.001. |
| [17] | Murphy E, Steenbergen C. What makes the mitochondria a killer? Can we condition them to be less destructive[J]. Biochim Biophys Acta,2011, 1813 (7) : 1302-8. DOI: 10.1016/j.bbamcr.2010.09.003. |
| [18] | Sheng Y, Previti C. Genomic features and computational identification of human microRNAs under long-range developmental regulation[J]. BMC Genomics,2011, 12 : 270. DOI: 10.1186/1471-2164-12-270. |
| [19] | Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell,2005, 120 (1) : 15-20. DOI: 10.1016/j.cell.2004.12.035. |
| [20] | Matsumoto S, Sakata Y, Suna S, et al. Circulating p53-responsive microRNAs are predictive indicators of heart failure after acute myocardial infarction[J]. Circ Res,2013, 113 (3) : 322-6. DOI: 10.1161/CIRCRESAHA.113.301209. |
| [21] | Sellier C, Hwang VJ, Dandekar R, et al. Decreased DGCR8 expression and miRNA dysregulation in individuals with 22q11.2 deletion syndrome[J]. PLoS One,2014, 9 (8) : e103884. DOI: 10.1371/journal.pone.0103884. |
| [22] | Baseler WA, Thapa D, Jagannathan R, et al. miR-141 as a regulator of the mitochondrial phosphate carrier (Slc25a3) in the type 1 diabetic heart[J]. Am J Physiol Cell Physiol,2012, 303 (12) : C1244-51. DOI: 10.1152/ajpcell.00137.2012. |
| [23] | Bostjancic E, Zidar N, Stajer D, et al. MicroRNAs miR-1, miR-133a, miR-133b and miR-208 are dysregulated in human myocardial infarction[J]. Cardiology,2010, 115 (3) : 163-9. DOI: 10.1159/000268088. |
 2015, Vol. 35
2015, Vol. 35
