弥漫大B细胞淋巴瘤(DLBCL)是临床常见的非霍奇金淋巴瘤(NHL), 占我国所有淋巴瘤的40.1%[1-2]。化疗是DLBCL的主要治疗方法, 常规化疗多采用环磷酰胺+阿霉素+长春新碱+泼尼松(CHOP)或在此基础上加用利妥苷单克隆抗体(R-CHOP)[1]。由于DLBCL本身的异质性及药物抵抗等导致对化疗反应差异明显, 经规范化疗后仍有40%的患者出现复发或进展[3]。大量临床研究结果证实, DLBCL对18F-FDG明显高摄取, PET/ CT对于疗效评估、预后判断具有重要价值[4], 但在化疗后什么时候进行预后预测一直有争议。国内大多数医生习惯在化疗中期让患者行首次18F-FDG PET/CT进行疗效评价和预后预测, 此时间点是否能可靠地用于预测预后?在化疗中后期进行PET/CT显像预测预后是否更可靠?为探讨化疗中期及中后期首次18F-FDG PET/ CT预测预后的价值, 我们回顾性分析了142例DLBCL患者于化疗中期和化疗中后期的18F-FDG PET/CT结果与无进展生存时间(PFS)及无进展生存率(PFS%)之间的关系, 现将结果报道如下。
1 资料与方法 1.1 病例资料收集2003年5月~2012年9月在本中心接受18F-FDG PET/CT检查的DLBCL患者142例, 男91例, 女51例, 平均年龄48(9~89)岁。病例纳入标准:(1)根据恶性淋巴瘤WHO分型临床诊断为DLBCL的初治患者; (2)已进行3疗程或以上的CHOP或R-CHOP方案规范化化疗。(3)临床资料完整, 在随访期间内未发现其他恶性肿瘤。
根据首次PET/CT检查的时间点将病例分为化疗中期组和化疗中后期组, 化疗中期组为完成3~4个疗程标准化疗后进行PET/CT显像, 化疗中后期组为完成5~8个疗程标准化疗后进行PET/CT显像的患者。化疗中期组71例, 其中, 3疗程28例, 4疗程43例; 化疗中后期组71例, 其中5疗程17例、6个疗程35例、7个疗程4例、8个疗程15例。142例患者中, 有75例在化疗前后均进行了PET/CT显像, 其中化疗中期组34人, 化疗后期组41人。所有患者均进行了临床随访, 随访时间 > 18个月, 随访包括活组织病理学检查、多种影像学检查(包括18F-FDG PET/CT)及临床随访等。
1.2 主要仪器与显像剂显像仪器为美国GE公司Discovery LS PET/CT仪, PET为18环, 层厚4.25 mm, CT为Light Speed 4排螺旋CT。18F-FDG由美国GE公司PETtrace回旋加速器及化学合成模块自动合成, 放化纯 > 95%。
1.3 显像方法及条件患者空腹6 h以上, 平静状态下通过三通管按体质量静脉注射18F-FDG 270~410 MBq, 暗室内静卧约1 h, 排尿后行PET/CT扫描。显像包括CT平扫及PET发射扫描, 显像范围从股骨中段至颅顶, 必要时加扫双下肢, 根据患者身高采集6~8个床位, 层厚为4.25 mm。CT平扫:电压140 kV, 电流160 mA, 螺距0.75, 球管单圈旋转时间0.8 s, 层厚为5 mm; PET发射扫描采用2D采集, 3 min/床位。
1.4 图像重建及融合PET图像重建采用OSEM重建方法, 图像衰减校正采用CT扫描数据。CT采用标准法重建, 重建层厚为4.25 mm, 将PET和CT图像传送到Xeleris工作站, 进行帧对帧图像对位融合。
1.5 图像分析及诊断标准所有PET图像、CT平扫图像和PET/CT融合图像均通过融合软件进行帧对帧对比分析。由2位有PET/ CT诊断经验的影像学医师共同阅片。PET阳性病灶的诊断按照国际淋巴瘤影像诊断小组推荐的标准[4]:病灶部位出现高于周围正常组织的局灶性或弥漫性18F-FDG摄取为阳性, 不必参照SUV。以下情况定义为阴性:(1)中等或较大肿块(≥2 cm)18F-FDG摄取程度≤纵隔血池; (2)肺内≥2 cm的结节18F-FDG摄取≤纵隔血池; (3)化疗后几周内骨髓出现弥漫性18F-FDG摄取。
1.6 临床随访142例DLBCL患者于18F-FDG PET/CT检查后随访18~114个月, 平均28.73个月。根据活组织病理学检查、多种影像学检查(包括18F-FDG PET/CT)及临床随访结果明确是否有肿瘤复发或进展。PFS为从治疗后首次18F-FDG PET/CT检查至首次临床明确有肿瘤复发、进展、死亡或随访结束的时间。
1.7 统计学处理统计学分析使用SPSS13.0, 采用Kaplan-Merier方法进行生存分析, 并对无进展生存率进行χ2检验, 用Log-rank检验进行组间比较, P < 0.05为差异有统计学意义。
2 结果 2.1 PET/CT显像结果142例DLBCL患者治疗后首次18F-FDG PET/CT检查结果为阴性者92例, 阳性者50例。其中化疗中期组PET/CT显像阴性者45例(63.4%), 阳性者26例(36.6%); 化疗中后期组PET/CT显像阴性者47例(66.2%), 阳性者24例(33.8%); 化疗中期组及中后期组18F-FDG PET/CT显像阳性率无显著统计学差异(χ2=12.423, P > 0.05)。
2.2 随访结果随访截止时, 142例DLBCL患者共有66例患者复发和(或)进展, 其中化疗中期组34例, 化疗中后期组32例。全部PET/CT显像阴性的92例中, 24例出现复发和(或)进展; 全部PET/CT显像阳性的50例中, 42例出现复发和(或)进展。化疗中期组, PET/CT显像阴性的45例中, 12例出现肿瘤复发和(或)进展, PET/CT显像阳性的26例中, 22例出现复发和(或)进展。在化疗中后期组, PET/CT显像阴性的47例中, 12例出现肿瘤复发和(或)进展, PET/CT显像阳性24例中, 20例出现肿瘤复发和(或)进展(图 1, 2)。
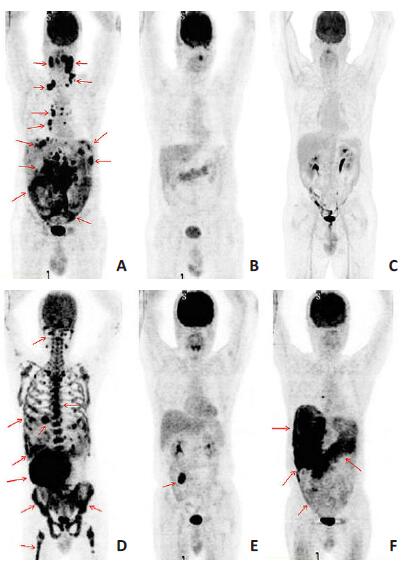
|
图 1 化疗中期组不同PET/CT显像结果患者的图像比较 Figure 1 Negaive and positive PET/CT findings in the interim phase group. A-C and D-F present findings in 2 patients with DLBCL in the interim phase group. A:Positive PET/CT finding before treatment; B:Negative PET/CT finding after 4 cycles of chemotherapy; C:No DLBCL recurrence or progression was observed after 30 months; D, E:Positive PET/CT finding before treatment and after 4 cycles of chemotherapy in a patient; F:DLBCL recurrence and progression in the gastrointestinal tract 9 months later. |
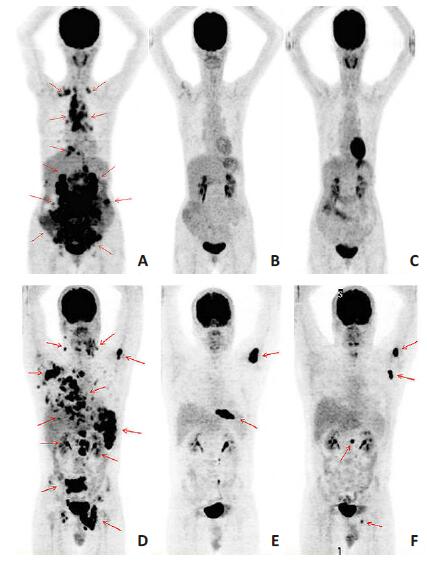
|
图 2 化疗中后期组不同PET/CT显像结果患者的图像比较 Figure 2 Negaive and positive PET/CT imaging of the later phase group. A-C and D-F present PET/CT findings in 2 patients with DLBCL in the later phase group. A:Positive PET/CT finding before treatment; B:Negative finding after 6 cycles of chemotherapy; C:No DLBCL recurrence or progression was observed at 27 months; D:Positive PET/CT finding before treatment; E:Positive PET/CT finding found after 7 cycles of chemotherapy; F:DLBCL recurrence and progression in this patient at 21 months. |
化疗中期组, 18F-FDG PET/CT显像阴性者PFS明显较阳性者长, 分别为63.56个月和19.23个月, 两者PFS存在显著统计学差异(P=0.000)。化疗中后期组, 18F-FDG PET/CT显像阴性者PFS也明显较阳性者长, 分别为65.78个月和24.32个月, 两者PFS也存在显著统计学差异(P=0.000)。化疗中期组和中后期组18F-FDG PET/CT显像阴性者之间PFS无显著统计学差异(63.56 vs 65.78个月, P=0.613);化疗中期组和中后期组18F-FDG PET/CT显像阳性者之间PFS也无显著统计学差异(19.23 vs 24.32个月, P=0.274, 图 3)。

|
图 3 各组的无进展生存曲线 Figure 3 Progression-free survival curves in different groups. A:No significant difference in PFS of the 92 patients with negative PET/CT findings between the interim and later phase groups; B:No significant difference in PFS of the 50 patients with positive findings between the interim and the later phase groups; C:PFS of the patients with the negative finding was much longer than that of patients with positive findings in the interim group; D:PFS of the patients with the negative finding was much longer than that of patients with positive findings in the later phase group. |
化疗中期组, 18F-FDG PET/CT显像阴性者PFS率明显高于阳性者, 分别为73.3%和15.4%, 两者PFS率存在显著统计学差异(P=0.000)。化疗中后期组, 18F-FDG PET/CT显像阴性者PFS率也明显高于阳性者, 分别为74.5%和16.7%, 两者PFS率也存在显著统计学差异(P=0.000)。化疗中期组和中后期组18F-FDG PET/CT显像阴性者之间PFS率无显著统计学差异(73.3% vs 74.5%, P=0.613);化疗中期组和中后期组18F-FDG PET/CT显像阳性者之间PFS率也无显著统计学差异(15.4% vs 16.7%, P=0.274, 图 3)。
3 讨论DLBCL是一种侵袭性非霍奇金氏淋巴瘤(NHL), 自然病程相对较短, 肿瘤的生物学特性、临床表现及预后等具有很大异质性, 部分患者经恰当的规范化治疗可能治愈[2]。目前治疗以化疗为主, 约半数患者可生存5年。如能在化疗过程中尽早对治疗反应进行客观评估, 有利于及时调整治疗方案, 使患者获益。常规采用的R-CHOP (或CHOP)化疗方案通常每3周为1个疗程, 总疗程数应达到6~8个, 可在完全缓解后再增加2~4个疗程巩固疗效[6]。由于DLBCL的异质性及化疗药物抵抗的原因[7], 即使通过目前的标准治疗方案进行规范化疗, 仍有约40%的患者出现复发或进展。因此, 尽早发现对该化疗方案不敏感的患者, 及时调整治疗方案对于改善患者的预后具有重要价值。
DLBCL是典型的18F-FDG高亲和性淋巴瘤, PET/ CT显像绝大多数肿瘤病灶表现为18F-FDG高摄取[7, 9-10], 而且18F-FDG摄取的量与肿瘤细胞的代谢活性相关。通常对化疗敏感的肿瘤细胞在化疗早期即可出现肿瘤细胞代谢活性减低、增殖活性降低或停止, PET/CT显像表现为DLBCL病灶18F-FDG摄取降低或无摄取。本研究采用DLBCL化疗中期和化疗中后期进行首次18F-FDG PET/CT评估, 通过对两次显像结果与患者预后之间关系的对比分析, 探讨化疗中期和化疗中后期评估疗效在判断预后中的临床应用价值比较。
全程化疗结束后采用18F-FDGPET/CT评价疗效, 对判断DLBCL患者的预后具有肯定的临床价值[11-13], 这种评估方法的优点是对化疗全部结束后疗效的客观评价, 结果可靠性强; 其不足是对该化疗方案不敏感的患者, 多进行了不必要的化疗, 延误了治疗时机。对于在化疗中期进行疗效评估, 判断患者预后也见一些报道[11, 14-15], 这种评估方法的优点是可避免对该化疗方案不敏感的患者进行不必要的化疗, 抓住治疗时机, 及时调整化疗方案, 取得更好的治疗效果。为探讨化疗中期及中后期首次18F-FDG PET/CT预测预后的价值, 本研究回顾性分析了142例DLBCL患者于化疗中期和化疗中后期18F-FDG PET/CT结果与PFS及PFS%率之间的关系。结果证明:(1) DLBCL患者142例PET/CT显像, 化疗中期组PET阴性率和阳性率(63.4%和36.6%)与化疗中后期组(66.2%和33.8%)无明显差异(P > 0.05), 表明化疗中期18F-FDG PET/CT显像结果与和化疗中后期无显著差异。(2)142例DLBCL患者中PET/CT显像阴性者总PFS率为73.9%, 明显高于PET/CT显像阳性者总PFS率(16.0%); 化疗中期组和化疗中后期组, PET/ CT显像阴性者PFS率也明显高于PET/CT显像阳性者。证明在DLBCL化疗过程中, 于化疗中期或化疗中后期进行18F-FDG PET/CT显像结果与PFS均有明显相关性, 对判断预后均具有临床应用价值。(3)142例DLBCL患者, 化疗中期组和化疗中后期组PET/CT显像均为阴性者, 两组PFS率无明显差异(P > 0.05), PET/CT显像阳性患者, 两组PFS率也无明显差异(P > 0.05), 结果证明化疗中后期评估疗效对判断预后并不优于化疗中期。在治疗中期组, 化疗3疗程后进行18F-FDG PET/CT显像的28例与化疗4疗程的43例进行总PFS, PET/CT显像阴性和阳性的PFS组间比较, 也无明显差异(P > 0.05)。结果表明DLBCL治疗后行18F-FDG PET/CT评估疗效的时间点不论选择在化疗中期或化疗中后期对判断预后均有临床应用价值, 化疗中期显像的预测能力与化疗中后期无明显差异, 提示可于化疗过程中较早(化疗中期)进行18F-FDG PET/CT疗效评估并判断预后。
总之, 18F-FDG PET/CT显像在化疗中期及化疗中后期评估DLBCL患者的化疗反应均可较好地判断预后, 在化疗中后期行PET/CT显像预测预后并不优于化疗中期, 因此在化疗中期行PET/CT进行预测预后是合适的, 不必延后到化疗中后期。
| [1] | Fisher RJ, Gaynor ER. Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma[J]. N Engl J Med,1993, 328 : 1002-6. DOI: 10.1056/NEJM199304083281404. |
| [2] | 中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会. 中国弥漫大B细胞淋巴瘤诊断与治疗指南(2013年版)[J]. 中华血液学杂志,2013, 34 (9) : 816-9. |
| [3] | 应志涛, 朱军. 治疗中期PET/CT评估在弥漫大B细胞淋巴瘤中的预后意义[J]. 循证医学,2012, 12 (5) : 259-61. |
| [4] | 李洪生, 吴湖炳, 王全师, 等. 18F-FDG PET/CT评价弥漫性大B细胞淋巴瘤化疗中期的治疗反应[J]. 中华核医学杂志,2011, 31 (3) : 145-50. |
| [5] | 李小秋, 李甘地, 高子芬, 等. 中国淋巴瘤亚型分布:国内多中心性病例10002例分析[J]. 诊断学理论与实践,2012, 11 (2) : 111-5. |
| [6] | 朱军. 淋巴瘤化疗及放疗进展[J]. 中国全科医学,2002, 5 (5) : 350-1. |
| [7] | Ngeow JY, Quek RH, Ng DC, et al. High SUV uptake on FDGPET/CT predicts for an aggressive B-cell lymphoma in a prospective study of primary FDG-PET/CT staging in lymphoma[J]. Ann Oncol,2009, 20 (9) : 1543-7. DOI: 10.1093/annonc/mdp030. |
| [8] | 周吉成. 非霍奇金淋巴瘤治疗现状[J]. 广西医学,2005, 27 (10) : 1508-9. |
| [9] | Weiler-Sagie M, Bushelev O, Epelbaum R, et al. 18F-FDG avidity in lymphoma readdressed:a study of 766 patients[J]. J Nucl Med,2010, 51 (1) : 25-30. DOI: 10.2967/jnumed.109.067892. |
| [10] | Spaepen K, Stroobants S, Dupont P, et al. (18)[J]. Eur J Nucl Med Mol Imaging,2003, 30 (5) : 682-8. DOI: 10.1007/s00259-003-1120-6. |
| [11] | Thomas A, Gingrich RD, Smith BJ, et al. 18-Fluoro-deoxyglucose positron emission tomography report interpretation as predictor of outcome in diffuse large B-cell lymphoma including analysis of `indeterminate' reports[J]. Leuk Lymphoma,2010, 51 (3) : 439-46. DOI: 10.3109/10428190903560198. |
| [12] | 应志涛, 王雪鹃, 宋玉琴, 等. 弥漫大B细胞淋巴瘤患者规范治疗后行18F-FDG PET/CT检查的预后意义[J]. 中华血液学杂志,2012, 33 (10) : 810-3. |
| [13] | 王全师, 吴湖炳, 王明芳, 等. 18F-FDG显像对淋巴瘤分期及疗效评价的价值[J]. 中华核医学杂志,2004, 24 (1) : 8-10. |
| [14] | Spaepen K, Stroobants S, Dupont P, et al. Early restaging positron emission tomography with (18) F-fluorodeoxyglucose predicts outcome in patients with aggressive non-Hodgkin's lymphoma[J]. Ann Oncol,2002, 13 (9) : 1356-63. DOI: 10.1093/annonc/mdf256. |
| [15] | Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J]. J Clin Oncol,2007, 25 (5) : 579-86. DOI: 10.1200/JCO.2006.09.2403. |
| [16] | Moskowitz CH, Schoeder H, Teruya-Feldstein JA, et al. Riskadapted dose-dense immunochemotherapy determined by interim FDG-PET in advanced-stage diffuse large B-cell lymphoma[J]. J Clin Oncol,2010, 28 (11) : 1896-903. DOI: 10.1200/JCO.2009.26.5942. |
| [17] | Horning SJ, Juweid ME, Sch?der H, et al. Interim positron emission tomography scans in diffuse large B-cell lymphoma:an Independent expert nuclear medicine evaluation of the Eastern Cooperative Oncology Group E3404 study[J]. Blood,2010, 115 (4) : 775-7. DOI: 10.1182/blood-2009-08-234351. |
| [18] | Itti E, Juweid ME, Haioun C, et al. Improvement of early 18F-FDG PET interpretation in diffuse large B-cell lymphoma:importance of the reference background[J]. J Nucl Med,2010, 51 (12) : 1857-62. DOI: 10.2967/jnumed.110.080556. |
 2015, Vol. 35
2015, Vol. 35
