日本血吸虫病是一种严重危害人类健康的人兽共患寄生虫病, 随着分子生物学和基因组学的发展, 制备疫苗防治该病已成为新的希望。血吸虫32 000蛋白被证实为天冬酰胺肽链酶[1], 具有较好的免疫原性。Shi等[2]制备的核酸疫苗pCD-Sj32能够诱导小鼠产生较高水平的IL-2、TNF、IFN-γ和特异性IgG抗体而产生保护作用, 表明Sj32可诱导小鼠产生有效的免疫应答。沈定文等[3]利用重组31 000/32 000抗原免疫小鼠并进行攻击试验, 得到了30.1%的减虫率和63.2%的减卵率, 提示重组32 000蛋白可诱导机体产生较好的免疫保护力。本文在成功构建日本血吸虫重组Bb (pGEX-Sj32)疫苗[4]的基础上, 将其免疫小鼠, 动态观察其诱导的小鼠脾细胞增殖、T细胞亚群及细胞因子水平变化, 以期探索该疫苗的作用机制, 为后续研究提供有意义的材料。
1 材料与方法 1.1 材料及试剂88只清洁级6~8周龄BALB/c小鼠, 体质量15~18 g, 购自重庆医科大学实验动物中心。日本血吸虫成虫抗原(SjAWA)及重组Bb (pGEX-Sj32)疫苗由本室保存。刀豆蛋白A (ConA)购自美国Sigma公司; RPMI 1640培养基、10%胎牛血清、青霉素和链霉素购自上海生工生物工程技术服务有限公司; TNF-α、IL-10和IL-12检测ELISA试剂盒购自深圳欣博盛; 大鼠抗小鼠CD4+T细胞和CD8+T细胞单克隆抗体以及异硫氰酸荧光素(FITC)标记兔抗大鼠IgG均购自北京邦定泰克生物技术有限公司; 四甲基偶氮唑盐(MTT)和二甲基亚砜(DMSO)购自重庆百萃生物技术公司。
1.2 方法 1.2.1 动物免疫88只小鼠随机分为口服(PO)组和滴鼻(IN)组, 每组44只。PO组小鼠:106 cfu重组疫苗悬浮于100 μl MRS液体培养基单次口服免疫; IN组小鼠: 105 cfu重组疫苗悬浮于10 μl MRS液体培养基单次滴鼻免疫。
1.2.2 脾细胞分离在疫苗免疫后0、2、4、6、8、10、12、14、16、18、20周两组各随机剖杀4只小鼠, 无菌取脾, 参照文献[5]制备成终浓度为5×109/L的脾细胞悬液。
1.2.3 脾细胞增殖检测将分离的脾细胞(浓度为5×109/L)接种于24孔细胞培养板, 每份标本设3组:原液组(基础培养基)、SjAWA刺激组和ConA刺激组, 分别加入1 ml脾细胞悬液、1 ml脾细胞悬液+10 μg SjAWA和1 ml脾细胞悬液+10 μg ConA, SjAWA和ConA的终浓度均为10 g/L, 最后于每孔加入10 μl MTT (浓度为5 g/L), 37℃、5% CO2培养18 h, 弃去细胞上清液150 μl/孔, 加入DMSO 150 μl/孔, 吹打至甲臜充分溶解。将混匀的细胞转至96孔板(150 μl/孔), 同时设3个空白孔为对照, 酶标仪570 nm波长检测吸光度(A)值。
1.2.4 脾细胞亚群检测将细胞浓度为5×109/L的脾细胞悬液与1%阻断液各200 μl混匀于1.5 ml EP管, 置37℃孵育1 h; 以1 ml PBS洗涤2次, 3000 r/min离心5 min, 弃上清, 加入大鼠抗小鼠CD4+或CD8+亚群单抗5 μl, 4℃放置30 min, 加入1 ml PBS洗涤2次(方法同前), 离心并弃上清, 加入5 μl兔抗大鼠FITC-IgG抗体、混匀, 4℃放置30 min, 同上方法洗涤2次, 离心后弃上清。FACsort流式细胞仪测定CD4+T细胞和CD8+T细胞亚群的百分比。
1.2.5 脾细胞因子的检测将步骤1.2.2制备的脾细胞悬液加入24孔细胞培养板, 每份标本设原液组(1 ml脾细胞悬液)、SjAWA刺激组(1 ml脾细胞悬液+10 μg SjAWA)和ConA刺激组(1 ml脾细胞悬液+ 10 μg ConA), 37℃、5% CO2培养48 h, 收集脾细胞悬液至1.5 ml EP管, 3000 r/min离心5 min, 收集上清液, -20℃保存备用。按双抗体夹心ELISA试剂盒说明书检测TNF-α、IL-10和IL-12水平。
1.3 统计学分析采用SPSS18.0对实验数据进行分析, 数据结果以均数±标准差表示, 每周每组4份标本, 多组间比较用单因素方差分析, 组间两两比用Dunnett's T3法, 两组比较采用独立样本t检验, P < 0.05为有统计学意义。
2 结果 2.1 脾淋巴细胞增殖当无刺激物及分别用SjAWA和ConA刺激时, PO组小鼠脾细胞增殖水平均在免疫后2~16周升高, IN组小鼠脾淋巴细胞增殖水平均在免疫后2~18周升高, 两组均于免疫后6周达最高水平, 与0周相比有显著差异(P < 0.01)。同一时间点内原液、SjAWA和ConA刺激比较, SjAWA与ConA能够明显促进脾细胞的增殖, ConA作用最强, 与原液组相比具有显著差异(P < 0.01)。不同免疫途径比较, IN组与PO组小鼠脾淋巴细胞增殖水平未见显著性差异(P > 0.05, 表 1)。
| 表 1 日本血吸虫重组Bb(pGEX-Sj32)疫苗免疫小鼠脾细胞增殖的检测 Table 1 Detection of splenocyte proliferation from mice immunized with the recombinant Bb (pGEX-Sj32) vaccine (n=4) |
PO组和IN组小鼠脾CD4+T细胞亚群百分比均在免疫后2~12周升高, 分别在6周和8周达最高水平, 与0周相比有显著差异(P < 0.01);两组CD8+T细胞亚群百分比在免疫后2~20周缓慢升高, 仅PO组6~8周、IN组2周和12周与0周相比有统计学差异(P < 0.05或P < 0.01), 其余时间点均无统计学意义; 两组间比较无显著差异(P > 0.05, 图 1)。
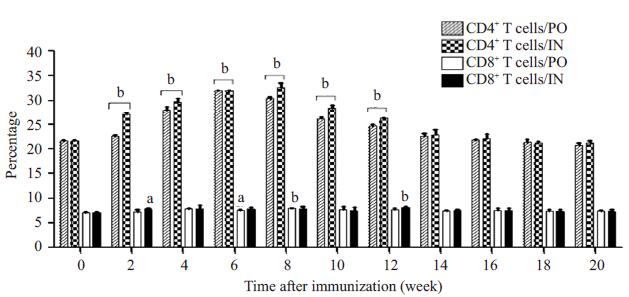
|
图 1 日本血吸虫重组Bb (pGEX-Sj32)疫苗免疫小鼠脾细胞亚群的检测 Figure 1 Detection of splenocyte subsets from mice immunized with the recombinant vaccine. aP < 0.05, bP < 0.01 vs 0 week. |
原液、SjAWA和ConA刺激时, PO组小鼠脾细胞IL-10水平均在2~18周升高, 且均于免疫后10周达最高水平, 原液和SjAWA刺激时6~10周和ConA刺激的4~16周与0周相比差异有统计学意义(P < 0.05或P < 0.01); IN组脾细胞IL-10水平均在2~18周升高, 且均于免疫后10周达最高水平, 8~14周与0周相比差异有统计学意义(P < 0.05或P < 0.01)。同一时间点, 原液、SjAWA和ConA刺激比较, 两组ConA刺激组均显著高于相应原液组(P < 0.01);PO组与IN组比较无统计学意义(P > 0.05, 表 2)。
| 表 2 日本血吸虫重组Bb (pGEX-Sj32)疫苗免疫小鼠脾细胞上清液IL-10水平的检测 Table 2 Levels of IL-10 in splenocyte supernatants from mice immunized with the recombinant vaccine (n=4) |
原液、SjAWA和ConA刺激时, PO组小鼠脾细胞IL-12水平均在2~14周升高, 且均于免疫后6周达最高, 4~6周与0周相比差异有统计学意义(P < 0.05或P < 0.01);IN组脾细胞IL-12水平亦均在2~18周升高, 且均于免疫后8周达最高水平, 4~8周与0周相比差异有统计学意义(P < 0.05或P < 0.01)。同一时间点, 原液、SjAWA和ConA刺激比较, 两组ConA刺激组均极显著高于相应原液组(P < 0.01);PO组与IN组比较无统计学意义(P > 0.05, 表 3)。
| 表 3 日本血吸虫重组Bb (pGEX-Sj32)疫苗免疫小鼠脾细胞上清液IL-12水平的检测 Table 3 Levels of IL-12 in splenocyte supernatants from mice immunized with the recombinant vaccine (n=4) |
原液、SjAWA和ConA刺激时, 两组小鼠脾细胞TNF-α水平均在免疫后2~14周升高, 且均于第8周达最高水平, 与0周相比, PO组原液在6~10周、SjAWA和ConA刺激时的6~12周有统计学差异(P < 0.05或P < 0.01)、IN组原液及SjAWA刺激组在6~8周和ConA刺激时的6~12周有统计学意义(P < 0.05或P < 0.01)。同一时间点, 原液、SjAWA和ConA刺激比较未见显著性差异; PO组与IN组比较也无统计学意义(P > 0.05, 表 4)。
| 表 4 日本血吸虫重组Bb (pGEX-Sj32)疫苗免疫小鼠脾细胞上清液TNF-α水平的检测 Table 4 Levels of TNF-α in splenocyte supernatants from mice immunized with the recombinant vaccine (n=4) |
脾脏是机体受抗原刺激后产生免疫应答的重要场所之一, 当寄生虫感染宿主后, 其抗原性成分被机体免疫系统感知, 可较早启动脾淋巴细胞增殖反应, 增殖的淋巴细胞通过分泌多种细胞因子和抗体, 发挥杀伤和(或)清除体内寄生虫、中和毒素及抑制炎症反应等作用, 从而产生细胞和(或)体液免疫应答, 故检测脾淋巴细胞增殖水平可间接反映机体的免疫状态。Tu等[6]将日本血吸虫pIRES-SjFABP-Sj26GST疫苗免疫BALB/ c鼠, 在第2周测得脾淋巴细胞发生显著增殖, 并分泌IFN-γ和IL-2等细胞因子介导Th1型免疫反应, 攻击感染后得到了31.8%的减虫率和24.78%的减卵率, 表明脾淋巴细胞增殖是该核酸疫苗产生免疫保护作用的关键。本研究显示日本血吸虫重组Bb (pGEX-Sj32)疫苗在免疫BALB/c鼠后2~18周脾淋巴细胞显著升高, 于第6周达峰值, 表明该重组疫苗表达的抗原分子能被小鼠免疫系统识别, 在免疫早期即可启动脾淋巴细胞增殖反应而产生有效的免疫应答。
1986年Mosmann等[7]提出的T淋巴细胞亚群分化学说为疫苗的免疫学机制研究提供了重要的指导意义。T细胞亚群分化(CD4+/CD8+)在机体抗感染免疫过程中起着重要的作用, 在血吸虫感染早期主要由CD4+ Th1型细胞及CD8+CTL细胞发挥作用, 而当发生虫卵肉芽肿及肝脏的免疫病理改变后则由CD4+Th2型细胞及CD8+Ts细胞作用为主。研究表明CD4+T细胞有助于抗血吸虫感染, CD8+Ts细胞则是一类负性调节细胞, 可下调机体的免疫力[8-9]。Li等[10]测得感染日本血吸虫的患者CD4+T细胞亚群百分比为39.5%、CD4+/CD8+的比例为1.37, 与对照组(CD4+T细胞亚群百分比49.8%、CD4+/CD8+的比例为1.62)比较均发生了显著的下降, 提示CD4+T细胞亚群可能在对抗血吸虫感染中起主要作用。本研究发现日本血吸虫重组Bb (pGEX-Sj32)疫苗能够诱导脾CD4+T细胞亚群升高, 在免疫后2~12周有统计学意义, 而CD8+T细胞亚群百分比在免疫后2~20周无明显升高, 表明该疫苗可主要促进T淋巴细胞向CD4+T亚群分化, 使小鼠产生有效的免疫应答。推测该疫苗抗原在提呈细胞的作用下, 主要经MHC-II类分子途径被结合, T淋巴细胞识别这些被处理的MHC-II类抗原复合物而分化为CD4+T亚群, 产生多种细胞因子发挥免疫作用。这些分泌的细胞因子可正反馈调节CD4+ T淋巴细胞不断增殖, 同时抑制CD8+T细胞亚群的分化, 减少TS细胞的产生, 抑制其负性调节作用, 从而上调免疫功能。
机体抵抗日本血吸虫感染有赖于辅助性T淋巴细胞(Th)的激活, 激活的Th细胞可分泌多种细胞因子, 形成Th1和Th2型免疫应答。Th1型细胞因子IL-12和TNF-α具有重要的免疫效应作用, IL-12可促进IL-2的分泌(Th1型细胞分化所必需的一类细胞因子), 使Th0细胞向Th1方向分化而形成大量的Th1型细胞, 这些成熟的细胞又可分泌TNF-α和IFN-γ等细胞因子清除病原体、抑制虫卵肉芽肿及肝纤维化形成, 从而产生Th1型免疫保护作用[11]。Cheng等[12]研究发现IL-12能阻碍血吸虫雌虫生长, 减少产卵, 从而减轻由虫卵引起的病理性炎症反应和纤维化。以上研究表明IL-12是一类重要的免疫增强和保护因子。本研究发现重组日本血吸虫Bb (pGEX-Sj32)疫苗能诱导小鼠脾淋巴细胞分泌IL-12, 口服组和滴鼻组分别在在免疫后2~14周和2~18周升高, 表明该疫苗的免疫保护作用可能与其诱导分泌IL-12有关。细胞因子TNF-α不仅具有杀伤肿瘤细胞的功能, 而且在血吸虫感染免疫中亦发挥重要的作用, 通过募集多种粒细胞而引发炎症反应, 介导虫卵肉芽肿形成及杀伤童虫。大量研究表明多种血吸虫疫苗的免疫保护力都与其诱导机体产生高水平TNF-α有关[13-15]。本研究发现重组日本血吸虫Bb (pGEX-Sj32)疫苗也能诱导小鼠分泌较高水平的TNF-α, 与上述报道一致。推测该疫苗能在小鼠体内成功表达32 000抗原分子, 被机体免疫系统识别并提呈, 在脾脏微环境内T淋巴细胞受提呈的抗原刺激增殖活化为Th细胞。其中分化的Th1型细胞产生IL-12, 该细胞因子一方面使Th0细胞不断分化为Th1细胞, 另一方面激活NK细胞、巨噬细胞和Tc细胞发挥杀伤作用。Th1型细胞因子通过与下游免疫细胞以及其他细胞因子相互促进、相互调节, 产生更多的有利抗日本血吸虫感染的IL-12和TNF-α等细胞因子, 进而形成并适当强化Th1型免疫应答, 发挥强大的免疫保护作用。
IL-10是Th2型细胞分泌的一类经典的抗炎因子, 它可以作用于抗原提呈细胞下调前炎症因子IL-12和IL-1β的分泌, 从而减轻感染宿主皮肤和肝脏的炎症反应以及肝纤维化, 同时大量研究发现IL-10能够抑制IFN-γ分泌而下调Th1型免疫应答[16-18], 在日本血吸虫感染中发挥重要的抗炎抗纤维化作用。本研究显示PO组和IN组小鼠脾细胞IL-10水平均在2~18周升高, 分别在10周和12周达峰值, 其达峰值时间较IL-12(PO/IN: 6/8周)和TNF-α(PO/IN:8/8周)晚, 表明该重组疫苗可能在免疫后期主要诱导产生Th2型免疫应答。这种Th1/Th2免疫在时间上的差异可能与细胞因子的调节、抗原的持续表达等因素相关。在免疫早期, 由于机体需要大量的效应细胞杀伤寄生虫体, 抑制炎症反应和清除异物, Th1型免疫可能占优势。大量的Th1型细胞因子如IL-12、TNF-α, 它们一方面激活杀伤性细胞杀灭病原体和趋化炎症细胞产生炎症反应, 另一方面反向调节Th1细胞, 使其不断分化成熟进而分泌更多的细胞因子, 如此形成强大的Th1型免疫应答。在免疫后期, 抗原物质被逐渐消耗以及随着机体抗感染力的增强, 负性调节因子逐渐占领主导地位, 抑制过度的Th1型免疫应答对自身组织的破坏, 同时通过凋亡级联机制诱导Th1型细胞发生凋亡, 从而维持Th1/Th2型免疫的平衡, 防止某一类型免疫过度强化而损伤机体自身组织, 并维持较好的免疫保护效力。
| [1] | Ruppel A, Diesjed HJ, Rothers U. Immunoblot analysis of Schistosoma mansoni antigens with sera of schistosomiasis patients:diagnostic potential of an adult Schistosome polypeptide[J]. Clin Exp Immunol,1985, 62 (3) : 499-506. |
| [2] | Shi Y, Xie L, Li C, et al. DNA vaccine pCD-Sj32 and its efficacy of protective immunity against infection of Schistosoma japonicum[J]. Chin Med J (Engl),1999, 112 (8) : 677-80. |
| [3] | 沈定文, 罗金萍, 陈喜珪, 等. 日本血吸虫31/32kDa重组抗原对小鼠免疫保护性研究[J]. 中国公共卫生,2002, 18 (2) : 171-2. |
| [4] | 谭建蓉, 李文桂, 张丽. 日本血吸虫重组两歧双歧杆菌(pGEX-Sj32)疫苗构建及鉴定[J]. 中华地方病学杂志,2015, 35 (1) : 34-7. |
| [5] | 向进平, 李文桂, 张丽. 日本血吸虫重组Bb (pGEX-Sj26GST-Sj32)疫苗免疫小鼠脾细胞增殖、亚群及凋亡的动态变化[J]. 细胞与分子免疫学杂志,2013, 29 (11) : 1129-32. |
| [6] | Tu Y, Hu Y, Fan G, et al. Protective effects of membrane-anchored and secreted DNA vaccines encoding fatty acid-binding protein and glutathione S-transferase against Schistosoma japonicum[J]. PLoS One,2014, 9 (1) : e86575. DOI: 10.1371/journal.pone.0086575. |
| [7] | Mosmann TR, Cherwinski H, Bond MW, et al. Two types of murine helper T cell clone[J]. J Immunol,1986, 136 (7) : 2348-57. |
| [8] | Ji MJ, Su C, Wang Y, et al. Characterization of CD4+ T cell responses in mice infected with Schistosoma japonicum[J]. Acta Biochim Biophys Sin (Shanghai),2006, 38 (5) : 327-34. DOI: 10.1111/abbs.2006.38.issue-5. |
| [9] | Chen L, Xu Z, Chang C, et al. Allospecific CD8 T suppressor cells induced by multiple MLC stimulation or priming in the presence of ILT3[J]. Hum Immunol,2014, 75 (2) : 190-6. DOI: 10.1016/j.humimm.2013.10.004. |
| [10] | Li YE, Zeng QR, Ellis MK, et al. CD4(+) T-cell counts, CD4(+)/CD8(+) T-cell count ratios, and antibody levels in migrant fishermen infected with Schistosoma japonicum in the Dongting Lake, China[J]. Am J Trop Med Hyg,2006, 75 (5) : 910-3. |
| [11] | Fonseca CT, Brito CF, Alves JB, et al. IL-12 enhances protective immunity in mice engendered by immunization with recombinant 14 kDa Schistosoma mansoni fatty acid-binding protein through an IFN-gamma and TNF-alpha dependent pathway[J]. Vaccine,2004, 22 (3/4) : 503-10. |
| [12] | Cheng YL, Song WJ, Liu WQ, et al. The effects of interleukin (IL)-12 and IL-4 deficiency on worm development and granuloma formation in Schistosoma japonicum-infected mice[J]. Parasitol Res,2012, 110 (1) : 287-93. DOI: 10.1007/s00436-011-2487-0. |
| [13] | Cardoso FC, Macedo GC, Gava E, et al. Schistosoma mansoni tegument protein Sm29 is able to induce a Th1-type of immune response and protection against parasite infection[J]. PLoS Negl Trop Dis,2008, 2 (10) : e308. DOI: 10.1371/journal.pntd.0000308. |
| [14] | Farias LP, Cardoso FC, Miyasato PA, et al. Schistosoma mansoni Stomatin like protein-2 is located in the tegument and induces partial protection against challenge infection[J]. PLoS Negl Trop Dis,2010, 4 (2) : e597. DOI: 10.1371/journal.pntd.0000597. |
| [15] | Wang X, Dong L, Ni H, et al. Combined TLR7/8 and TLR9 ligands potentiate the activity of a Schistosoma japonicum DNA vaccine[J]. PLoS Negl Trop Dis,2013, 7 (4) : e2164. DOI: 10.1371/journal.pntd.0002164. |
| [16] | Wilson MS, Cheever AW, White SD, et al. IL-10 blocks the development of resistance to Re-Infection with schistosoma mansoni[J]. PLoS Pathog,2011, 7 (8) : e1002171. DOI: 10.1371/journal.ppat.1002171. |
| [17] | Darrah PA, Hegde ST, Patel DT, et al. IL-10 production differentially influences the magnitude, quality, and protective capacity of Th1 responses depending on the vaccine platform[J]. J Exp Med,2010, 207 (7) : 1421-33. DOI: 10.1084/jem.20092532. |
| [18] | Brooks DG, Lee AM, Elsaesser H, et al. IL-10 blockade facilitates DNA vaccine-induced T cell responses and enhances clearance of persistent virus infection[J]. J Exp Med,2008, 205 (3) : 533-41. DOI: 10.1084/jem.20071948. |
 2015, Vol. 35
2015, Vol. 35
