每年全球有将近140万人死于肺癌, 而这其中有85%的肺癌是非小细胞肺癌(NSCLC)[1]。NSCLC患者的5年生存率很低, 术后复发和转移是主要原因。在肿瘤细胞中有一小群具有自我更新和无限复制, 并导致肿瘤分化、侵袭、转移及抵抗放化疗的细胞, 我们称之为肿瘤干细胞[2-4]。CD133, 又称之为prominin-1, 是肿瘤干细胞中常用的标记物, 最早发现表达于造血干细胞表面[5]。CD133蛋白是一个具有5次跨膜结构的糖蛋白, 其相对分子质量约为120 000, 其基因定位于4p16.12-pl和2号染色体上。近年来, CD133作为肿瘤干细胞标记物在多种肿瘤中得到应用。Notch信号通路在进化过程中属于高度保守的信号通路, 其异常表达常参与肿瘤的侵袭、转移、凋亡和血管生成等过程[6-7]。Notch受体家族有4个成员, 即Notch1-4, 其中Notch1是最常见的Notch受体, 其在大多数肿瘤中起着促癌的作用。CD133和Notch均在肿瘤的血管生成中起着重要作用[6, 8], 但在NSCLC中关于CD133和Notch1与血管生成的关系, 目前国内外尚未见报道。本研究采用免疫组织化学方法检测305例NSCLC患者肿瘤组织中CD133、Notch1和VEGF蛋白的表达, 分析CD133、Notch1及VEGF之间的相互关系, 并探讨它们与NSCLC浸润、转移及预后的关系。
1 材料与方法 1.1 一般资料收集蚌埠医学院第一附属医院病理科2003年1月~2006年10月存档石蜡包埋组织标本305例(患者术前均未行放、化疗及其它抗肿瘤治疗)和正常肺组织标本80例, 所有病例均有完整的临床病理资料和随访资料, 入选病例随访至患者死亡或截止2011年10月, 随访时间为3~100个月。年龄26~82岁, 中位年龄59.8岁。男性233例, 女性72例。鳞状细胞癌210例, 腺癌95例。中央型肺癌224例, 周围型肺癌81例。高分化癌34例, 中分化癌203例, 低分化癌68例。淋巴结转移185例, 淋巴结无转移120例。根据AJCC病理分期标准进行分期, 其中Ⅰ期50例, Ⅱ期90例, Ⅲ期94例, Ⅳ期71例。本实验经蚌埠医学院伦理委员会批准后进行的。对照组正常肺组织80例均取自离肺癌肿块 > 5.0 cm的肺组织, 经病理HE染色证实为正常肺组织。
1.2 试剂鼠抗人CD133和Notch1单克隆抗体购自美国Abcam公司, 鼠抗人VEGF单克隆抗体、ElivisionTM plus试剂盒和DAB显色试剂盒都购自福州迈新生物技术开发有限公司。
1.3 实验方法所有标本均经4%中性福尔马林固定, 石蜡包埋组织以4 μm厚连续切片、烤干, 然后于二甲苯溶液及梯度浓度乙醇溶液中脱蜡至水洗。免疫组织化学染色步骤按试剂盒说明书进行, 用已知阳性片作对照, 并以PBS液代替一抗作空白对照。
1.4 结果判定CD133、Notch1和VEGF均以细胞膜和细胞浆出现棕黄色颗粒为阳性。表达结果从着色强度和着色范围两个方面综合计分。从着色强度来看, 无色, 0分; 淡黄色, 1分; 棕黄色, 2分; 棕褐色, 3分。从着色范围来看(主要是计数高倍镜下阳性细胞所占百分比), < 10%, 1分; 11%~50%, 2分; 51%~75%, 3分; > 75%, 4分。然后用着色强度得分和范围得分的乘积作为判断结果, 若积分≤2为阴性, > 2为阳性。每例标本均随机计数10个高倍视野(×400倍), 取其中位值, 免疫组织化学结果最后由两位病理医师采用独立双盲法阅片判定。
1.5 统计分析采用SPSS20.0统计软件进行数据分析。CD133、Notch1和VEGF蛋白表达阳性组与阴性组生存分析采用Kaplan-Meier法, 组间比较用Log-rank检验, 多因素分析采用Cox回归模型分析, CD133、Notch1和VEGF在NSCLC组中表达与正常肺组织、各临床病理因素之间的相关性及相互关系采用χ2检验及Spearman等级相关检验, P < 0.05为差异有统计学意义。
2 结果 2.1 NSCLC组织中CD133的表达及其与临床病理因素的关系CD133蛋白在正常肺组织中的阳性表达率为10.0%, 在NSCLC组织中的阳性表达率为48.9%, 两组之间差异有统计学意义。CD133蛋白的阳性表达在NSCLC患者的性别、年龄、肿瘤位置、大小及组织学类型等之间差异均无统计学意义(P > 0.05)。随着NSCLC组织的分化越差, CD133蛋白的阳性表达率越高, 差异有统计学意义(P < 0.05);且CD133蛋白的阳性表达率在不同临床分期及淋巴结有无转移之间有统计学意义(P < 0.05, 图 1A、B, 表 1)。
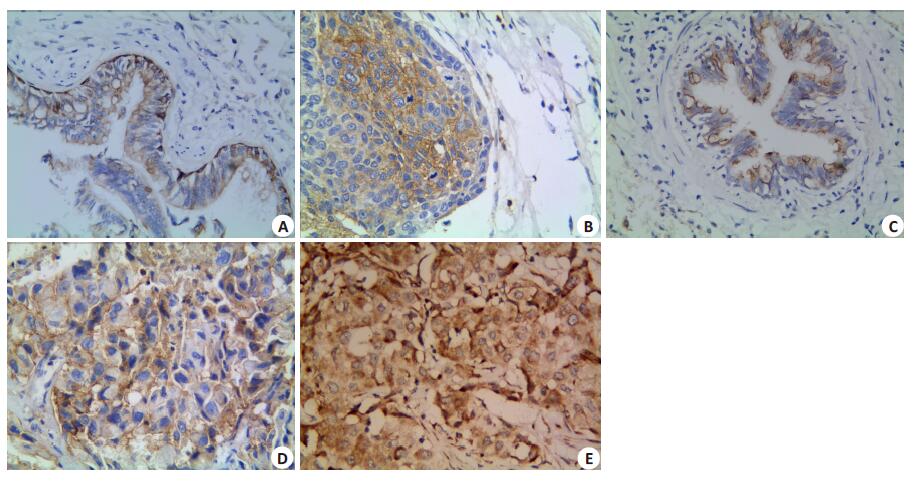
|
图 1 CD133、Notch1和VEGF在NSCLC中的表达 Figure 1 Expression of CD133, Notch1, and VEGF in NSCLC and normal lung tissue (ElivisionTM). A, B: Positive staining of CD133 in the membrane and cytoplasm of a normal lung tissue specimen (Original magnification: × 100) and a moderately differentiated NSCLC specimen (Original magnification: ×400), respectively; C, D: Positive staining of Notch1 in membrane and cytoplasm of a normal lung tissue specimen (Original magnification: × 400) and a moderately differentiated NSCLC specimen (Original magnification: ×400), respectively; E: Positive staining of VEGF in the cytoplasm and membrane of a poorly differentiated NSCLC specimen (Original magnification: ×400). |
| 表 1 NSCLC中CD133、Notch1和VEGF蛋白的表达与临床病理因素之间的相互关系 Table 1 Correlation of CD133, Notch1, and VEGF protein expression with the clinicopathologic characteristics of the patients with NSCLC |
Notch1蛋白在正常肺组织中阳性率为15.0%, 在NSCLC组中为43.9%, 差异有统计学意义。随着NSCLC组织的分化越差、临床分期越高, Notch1蛋白的阳性表达率越高, 差异有统计学意义; 淋巴结转移组中Notch1蛋白的阳性表达率高于淋巴结无转移组, 差异有统计学意义。Notch1蛋白的阳性表达率在不同年龄、性别、肿瘤位置、大小及组织学类型等之间差异均无统计学意义(P > 0.05, 图 1C、D, 表 1)。
2.3 NSCLC组织中VEGF的表达及其与临床病理因素的关系对照组中未见有VEGF蛋白的表达, NSCLC组中其阳性表达率为45.6%, 其阳性表达率在不同患者年龄、性别及组织学类型之间差异无统计学意义(P > 0.05)。VEGF蛋白的阳性表达率在肿瘤分化程度、临床分期高低及淋巴结有无转移之间差异有统计学意义(P < 0.05, 图 1E, 表 1)。
2.4 NSCLC组织中CD133、Notch1、VEGF三者之间的相互关系Spearman相关分析显示, CD133蛋白的表达与Notch1蛋白的表达呈正相关关系(rs=0.734, P < 0.001); CD133蛋白的表达与VEGF蛋白的表达呈正相关关系(rs=0.765, P < 0.001);Notch1蛋白的表达与VEGF蛋白的表达呈正相关关系(rs=0.795, P < 0.001, 表 2)。
| 表 2 NSCLC组织中CD133、Notch1和VEGF蛋白表达之间的相互关系 Table 2 Correlations between CD133, Notch1, and VEGF expressions in NSCLC |
将NSCLC肿瘤患者性别(分为男性和女性组)、组织分化(分为高、中、低分化组)、年龄(分为≥60岁组与 < 60岁组)、肿瘤长径(分为≥3.0 cm组与 < 3.0 cm组)、肿瘤位置(分为中央型与周围型组)、TNM分期(分为Ⅰ+Ⅱ期与Ⅲ+Ⅳ期组)、淋巴结转移(分为转移组与无转移组)、CD133蛋白表达(分为阳性与阴性组)、Notch1蛋白表达(分为阳性与阴性组)、VEGF蛋白表达(分为阳性与阴性组)等因素引入Cox模型进行分析, 结果显示: CD133、Notch1和TNM分期是影响NSCLC患者预后的独立因素(表 3)。
| 表 3 305例NSCLC患者多因素分析 Table 3 Multivariate survival analysis of 305 patients with NSCLC |
Kaplan-Meier生存分析显示CD133蛋白表达阳性组与阴性组的中位生存时间分别为18.5±0.9月和64.6±2.3月, 差异有统计学意义(P < 0.001, 图 2A); Notch1蛋白阳性表达组与阴性表达组的中位生存时间分别为18.3±1.3月和60.7±2.2月, 两组之间相比差异有统计学意义(P < 0.001, 图 2B); VEGF蛋白表达阳性组与阴性组的中位生存时间分别为19.8±1.2月和60.3±2.3月, 两组之间相比差异有统计学意义(P < 0.001, 图 2C)。
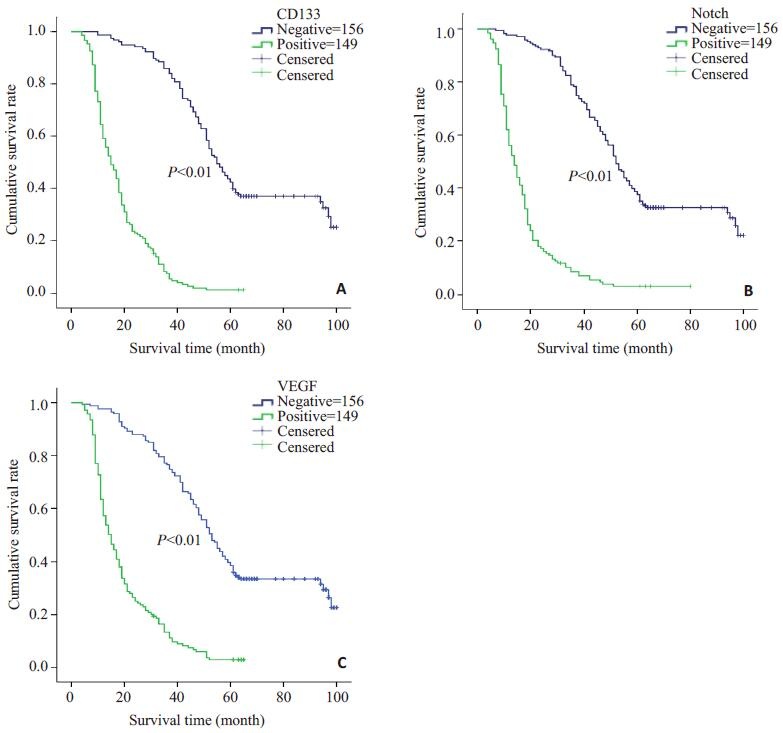
|
图 2 CD133、Notch1和VEGF表达阳性组与阴性NSCLC患者生存曲线 Figure 2 Survival curves of NSCLC patients with positive and negative expressions of CD133 (A), Notch1 (B), and VEGF (C). |
肿瘤干细胞(CSCs)又叫肿瘤起源细胞, 是具有自我更新、无限增殖及多向分化能力的一群细胞, 与恶性肿瘤的复发、转移以及放化疗失败等均有关, 进而影响患者的预后。CD133作为干细胞标记物, 最初是从造血干细胞/祖细胞表面发现的[9-10], 后来在多种实体肿瘤也发现了CD133过表达, 例如肺癌、胃癌、肝癌、大肠癌、乳腺癌以及前列腺癌等[11-16]。有研究表明, 大约有50%左右或更多的NSCLC、胃癌和卵巢癌表达CD133[2, 17-18]。有学者将CD133+肺癌细胞和CD133-肺癌细胞分别植入小鼠中, 发现CD133+的肺癌细胞能够在小鼠中再生出肺癌, 但CD133-的肺癌细胞缺乏这种能力; 且在体外培养中, CD133-的肺癌细胞会逐渐死亡, 而CD133+的肺癌细胞能够生成其相应类型的肺癌细胞, 但其部分细胞丢失了CD133的表达。以上这些说明, CD133+的肺癌细胞可能具有干细胞特性; 并且CSCs的存在也是肺癌细胞抵抗放、化疗的主要原因之一[11]。因此, 在肺癌中通过清除CD133+肿瘤细胞的治疗将是未来研究的重要靶点。本研究通过免疫组织化学方法检测NSCLC组织中CD133蛋白的表达, 发现在305例NSCLC组织中, CD133蛋白的阳性表达率为48.9%, 且CD133蛋白的阳性表达率在NSCLC患者肿瘤组织分化程度、淋巴结转移与否及临床分期不同之间差异有统计学意义, 即CD133蛋白阳性表达的肿瘤细胞分化差、易于浸润及发生转移。有研究表明, 在恶性肿瘤中CD133的阳性表达率范围很广(0~48.9%), 但并非所有表达CD133的肿瘤细胞均具有肿瘤干细胞的功能, 仅有部分CD133+的细胞具有肿瘤干细胞功能[12, 19-20]。此外, 我们还发现在正常组织中也有部分细胞表达CD133蛋白, 这个结果与其他学者[11, 20-21]的研究结果一致, 说明CD133可能在NSCLC的形成过程中起着重要作用[21]。Kaplan-Meier生存分析表明, CD133蛋白阳性表达组的患者生存时间明显低于其阴性表达组患者, 差异有统计学意义, 说明CD133可以预测NSCLC患者的预后, 这与国内外文献报道的结果相一致[22-23]。
Notch信号通路是进化中高度保守的信号通路。近年来发现, Notch信号通路异常与肿瘤发生发展密切相关[21]。Notch1受体是目前Notch信号通路中研究的最多的受体, 其通过邻近细胞间的相互作用来精确调控细胞的生长发育、增殖及分化。有研究发现, Notch1的异常活化, 在某种程度上可能是导致细胞过度增殖和恶性转化的[22]。本研究结果显示, Notch1蛋白在NSCLC组织中的表达率明显高于对照肺组织; 同时Notch1蛋白的阳性表达率与NSCLC组织的分化程度、淋巴结转移与否及临床分期均密切相关, 即在分化差、淋巴结转移及分期高的患者中, Notch1蛋白的阳性表达率显著增高。生存分析显示, Notch1蛋白阴性表达组患者的生存时间明显高于其阳性表达组患者, 差异有统计学意义。以上这些说明Notch1信号通路异常可能参与NSCLC的发生、发展、浸润及转移; 并能够评估患者的预后, 这与文献报道[23]结果一致。
VEGF主要是由肿瘤细胞分泌的一种功能因子, 与血管内皮细胞特异性受体结合, 启动肿瘤血管新生, 有利于肿瘤细胞的浸润及转移。本研究结果表明, VEGF蛋白的表达与NSCLC组织的分化程度、淋巴结转移及临床分期等呈正相关关系。同时还显示VEGF蛋白的阳性表达与NSCLC患者的年龄、性别、肿瘤大小及组织学类型等无关。VEGF蛋白阳性表达组的患者生存时间明显低于其阴性表达组患者。
Spearman相关分析显示, VEGF蛋白表达与CD133和Notch1蛋白表达均呈正相关关系, 且CD133与Notch1也呈正相关关系。这说明CSCs、VEGF、Notch1之间可能存在某种联系。CSCs具有很强的致瘤、血管侵袭能力; 在增殖过程中, CSCs可能会分泌某种化学因子刺激局部形成适合其生长的微环境, 即一个具有新生血管的微环境[24], 一方面为肿瘤的演进准备所必需的氧气和营养物质; 另外一方面, 如果抑制VEGF信号通路, 不仅微环境中的新生血管会减少, 且CSCs的数量明显减少, 肿瘤生长缓慢[25]。而VEGF可以通过Notch1信号通路调节内皮细胞的增殖, 并促进血管的发育和成熟[26], 最终导致肿瘤的生长、浸润以及转移。本研究多因素分析显示CD133和Notch1蛋白的表达情况和TNM分期是影响NSCLC患者的独立预后因素, 而VEGF并非NSCLC患者的独立预后因素。
综上所述, CSCs可能通过诱导VEGF基因表达促进新生血管形成是NSCLC组织发生侵袭、转移的关键事件, 而Notch1基因过表达又进一步促进了NSCLC的侵袭与转移。因此, 早期联合检测CD133、Notch1和VEGF的表达可作为评估NSCLC患者转移和预后的指标之一。
| [1] | Ramalingam SS, Owonikoko TK, Khuri FR. Lung cancer:new biological insights and recent therapeutic advances[J]. CA Cancer J Clin,2011, 61 (2) : 91-112. DOI: 10.3322/caac.v61:2. |
| [2] | O'brien CA, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature,2007, 445 (7123) : 106-10. DOI: 10.1038/nature05372. |
| [3] | Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al. Identification and expansion of human colon-cancer-initiating cells[J]. Nature,2007, 445 (7123) : 111-5. DOI: 10.1038/nature05384. |
| [4] | Chiba T, Kamiya A, Yokosuka O, et al. Cancer stem cells in hepatocellular carcinoma:Recent progress and perspective[J]. Cancer Lett,2009, 286 (2) : 145-53. DOI: 10.1016/j.canlet.2009.04.027. |
| [5] | Weigmann A, Corbeil D, Hellwig A, et al. Prominin, a novel microvilli-specific polytopic membrane protein of the apical surface of epithelial cells, is targeted to plasmalemmal protrusions of non-epithelial cells[J]. Proc Natl Acad Sci U S A,1997, 94 (23) : 12425-30. DOI: 10.1073/pnas.94.23.12425. |
| [6] | Garcia A, Kandel JJ. Notch:a key regulator of tumor angiogenesis and metastasis[J]. Histol Histopathol,2012, 27 (2) : 151-6. |
| [7] | Wang Z, Li Y, Banerjee S, et al. Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth, migration and invasion, and induces apoptosis via inactivation of Akt, mTOR, and NF-kappaB signaling pathways[J]. J Cell Biochem,2010, 109 (4) : 726-36. |
| [8] | Dome B, Timar J, Dobos J, et al. Identification and clinical significance of circulating endothelial progenitor cells in human non-small cell lung cancer[J]. Cancer Res,2006, 66 (14) : 7341-7. DOI: 10.1158/0008-5472.CAN-05-4654. |
| [9] | Yin AH, Miraglia S, Zanjani ED, et al. AC133, a novel marker for human hematopoietic stem and progenitor cells[J]. Blood,1997, 90 (12) : 5002-12. |
| [10] | Miraglia S, Godfrey W, Yin AH, et al. A novel five-transmembrane hematopoietic stem cell antigen:isolation, characterization, and molecular cloning[J]. Blood,1997, 90 (12) : 5013-21. |
| [11] | Eramo A, Lotti F, Sette G, et al. Identification and expansion of the tumorigenic lung cancer stem cell population[J]. Cell Death Differ,2008, 15 (3) : 504-14. DOI: 10.1038/sj.cdd.4402283. |
| [12] | Zhao P, Li Y, Lu Y. Aberrant expression of CD133 protein correlates with Ki-67 expression and is a prognostic marker in gastric adenocarcinoma[J]. BMC Cancer,2010, 10 : 218. DOI: 10.1186/1471-2407-10-218. |
| [13] | Tang KH, Ma S, Lee TK, et al. CD133(+) liver tumor-initiating cells promote tumor angiogenesis, growth, and self-renewal through neurotensin/interleukin-8/CXCL1 signaling[J]. Hepatology,2012, 55 (3) : 807-20. DOI: 10.1002/hep.24739. |
| [14] | Yang ZL, Zheng Q, Yan J, et al. Upregulated CD133 expression in tumorigenesis of colon cancer cells[J]. World J Gastroenterol,2011, 17 (7) : 932-7. DOI: 10.3748/wjg.v17.i7.932. |
| [15] | Ding J, Jin W, Chen C, et al. Tumor associated macrophage cancer cell hybrids May acquire cancer stem cell properties in breast cancer[J]. PLoS One,2012, 7 (7) . |
| [16] | Rentala S, Yalavarthy PD, Mangamoori LN. Alpha 1 and beta 1 integrins enhance the homing and differentiation of cultured prostate cancer stem cells[J]. Asian J Androl,2010, 12 (4) : 548-55. DOI: 10.1038/aja.2010.20. |
| [17] | Janikova M, Skarda J, Dziechciarkova M, et al. Identification of cd133(+)/nestin+ putative cancer stem cells in non-small cell lung cancer[J]. Biomed Papers:Olomouc,2010, 154 (4) : 321-6. DOI: 10.5507/bp.2010.048. |
| [18] | Ferrandina G, Bonanno G, Pierelli L, et al. Expression of CD133-1 and CD133-2 in ovarian cancer[J]. Int J Gynecol Cancer,2008, 18 (3) : 506-14. DOI: 10.1111/j.1525-1438.2007.01056.x. |
| [19] | Woo T, Okudela K, Mitsui H, et al. Prognostic value of CD133 expression in stage I lung adenocarcinomas[J]. Int J Clin Exp Pathol,2010, 4 (1) : 32-42. |
| [20] | Immervoll H, Hoem D, Sakariassen PØ, et al. Expression of the "stem cell marker" CD133 in pancreas and pancreatic ductal adenocarcinomas[J]. BMC Cancer,2008, 8 : 48. DOI: 10.1186/1471-2407-8-48. |
| [21] | Schneider M, Huber J, Hadaschik B, et al. Characterization of colon cancer cells:a functional approach characterizing CD133 as a potential stem cell marker[J]. BMC Cancer,2012, 12 : 96. DOI: 10.1186/1471-2407-12-96. |
| [22] | Xu YH, Zhang GB, Wang JM, et al. B7-H3 and CD133 expression in non-small cell lung cancer and correlation with clinicopathologic factors and prognosis[J]. Saudi Med J,2010, 31 (9) : 980-6. |
| [23] | Salnikov AV, Gladkich J, Moldenhauer G, et al. CD133 is indicative for a resistance phenotype but does not represent a prognostic marker for survival of non-small cell lung cancer patients[J]. Int J Cancer,2010, 126 (4) : 950-8. |
| [24] | Balint K, Xiao M, Pinnix CC, et al. Activation of notch1 signaling is required for beta-catenin-mediated human primary melanoma progression[J]. J Clin Invest,2005, 115 (11) : 3166-76. DOI: 10.1172/JCI25001. |
| [25] | Pancewicz J, Nicot C. Current views on the role of Notch signaling and the pathogenesis of human leukemia[J]. BMC Cancer,2011, 11 : 502. DOI: 10.1186/1471-2407-11-502. |
| [26] | 吴科荣, 许乐, 张立, 等. Notch1和Jagged1表达与肾透明细胞癌发病及预后[J]. 中国中西医结合外科杂志,2012, 18 (2) : 140-5. |
| [27] | Calabrese C, Poppleton H, Kocak M, et al. A perivascular niche for brain tumor stem cells[J]. Cancer Cell,2007, 11 (1) : 69-82. DOI: 10.1016/j.ccr.2006.11.020. |
| [28] | Caolo V, Van Den Akker NM, Verbruggen SA, et al. Feed-forward signaling by membrane-bound ligand receptor circuit:the case of notch delta-like 4 ligand in endothelial cells[J]. J Biol Chem,2010, 285 (52) : 40681-9. DOI: 10.1074/jbc.M110.176065. |
 2015, Vol. 35
2015, Vol. 35
