2. 解放军总医院普通外科, 北京 100853 ;
3. 解放军401医院肿瘤内科, 山东 青岛 266071
2. Department of General Surgery, General Hospital of PLA, Beijing 100853, China ;
3. Department of Medical Oncology, 401 Hospital of PLA, Qingdao 266071, China
增殖诱导配体(APRIL, 又称为TNFSF13/CD256)属于肿瘤坏死因子超家族。既往研究观察到APRIL在肿瘤发展及免疫系统均发挥重要作用。APRIL的受体为BCMA (B cell maturation antigen)和TACI (transmembrane activator and calcium modulator and cyclophilin ligand interactor), 这些受体表达在T细胞、B细胞、肿瘤细胞表面[1-3]。APRIL作为一种自分泌或旁分泌生长因子而促进肿瘤的形成及肿瘤细胞的增殖与存活[4-5]。同时APRIL与T细胞、B细胞的增殖、存活以及功能密切相关[6-7]。APRIL可促进结肠癌细胞系在体外和动物体内的生长和转移[8]。进行过5-FU辅助治疗的大肠癌患者中, 间质APRIL阳性的患者预后较差[9]。在大肠癌、膀胱癌、卵巢上皮癌、头颈部癌的免疫组织化学研究均未发现肿瘤原发灶APRIL表达与预后的相关性[9-10]。在一个小样本研究中, 对52例乳腺癌原发灶APRIL免疫组化染色也未观察到肿瘤APRIL阳性染色与预后的关联性[11]。本研究通过免疫组织化学方法观察APRIL在130例乳腺癌原发灶的分布情况, 并分析其与CD8、CD4阳性淋巴细胞浸润的关系, 分析了APRIL表达对早期乳腺癌术后无病生存(disease free survival, DFS)和总生存(overall survival, OS)的预后预测价值。
1 材料与方法 1.1 研究对象纳入标准2000年1月~2002年12月在解放军总医院手术的具有完整临床及随访资料以及病理标本的Ⅰ~Ⅲ期女性乳腺癌患者。术前检查未发现远处转移, 病理证实为乳腺原发肿瘤, 本院病理科保存有原发肿瘤的石蜡包埋标本, 有完整的临床资料。共143例符合标准。对符合标准的143个患者进行电话随访, 失访13例, 最终有130例患者被纳入。
1.2 免疫组织化学染色方法调阅130例乳腺癌患者石蜡组织标本, 连续切片3张3 μm薄片分别置于阳离子防脱片上。石蜡切片65℃烘烤2 h, 二甲苯脱蜡10 min×2次, 梯度乙醇水化, 蒸馏水漂洗2 min×3次。将组织切片置于柠檬酸缓冲液(pH 6.0)或Tris-EDTA缓冲液(pH 9.0)中进行高压修复, 3% H2O2中避光室温孵育10 min, 山羊血清37℃孵育10 min后滴加一抗工作液, 4℃冰箱保湿盒内过夜。所用一抗为:兔抗人APRIL多克隆抗体(NOVUS, NB100-92295, 1:100), 鼠抗人CD8单克隆抗体(DAKO, 623, 稀释度1:100), 兔抗人CD4单克隆抗体(中衫金桥, ZA-0519, 稀释度1:100)。次日取出保湿盒, 复温30 min。漂洗后滴加适量兔鼠通用型EnVisionTM二抗工作液(DAKO), 37℃孵箱孵育30 min。以上所有步骤前后均用PBS缓冲液漂洗5 min×3次。DAB显色1~3 min, 苏木素复染胞核1~2 min, 盐酸酒精分化, 温水返蓝约5 min, 显微镜下观察染色及分化程度。梯度乙醇脱水, 二甲苯透明, 中性树胶封片保存。实验设阳性对照和阴性对照, APRIL阳性片为证实有目的分子高表达的人结肠癌组织, 其他抗体阳性片为人扁桃体。阴性对照以一抗稀释液代替一抗。
1.3 免疫组化结果人工判读方法组织切片由2位独立的病理医师(对临床和预后情况不知晓)分别进行分析, 核对所得结果, 获得共识。APRIL+、CD4+、CD8+间质细胞计数方法如下:LEICA DM2000显微镜下在切片肿瘤区域随机取15个高倍视野(400×), 镜下计数间质阳性细胞数, 得出平均每个高倍视野的阳性细胞数并除以高倍视野面积0.31 mm2, 得出平均每平方厘米阳性细胞数。肿瘤细胞质染色强度判读:肿瘤细胞质染色强度分为3个等级:1=浅黄、2=棕黄、3=深棕, 分别计数不同染色强度肿瘤细胞占所有被观察的肿瘤细胞的百分比, 分别为A%、B%和C%, 得出最终的肿瘤细胞质染色强度=1×A%+2×B%+3×C%。
1.4 HER-2阳性状态判别标准患者的HER-2阳性状态均查自本院病历记载。本院的乳腺癌HER-2阳性的判别严格遵循国际公认的临床判定标准:免疫组织化学染色HER-2(+++)即被判定为HER-2扩增阳性, 免疫组织化学染色HER-2(+)和(-)即被判定为HER-2扩增阴性。免疫组织化学染色HER-2(++)的病例进一步行荧光原位杂交(FISH)基因检测, 明确HER-2基因存在扩增的判定为HER-2扩增阳性, 否则判定为阴性。文中"HER-2扩增阳性"简称为"HER-2阳性", "HER-2扩增阳阴性"简称为"HER-2阴性"。
1.5 统计学方法使用SPSS13.0软件包对数据进行统计学处理。连续变量的实验参数之间以及与连续变量的乳腺癌临床病理参数的相关性采用Spearman秩和检验。连续变量与二分类变量临床病理参数的相关性采用Mann-Whitney U检验, 与三分类变量临床病理参数的相关性采用Kruskal-Wallis H检验。分类变量之间的相关性采用Perason Chi-Square检验。年龄按照中位数(48岁)分为2组并赋值、Ki-67按照公认临界值14%分为2组并赋值, 所得数据参与单因素和多因素的生存分析。APRIL阳性间质细胞密度分组用ROC曲线分析得出截点值为26.13/mm2。APRIL肿瘤细胞质强度分组用ROC曲线分析得出截点值为0.83。生存分析选用Kaplan-Meier法, 单因素分析显著性检验选用Log-rank检验, 多因素分析采用COX风险比例模型。P < 0.05认为有统计学意义, 单因素P < 0.1被认为存在相关趋势。
2 结果 2.1 乳腺癌患者特征对符合纳入标准的143例患者进行电话随访, 失访13例, 最终有130例患者被纳入, 失访率为9.1%。截至最后随访期2012年7月3日, 中位随访时间112个月(7.7~138.6个月)。患者中位年龄48岁(25~80岁)。所有患者均未接受手术去势、新辅助放化疗和辅助靶向治疗。33例局部复发和/或转移, 29例死亡; 无病生存率74.6%, 总生存率77.7%, 中位无病生存、中位无远处转移生存和中位总生存期尚未达到。130例乳腺癌患者临床病理因素描述见表 1。
| 表 1 130例乳腺癌患者的临床病理特征 Table 1 Clinicopathological features of the 130 patients with breast cancer |
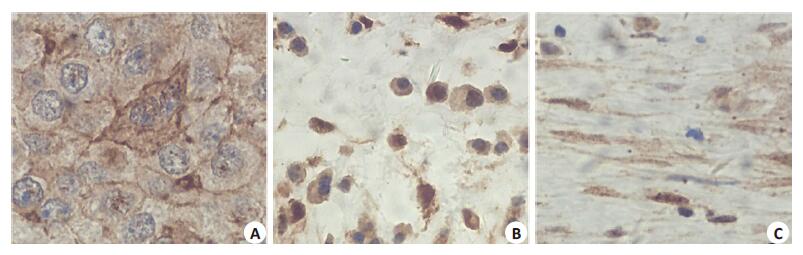
在大部分病例均可观察到肿瘤细胞的细胞质为APRIL阳性(图 1A), 肿瘤间质存在APRIL阳性免疫细胞, 部分呈淋巴细胞形态(细胞呈圆球形, 细胞核圆形或椭圆形, 细胞核苏木素染色深, 胞质很少), 部分呈粒细胞形态(细胞呈圆球形, 细胞核有凹陷或呈分叶状, 细胞质比淋巴细胞丰富, 形态比淋巴细胞略大), 部分呈单核巨噬细胞形态(形态显著大于淋巴细胞, 细胞核呈多形性, 核偏位, 细胞质丰富)(图 1B), 并可观察到间质中的基质染色阳性(图 1C)。
|
图 1 乳腺癌原发灶APRIL免疫组织化学染色结果 Figure 1 Immunohistochemistry for APRIL in breast cancer (Original magnification:×400). A:APRIL-positive tumor cells; B:APRIL-positive interstitial cells; C:APRIL-positive extracellular matrix. |
APRIL肿瘤细胞质强度与APRIL阳性间质细胞密度正相关(Spearman, 相关系数=0.228, P=0.009)。APRIL肿瘤细胞质强度与Ki67百分比正相关(Spearman, 相关系数=0.255, P=0.003), 与年龄、月经状况、临床分期、SBR分级、癌栓、ER、PR、HER-2均不相关。APRIL阳性间质细胞密度与年龄、月经状况、临床分期、SBR分级、癌栓、ER、PR、HER-2、Ki67均不相关。
2.4 APRIL阳性间质细胞密度与淋巴细胞亚群的相关性分析APRIL阳性间质细胞密度与CD4+间质细胞密度(Spearman, 相关系数=0.432, P < 0.001), CD8+间质细胞密度(Spearman, 相关系数=0.437, P < 0.001)均正相关。
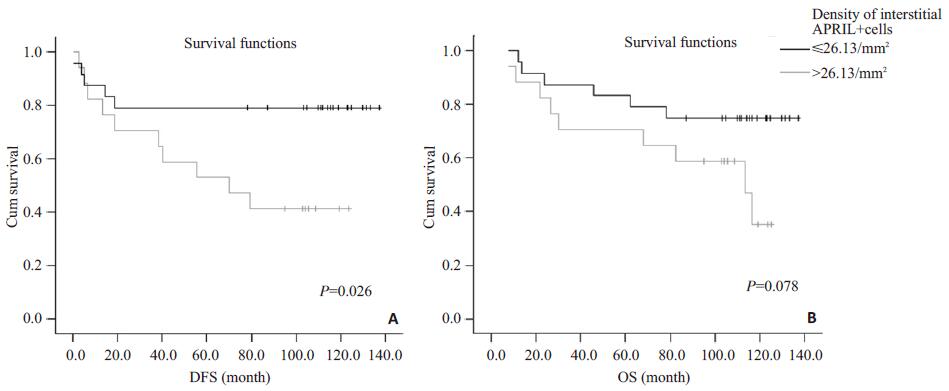
2.5 APRIL表达与预后的关系各临床病理因素和APRIL表达情况与DFS、OS关系的Cox单因素分析结果见表 2。总体单因素分析和Cox多因素分析均未见APRIL肿瘤细胞质强度和APRIL阳性间质细胞密度与DFS、OS的相关性。进一步将患者按照ER和PR的表达情况将患者分为两组分别进行生存分析, 即激素受体阴性组(ER和PR均为阴性)和激素受体阳性组(ER和/或PR阳性)。APRIL肿瘤细胞质强度在激素受体阴性组和阳性组均未见到与预后的相关性。APRIL阳性间质细胞密度在激素受体阳性患者与预后不相关。激素受体阴性组的Log-Rank单因素分析中, APRIL阳性间质细胞密度较高患者的DFS (病例数=24, 复发病例数=5, 平均DFS=70.198月)、OS (病例数=17, 死亡病例数=9, 平均DFS=85.718月)较密度较低患者的DFS (病例数=17, 复发病例数=10, 平均DFS=110.274月)(P=0.026)、OS (病例数=24, 死亡病例数=6, 平均DFS=112.599月)(P=0.078)延长。生存曲线见图 2。激素受体阴性患者的Cox多因素分析包含APRIL阳性间质细胞密度、年龄分组、临床分期、SBR分级、癌栓、HER2、Ki-67, APRIL阳性间质细胞密度是DFS (HR=0.313, 95% CI=0.107-0.920, P=0.035)的独立保护性预后因素。但由于激素受体阴性患者仅有41例, 该多因素分析的结果的可靠性仍有待于更大样本研究的证实。
| 表 2 各影响因素与乳腺癌患者DFS和OS关系的COX单因素分析 Table 2 Univariate COX analysis of correlation of the potential risk factors with DFS and OS of the patients |
|
图 2 激素受体阴性乳腺癌原发灶APRIL阳性间质细胞密度与DFS和OS关系的Kaplan-Meier曲线 Figure 2 Kaplan-Meier analysis of correlation between disease free survival (DFS), overall survival (OS) and density of interstitial APRIL-positive cells in hormone receptor-negative patients. A: DFS was significantly longer in patients with higher densities (>26.13/mm2) than those with lower densities (≤26.13/mm2) of interstitial APRILpositive cells (P=0.026). B: Patients with higher densities of interstitial APRIL-positive cells tended to have a longer OS than those with lower density of interstitial APRIL-positive cells, but the difference did not reached a statistical significance. |
在89个激素受体阳性患者的Log-Rank单因素检验中, 辅助内分泌治疗组患者的DFS (P=0.002)、DDFS (P=0.001)和OS (P=0.004)均显著长于无内分泌治疗组患者。在包含辅助内分泌治疗、年龄、临床分期、SBR分级、脉管癌栓、HER-2和Ki67百分比的COX多因素分析中, 辅助内分泌治疗是DFS (HR=0.234, 95%CI=0.089-0.614, P=0.003)、DDFS (HR=0.234, 95% CI=0.083-0.666, P=0.006)的独立预后因素。
3 讨论 3.1 APRIL染色阳性细胞包括APRIL合成细胞、通过类肝素硫酸酯蛋白聚糖储存APRIL的细胞APRIL是一种全长为250个氨基酸的Ⅱ型跨膜蛋白, 在高尔基体内经弗林蛋白酶在101~104氨基酸处水解后, 产生包含其细胞外段(全序列第105~250氨基酸)的可溶性增殖诱导配体(sAPRIL), sAPRIL保留了全长APRIL的生物学活性[12]。针对APRIL细胞内段的一抗的免疫组织化学可检测到能够合成APRIL的细胞类型, 而针对sAPRIL的一抗则可以同时检测到全长的APRIL和sAPRIL蛋白, 因此可标记合成APRIL的细胞和能够结合储存APRIL的结构[10, 12]。本研究中使用的抗体针对的是APRIL第183个氨基酸-丝氨酸周围的氨基酸残基, 因此是针对sAPRIL的一抗。本研究中免疫组织化学染色阳性细胞中包括了合成APRIL的细胞和能够通过合成类肝素硫酸酯蛋白聚糖(HSPG)与sAPRIL结合而储存APRIL的细胞, 由于肿瘤基质中存在HSPG, 因此也可观察到基质非细胞结构的阳性染色。
3.2 APRIL被间质细胞合成并以旁分泌的形式到达肿瘤细胞并促进肿瘤增殖Mhawech-Fauceglia等[10]分别利用针对APRIL细胞内段的一抗(只有合成APRIL的细胞内存在APRIL细胞内段, 因此只有合成APRIL的细胞为阳性)的免疫组化染色来观察54种实体瘤肿瘤中APRIL的合成和分布情况后发现, 除膀胱尿道上皮癌和鳞状细胞癌的肿瘤细胞合成APRIL以外, 包括乳腺癌在内的其他类型肿瘤中肿瘤细胞合成APRIL的现象极为罕见; 该研究中的130例乳腺癌中, 仅在1例患者观察到阳性肿瘤细胞; 但是各种类型肿瘤的间质普遍存在合成APRIL的间质细胞, 较正常组织中显著增多。本研究发现sAPRIL在间质细胞广泛表达。由于肿瘤细胞能够通过合成HSPG将APRIL结合储存在间质以及肿瘤细胞的细胞质[10, 13], 因此本研究中肿瘤细胞染色强度与APRIL阳性间质细胞密度正相关。APRIL可促进肿瘤细胞增殖并维持其生存, 肿瘤内APRIL高表达与肿瘤较强的侵袭性相关[4-5]。本研究还发现肿瘤细胞APRIL染色强度与代表肿瘤细胞增殖情况的Ki67呈正相关, 分析原因为APRIL被间质细胞合成并以旁分泌的形式到达肿瘤细胞并促进肿瘤增殖。
3.3 较高的APRIL阳性间质细胞密度提示肿瘤微环境内存在活跃的免疫反应巨噬细胞、中性粒细胞、活化T细胞和树突状细胞均能合成APRIL[1, 13-15]。荧光双标证实, 基底细胞癌和黑素瘤肿瘤间质中合成APRIL的细胞以中性粒细胞为主[13]。在本研究中, APRIL阳性间质细胞分别具有淋巴细胞、粒细胞和巨噬细胞的形态, 与既往研究相符合。如前所述, 活化的T细胞可合成分泌APRIL; 本研究的结果也证实了这一点:APRIL阳性间质细胞密度与CD4+间质细胞密度、CD8+间质细胞密度均高度正相关。因此, 肿瘤间质APRIL阳性细胞的增多提示肿瘤微环境内存在活跃的免疫反应。
3.4 较高的APRIL阳性间质细胞密度与较好的预后相关在本研究的激素受体阴性患者中, 有较高APRIL阳性间质细胞密度的患者的预后显著好于密度较低患者, 这提示激素受体阴性乳腺癌肿瘤微环境存在活跃的免疫反应的患者预后较好。但由于激素受体阴性患者仅有41例, 该结论可靠性仍有待于更大样本研究的证实。而在激素受体阳性患者, 由于内分泌治疗对不良预后患者的生存的显著改善作用, 掩盖了肿瘤免疫微环境免疫状态对预后的影响, 所以本研究未能在激素受体阳性患者观察到间质细胞APRIL表达与预后的关联性。如前言所综述, 既往针对多种肿瘤APRIL染色强度与预后的关系研究均未发现肿瘤APRIL表达与预后的关联性[9-11]。本研究也未发现乳腺癌细胞APRIL染色强度与预后的关系。
综上所述, 通过免疫组织化学染色的方法观察到乳腺癌间质免疫细胞广泛表达APRIL, 乳腺癌细胞APRIL染色强度与肿瘤细胞的增殖正相关, 提示免疫细胞可能通过旁分泌APRIL促进乳腺癌细胞增殖。在激素受体阴性患者, 乳腺癌间质APRIL阳性细胞增多与较好的预后相关。
| [1] | Stein JV, López-Fraga M, Elustondo FA, et al. April modulates B and T cell immunity[J]. J Clin Invest,2002, 109 (12) : 1587-98. DOI: 10.1172/JCI0215034. |
| [2] | Rennert P, Schneider P, Cachero TG, et al. A soluble form of B cell maturation antigen, a receptor for the tumor necrosis factor family member April, inhibits tumor cell growth[J]. J Exp Med,2000, 192 (11) : 1677-84. DOI: 10.1084/jem.192.11.1677. |
| [3] | Kimberley FC, Van Der Sloot AM, Guadagnoli M, et al. The design and characterization of receptor-selective April variants[J]. J Biol Chem,2012, 287 (44) : 37434-46. DOI: 10.1074/jbc.M112.406090. |
| [4] | Moreaux J, Veyrune JL, De Vos J, et al. April is overexpressed in cancer:Link with tumor progression[J]. BMC Cancer,2009, 9 : 83-9. DOI: 10.1186/1471-2407-9-83. |
| [5] | Wang G, Wang F, Ding W, et al. April induces tumorigenesis and metastasis of colorectal cancer cells via activation of the PI3K/Akt pathway[J]. PLoS One,2013, 8 (1) : e55298. DOI: 10.1371/journal.pone.0055298. |
| [6] | Mackay F, Leung H. The role of the BAFF/April system on T cell function[J]. Semin Immunol,2006, 18 (5) : 284-9. DOI: 10.1016/j.smim.2006.04.005. |
| [7] | Park SR, Kim PH, Lee KS, et al. April stimulates NF-κB-mediated HoxC4 induction for AID expression in mouse B cells[J]. Cytokine,2013, 61 (2) : 608-13. DOI: 10.1016/j.cyto.2012.10.018. |
| [8] | Wang GH, Lu MH, Wang JC, et al. Abnormal expression of April in colorectal cancer cells promotes tumor growth and metastasis[J]. Zhonghua Zhong Liu Za Zhi,2013, 35 (4) : 249-55. |
| [9] | Petty RD, Samuel LM, Murray GI, et al. April is a novel clinical chemo-resistance biomarker in colorectal adenocarcinoma identified by gene expression profiling[J]. BMC Cancer,2009, 9 : 434-44. DOI: 10.1186/1471-2407-9-434. |
| [10] | Mhawech-Fauceglia P, Allal A, Odunsi K, et al. Role of the tumour necrosis family ligand April in solid tumour development:Retrospective studies in bladder, ovarian and head and neck carcinomas[J]. Eur J Cancer,2008, 44 (15) : 2097-100. DOI: 10.1016/j.ejca.2008.07.007. |
| [11] | Pelekanou V, Kampa M, Kafousi M, et al. Expression of TNFsuperfamily members BAFF and April in breast cancer:immunohistochemical study in 52 invasive ductal breast carcinomas[J]. BMC Cancer,2008, 8 : 76-81. DOI: 10.1186/1471-2407-8-76. |
| [12] | López-Fraga M, Fernández R, Albar JP, et al. Biologically active April is secreted following intracellular processing in the Golgi apparatus by furin convertase[J]. EMBO Rep,2001, 2 (10) : 945-51. DOI: 10.1093/embo-reports/kve198. |
| [13] | Mhawech-Fauceglia P, Kaya G, Sauter G, et al. The source of April up-regulation in human solid tumor lesions[J]. J Leukoc Biol,2006, 80 (4) : 697-704. DOI: 10.1189/jlb.1105655. |
| [14] | Jang YS, Kim JH, Seo GY, et al. TGF-β1 stimulates mouse macrophages to Express April through Smad and p38MAPK/CREB pathways[J]. Mol Cells,2011, 32 (3) : 251-5. DOI: 10.1007/s10059-011-1040-4. |
| [15] | Litinskiy MB, Nardelli B, Hilbert DM, et al. DCs induce CD40-independent immunoglobulin class switching through BLyS and April[J]. Nat Immunol,2002, 3 (9) : 822-9. DOI: 10.1038/ni829. |
 2015, Vol. 35
2015, Vol. 35
