上皮-间充质转化(EMT)与肿瘤细胞的增殖、转移、耐药以及癌干细胞有密切关系, 并有研究认为EMT是肿瘤发生恶变的一个过渡形态, 也有观点认为EMT是肿瘤患者预后较差、死亡率高的原因之一[1-4]。在对胰腺癌的研究中也发现, 发生EMT的胰腺癌细胞更易于发生侵袭转移、耐药等。近年研究发现MSX2与多种癌细胞的耐药、增殖、转移能力有密切关系, 如过表达MSX2的PANC-1细胞对吉西他滨的耐药性明显增加[2]; 过表达MSX2可促进乳腺小叶分支导管的形成以及EMT的发生[3-4]; 那么MSX2对胰腺癌细胞EMT的发生有何影响呢, 这在国内外的研究中并无报道。本研究采用RNA干扰方法敲低胰腺癌PANC-1细胞中MSX2表达, 检测EMT标志分子的表达变化, 并观察细胞增殖、侵袭转移能力的变化, 进而探讨MSX2通过控制EMT来影响胰腺癌PANC-1细胞的侵袭转移情况。以往的研究多侧重于研究某一分子与癌细胞的生物学表现的直接关系, 而本研究则侧重研究MSX2分子通过EMT影响癌细胞的生物学特性, 这将对以后的肿瘤学研究提供新的思路。
1 材料与方法 1.1 材料人胰腺癌细胞PANC-1购自中科院上海生命科学研究院。DMEM、胎牛血清购自HyClone公司, 逆转录及PCR试剂盒购自Thermo scientific, qPCR试剂盒购自广州复能基因, shMSX2质粒购自上海艾博思生物科技有限公司, LipofectamineTM2000购自Invitrogen, 引物由上海生工合成, 小鼠抗人多克隆抗体MSX2、E-cadherin、Vimentin、β-catenin、兔抗小鼠二抗购自博士德生物技术有限公司, CCK-8试剂盒购自碧云天生物技术有限公司。质粒提取试剂盒购自Omega公司。
1.2 质粒转染与分组根据Omega质粒小提试剂盒说明书提取细菌质粒, 并测浓度及纯度用于转染。参照LipofectamineTM2000转染试剂说明书进行转染, 取对数生长期细胞消化收集计数, 以6×105/孔接种于6孔板培养过夜, 次日将孔中培养液换成无血清无抗生素的Opti-MEM, 培养1 h后加入质粒与OPTI-MEM混合液, 6 h后换成含10% FBS的培养液, 继续培养24 h后在倒置荧光显微镜下观察转染效率, 目测荧光数在70%左右可用于后续试验。根据转染质粒不同分为3组:PC-1组为没有做过处理的正常对照组, NC组为转染空质粒的阴性对照组, shMSX2-1、shMSX2-2、shMSX2-3组分别为转染不同MSX2干扰片段的处理组。
1.3 Real-time PCR检测MSX2、E-cadherin、Vimentin的表达按照Trizol试剂盒说明书抽提细胞总RNA。逆转录试剂盒合成cDNA第1链。PCR引物采用Premier 5.0软件设计, 由上海生工合成。Real-time PCR在ABI Step One机器上进行反应, 采用两步法进行扩增。引物:MSX2(广州复能基因HQPO011529), E-cadherin上游:5-ATTCTGATTCTGCTGCTCTTG-3, 下游:5-AGTAGTCATAGTCCTGGTCTT-3;vimentin上游:5-GA AGAGAACTTTGCCGTTGAAG-3, 下游:5-GAAGG TGACGAGCCATTTC-3。反应条件:预变性95℃, 10 min; 循环40次, 95℃、10 s, 60℃、20 s, 72℃、15 s; 溶解曲线条件机器默认。反应结束后通过溶解曲线判断扩增的特异性, 待测基因表达通过2-△△ct方法进行计算。
1.4 Western blot检测MSX2、E-cadherin、Vimentin蛋白的表达PANC-1细胞生长达到80%左右, PBS清洗2遍, 加入适量RIPA裂解液(用时以1:100体积加如PMSF), 细胞刮收集细胞, 冰浴30 min, 12 000 r/min离心15 min后, 取上清, 于-80℃保存备用。BCA法测定蛋白浓度后, 每孔上样30 μg, 10% SDS-PAGE凝胶电泳分离, 上层胶90 V, 30 min, 分离胶120 V, 2 h; 经90 V电转30 min, 使蛋白转移到PVDF膜上; 5%脱脂奶粉封闭2 h, 加一抗封闭4℃过夜; TBST漂洗(3次×10 min), 加入二抗室温孵育2 h, TBST室温摇床漂洗(3次×10 min), 化学发光显示。蛋白表达以光密度表示, 以目的蛋白/β-actin表示蛋白相对表达量。
1.5 CCK-8法检测shRNA-MSX2对PANC-1细胞增殖能力的抑制作用取对数生长期细胞以5000个/孔接种于96孔板中, 每孔200 μl培养液, 分3组:正常组、NC组和干扰组siMSX2-1, 每组3个复孔, 另外设置空白对照只加培养液不加细胞, 重复3次试验。将96孔板在正常条件下培养, 分别于24 h、2 d、3 d、4 d、5 d测定D450值, 测前2 h每孔加入10 μl CCK-8试剂, 用酶联免疫检测分析仪测定D450值。以空白对照孔调零, 测定各孔光密度值, 计算每组平均值, 以时间为横坐标, 光密度值为纵坐标绘制生长曲线图。
1.6 划痕试验检测shMSX2对PANC-1细胞迁移能力的影响12孔板培养的正常细胞和转染细胞, 待转染后24 h用无菌枪头沿孔的直径划直线, 用无菌PBS冲洗干净后, 加入无血清培养液培养, 分别于划痕后0、20、40 h于倒置荧光显微镜下观察细胞迁移生长情况, 定性判断细胞迁移能力变化。
1.7 Transwell小室试验检测shMSX2对PANC-1细胞侵袭能力的影响用无血清DMEM 1:4稀释Matrigel胶, 取80 μl包被Transwell小室底部膜, 37℃培养箱培养30 min凝固成胶, 重悬细胞使细胞浓度为(30~50)×104个/ml, 取200 μl接种于24孔板小室中, 下室加入含10%胎牛血清的培养液800 μl。正常培养40 h后取出小室以4%多聚甲醛固定20 min, 结晶紫染色30 min, 轻轻擦去上室面的细胞, 显微镜下分别取10个不同视野计数并拍照。
1.8 RT-PCR实验初步探索MSX2促进胰腺癌PANC-1细胞发生MET的分子机制RNA提取及逆转录方法同1.3, 2×PCR Master Mix进行PCR反应。snail上游:5-GAGGCGGTGGCAGA CTAG-3, 下游:5-GACACATCGGTCAGACCAG-3, 179 bp; slug上游:5-CATGCCTGTCATACCACAA C-3, 下游:5-GGTGTCAGATGGAGGAGGG-3, 169 bp; twist上游:5-GCCAGGTACATCGACTTCCTC T-3, 下游:5-TCCATCCTCCAGACCGAGAAGG-3, 122 bp; zeb1上游:5-CAGCTTGATACCTGTGAATG GG-3, 下游:5-TATCTGTGGTCGTGTGGGACT-3, 100 bp; GAPDH (上海生工PHS05), 片段大小138 bp。PCR产物经2%琼脂糖凝胶电泳鉴定, 紫外灯下拍照, 试验重复3次, gene5软件测量灰度值比较各组分子表达变化。
1.8 统计学分析计量资料数据均采用均数±标准差, 采用SPSS19.0统计软件处理实验数据, 两组数据比较采用t检验。
2 结果2.1特异性MSX2 shRNA转染PANC-1细胞
质粒提取后检测纯度D260/280在1.8~2.0之间, 浓度在0.7 μg/μl左右, 适合转染。转染后24 h在荧光显微镜下观察绿色荧光, 通过视野观察估测转染效率在70%左右(图 1), 可用于后续实验。
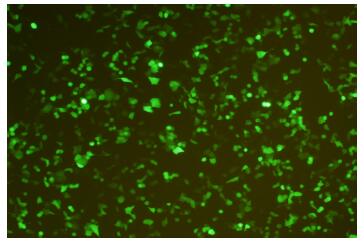
|
图 1 转染shMSX2-1后24 h荧光显微镜下观察判断转染效率 Figure 1 Transfection efficiency assessed by fluorescence microscopy 24 h after shMSX2-1 transfection in PANC-1 cells. |
转染后MSX2相对于正常组(PC-1)表达量变化(2-△△CT):正常组、阴性对照组、shMSX2-1组、shMSX2-2组、shMSX2-3组分别为1、1.097±0.036、0.091±0.005、0.479±0.175和0.349±0.012, 3个干扰组较正常组、阴性对照组差异有统计学意义(P < 0.05), 而正常组与阴性对照组之间差异无统计学意义(P > 0.05), 且shMSX2-1组干扰效率最高, 故选取shMSX2-1组用于后续试验。阴性对照组中E-cadherin、Vimentin变化较正常组差异无意义(P > 0.05), shMSX2-1组中E-cadherin表达升高, Vimentin降低, 差异均有统计学意义(P < 0.05, 表 1)。
| 表 1 EMT标志分子在基因水平的表达变化2-△△CT Table 1 Relative expression of EMT-related molecules at the mRNAlevel (2-△△CT, Mean±SD) |
shMSX2-1组中MSX2蛋白表达(0.07±0.015)明显低于NC组(0.496±0.095)和PC-1组(0.624±0.862), 且差异有统计学意义(P < 0.05), 而NC组与PC-1组差异无统计学意义(P > 0.05), 从蛋白水平印证了干扰效率的可用性。
E-cadherin蛋白在shMSX2-1组中表达明显高于NC和PC-1组, Vimentin蛋白表达明显低于NC组和PC-1组, 且两组差异变化均有统计学意义(P < 0.05), 而两各分子在NC组和PC-1组中表达差异无统计学意义(P > 0.05, 表 2)。说明干扰MSX2后可引起PANC-1细胞的上皮标志蛋白表达升高, 间质标志物波形蛋白表达下调, 有发生MET的趋势。
| 表 2 干扰前后EMT相关蛋白表达变化灰度值 Table 2 Expression of EMT-related E-cadherin and vimentin proteins after MSX2 interference (Mean±SD) |
增值试验发现shMSX2-1组细胞增值能力在第3天(0.798±0.146)较NC组(1.029±0.053)和PC-1组(1.096±0.045)明显受到抑制, 并且差异有统计学意义(P < 0.05), 而NC组与PC-1组差异无统计学意义(P > 0.05)。说明干扰MSX2后对PANC-1细胞的增殖有抑制作用(图 2)。
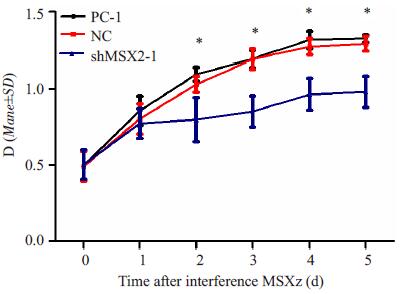
|
图 2 干扰前后细胞增殖能力变化 Figure 2 Proliferation ability of PANC-1 cells after interference MSX2. *P < 0.05. |
划痕试验发现shMSX2-1组细胞划痕在40 h时尚未愈合, 而PC-1组和NC组细胞在40 h时已经愈合完全(图 3), 表观发现干扰MSX2后使PANC-1细胞迁移能力减弱。

|
图 3 干扰前后细胞的迁移能力变化 Figure 3 Migration ability of PANC-1 cells after interference MSX2. |
小室试验观察到40 h后shMSX2组细胞的侵袭能力较对照组明显减弱, 差异有统计学意义(P < 0.05), 而PC-1组和NC组细胞的侵袭能力变化无统计学意义(P > 0.05, 图 4)。
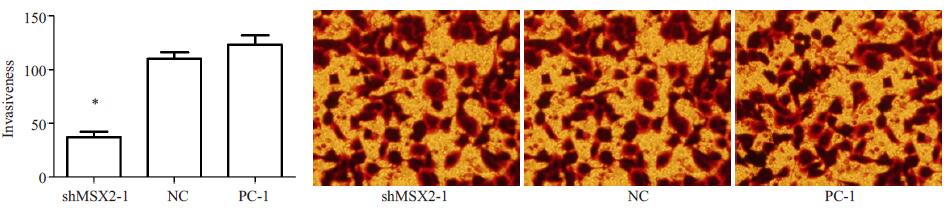
|
图 4 干扰前后细胞的侵袭能力变化 Figure 4 Invasiveness of PANC-1 cells after MSX2 interference. |
干扰MSX2后72 h细胞形态发生变化, 由原来松散的长梭形变成了连接紧密的椭圆形, NC组较PC-1组则没有明显变化, 提示干扰MSX2后细胞由间质形态向上皮表型转变(图 5)。
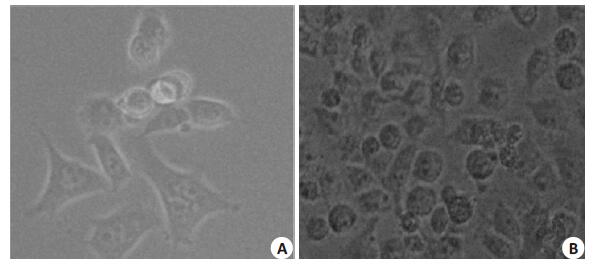
|
图 5 倒置显微镜随机选取的视野下观察干扰前后细胞的形态 Figure 5 Morphology of PANC-1cells after MSX2 interference (Original magnification:×100). A:Control group; B:Interference groug. |
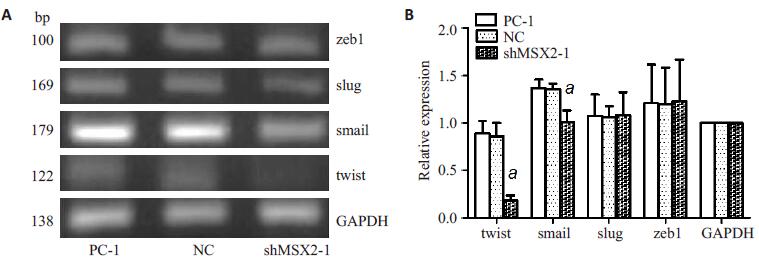
干扰MSX2后twist和snail基因表达明显降低(P < 0.05), 而slug和zeb1基因表达差异无显著性(P > 0.05, 图 6)。
|
图 6 RT-PCR检测干扰MSX2前后PANC-1细胞中twist、snail、slug、zeb1基因的表达变化 Figure 6 Expression of twist, snail, slug, and zeb1 mRNA levels in PANC-1 cells after MSX2 interference detected by RT-PCR. A:RT-PCR; B:Semi-quantitative analysis. *P > 0.05 vs PC-1 group. |
EMT是指细胞失去上皮特性逐渐向间充质转变, 在此过程中, 细胞极性消失, 连接松散, 更易于经血流转移, 在分子学上表现为上皮标志蛋白E-钙黏蛋白、紧密连接ZO-1等表达下调或缺失, 而波形蛋白、N-钙黏蛋白等间质标志蛋白表达升高[5]。
近年来研究表明MSX2在肿瘤的发生发展中发挥着重要作用, 并且与EMT关系密切。现今的研究认为EMT是恶性或者良性肿瘤恶性程度增加的一个过渡形态, 发生EMT的癌细胞具有更强的化疗药物耐药性、更强的转移侵袭能力, 还有研究显示发生EMT的癌细胞有肿瘤干细胞样特性[2-3]; 上皮标志蛋白E-cadherin是肿瘤细胞EMT过程中最重要的标志蛋白, 它是一种广泛表达于上皮细胞并介导细胞间连接的钙依赖性跨膜蛋白, 它的表达缺失伴随着上皮细胞表型的丧失, 使细胞粘附能力下降, 易于脱落发生转移, 而间质标志蛋白Vimentin表达升高使得细胞易于发生侵袭转移。Tsuji等[6]研究认为E-cadherin表达的缺失与再表达不是取决于不可逆转的基因缺失或者突变, 调节其表达的机制是可逆的; 还有研究表明在很多转移癌组织中的上皮标志蛋白表达高于原发灶[7], 并且在形态上也更偏向于上皮形态, 也就是说在一些癌细胞中由于E-cadherin等表达缺失发生了EMT, 癌细胞转移到其他脏器后又重新恢复上皮细胞特性, 发生了间叶-上皮转化(mesenchymalepithelial transition, MET), 既EMT的逆向过程, 表现为上皮细胞特性的获得, 如细胞间连接变得紧密, 上皮标志物E-cadherin等表达上调; 间质特性的丧失, 如如波形蛋白等表达下调。在肿瘤的发生发展中, 这种表观形态学上的转换具有重要意义, EMT使肿瘤细胞易于发生侵袭转移、对化疗药物耐药等, 使得患者预后极差, 而MET使肿瘤细胞由低粘附高转移的特性趋于上皮细胞特性转变, 对肿瘤细胞的恶性表现起到抑制作用, 如有研究认为发生MET的卵巢癌细胞对顺铂的敏感性较未发生MET的癌细胞高, 并提出EMT的逆转是解决卵巢癌顺铂耐药的假说[8-9]; 还有研究认为发生了MET的口腔鳞癌KB和KOSCC-25B细胞以及人前列腺癌细胞的侵袭转移能力明显降低[10-11]; 所以说在肿瘤的形态学发展中EMT-MET转变有着重要意义, 伴随着MET, 肿瘤细胞的表观特性也趋向于良性改变, 因此研究肿瘤细胞EMT-MET转变的分子机制尤为重要。为了研究在胰腺癌中MSX2与EMT关系, 本实验通过MSX2特异的shRNA转染胰腺癌PANC-1细胞, 敲低胰腺癌细胞中MSX2基因的表达, 通过Real time PCR和Western blot在基因和蛋白水平检测EMT标志分子的表达变化发现, 与正常组和阴性对照组相比, 干扰MSX2后的PANC-1细胞组E-cadherin表达上调, 而Vimentin表达下降, 差异均有统计学意义, 并且细胞在形态上也趋向于上皮形态转变:细胞由松散的长梭形变成了连接紧密的椭圆形, 试验中还通过Transwell和划痕试验发现干扰MSX2后的PANC-1细胞侵袭、转移能力明显减弱, 这些结果表明在胰腺癌中上皮标志蛋白E-cadherin的表达是可逆的, 并且伴随着E-cadherin蛋白表达的上调, 细胞的侵袭转移能力也降低, 干扰MSX2基因可使胰腺癌细胞的EMT程度降低, 有发生MET转变的趋势。此外通过CCK-8检测还发现干扰MSX2后的胰腺癌细胞增殖能力也明显受到抑制, 且随着转染时间的延长, 抑制程度也越明显, 差异均有统计学意义, 这进一步印证了干扰MSX2可促进PANC-1细胞发生MET转变这一观点。一般认为在肿瘤细胞中, 转录因子snail、slug、twist、zeb1等直接或间接的控制着EMT的过程[12]。我们通过RT-PCR检测发现, 干扰MSX2后可抑制EMT相关转录因子twist和snail的表达, 而slug和zeb1表达变化不明显, 说明在PANC-1细胞中MSX2可能通过转录因子twist和snail发挥其抑制EMT作用。
本研究发现, 针对MSX2基因的胰腺癌靶向治疗将在针对肿瘤细胞EMT/MET转换过程中发挥着关键作用, 以往的靶向治疗研究很少以肿瘤的EMT/MET转换为思路, 所以本实验结果的发表将为胰腺癌的靶向治疗提供一种新的理念, 为探究胰腺癌的发生发展开辟新的分支。
| [1] | Krantz SB, Shields MA, Dangi-Garimella S, et al. Contribution of epithelial-to-mesenchymal transition and cancer stem cells to pancreatic cancer progression[J]. J Surg Res,2012, 173 : 105-12. DOI: 10.1016/j.jss.2011.09.020. |
| [2] | Hamada S, Satoh K, Hirota M, et al. The Homeobox gene MSX2 determines chemosensitivity of pancreatic cancer cells via the regulation of transporter gene ABCG2[J]. J Cell Physiol,2012, 227 : 729-38. DOI: 10.1002/jcp.22781. |
| [3] | DiBari M, Ginsburg E, Plant J, et al. Msx2 induces epithelialmesenchymal transition in mouse mammary epithelial cells through upregulation of Cripto1[J]. J Cell Physiol,2009, 219 : 659-66. DOI: 10.1002/jcp.v219:3. |
| [4] | Satoh K, Hovey RC, Malewski T, et al. Progesterone enhances branching morphogenesis in the mouse mammary gland by increased ex-pression of Msx2[J]. Oncogene,2007, 26 : 7526-34. DOI: 10.1038/sj.onc.1210555. |
| [5] | Thiery JP. Epithelial-mesenchymal transitions in tumor progression[J]. Nat Rev Cancer,2002, 2 (6) : 442-54. DOI: 10.1038/nrc822. |
| [6] | Tsuji T, Ibaragi S, Hu GF. Epithelial-mesenchymal transition and cell cooperativity in metastasis[J]. Cancer Res,2009, 69 (18) : 7135-9. DOI: 10.1158/0008-5472.CAN-09-1618. |
| [7] | Iwatsuki M, Mimori K, Yokobori T, et al. Epithelial-mesenchymal transition in cancer development and its clinical significance[J]. Cancer Sci,2010, 101 (2) : 293-9. DOI: 10.1111/cas.2010.101.issue-2. |
| [8] | Yew KH, Crow J, Hirst J, et al. Epimorphin-induced MET sensitizes ovarian cancer cell to platinum[J]. PLoS One,2013, 8 (9) : e72637. DOI: 10.1371/journal.pone.0072637. |
| [9] | Marchini S, Fruscio R, Clivio L, et al. Resistance to Platinum-based chemotherapy is associated with epithelial to mesenchymal transition in epithelial ovarian cancer[J]. Eur J Cancer,2013, 49 : 520-30. DOI: 10.1016/j.ejca.2012.06.026. |
| [10] | Hong KO, Kim JH, Hong JS, et al. Inhibition of Akt activity induces the mesenchymal-to-epithelial reverting transitionwith restoring E-cadherin expression in KB and KOSCC-25B oral squamous cell carcinoma cells[J]. J Exp Clin Cancer Res,2009, 28 : 28. DOI: 10.1186/1756-9966-28-28. |
| [11] | Roca H, Hernandez J, Weidner S, et al. Transcription factors OVOL1 and OVOL2 induce the mesenchymal to epithelial transition in human cancer[J]. PLoS One,2013, 8 (10) : e76773. DOI: 10.1371/journal.pone.0076773. |
| [12] | 丛宁宁, 张庆瑜. EMT在消化系肿瘤中的研究进展[J]. 世界华人消化杂志,2013, 21 (3) : 205-10. |
 2015, Vol. 35
2015, Vol. 35
