2. 军事医学科学院干细胞与再生医学实验室, 北京 100850
2. Stem Cell and Regenerative Medicine Lab, Beijing Institute of Transfusion Medicine, Beijing 100850, China
肾小管上皮细胞(RTEC)具有强大的再生与修复功能, 如在经历了缺血或肾毒性物质引起的急性肾损伤后, 肾脏功能仍然可以恢复, 损伤的肾小管上皮细胞很快又会被新生的肾小管上皮细胞代替[1]。新生肾小管上皮细胞来源于哪里?主要有三个方面, 一是来源于肾脏的固有细胞; 二是来源于循环中的骨髓间充质干细胞; 三是来源于肾组织干细胞[2]。近年来, 有关干细胞尤其是骨髓间充质干细胞(BMSCs)在AKI中的作用争议较多, 最近的一项研究表明, 外周注射的BMSC大约有85%以上处于细胞周期的G0/Gl期, 无法在损伤部位长期的存活、增殖和分化, 且经静脉注射的BMSC多滞留于肝脏和肺脏, 仅有1%的BMSC到达肾脏的损伤部位, 故难以改善肾损伤[3]。目前多数学者和研究认为肾小管上皮细胞的自我更新主要是依赖于肾脏本身的组织干细胞作用来实现的, 这一类细胞可以动员至损伤部位并分化为肾小管上皮细胞[4]。2004年Oliver等首次提出肾组织干细胞(kidney stem cell, KSC)存在于肾乳头的干细胞壁龛中, 并证实了存在于此处KSC参与了缺血损伤的肾小管上皮细胞的修复[5-6], 在我们实验室之前的研究中已经成功的从大鼠肾乳头处分离并稳定培养出了KSC, 并证实了该细胞与BMSCs具有相似的表型特征[7-8], 那么KSC是否可以直接分化为肾小管上皮细胞?正是本研究将探讨的问题。
1 材料和方法 1.1 实验器材与仪器 1.1.1 细胞实验主要器材T25细胞培养瓶、Transwell 24孔板(膜孔径0.4 mm)、Transwell 6孔板(膜孔径0.4 mm)、15 ml离心管均购自Corning, 手术器材包括剪刀、钳子、镊子、显微手术剪等。
1.1.2 主要设备调温低速离心机(日本KUBOTA KR/ 702J), 台式高速冷冻离心机(德国Sigma), UV5600型二氧化碳培养箱, 三气培养箱(德国Heraeus), IX70型倒置荧光显微镜(日本Olympus), 解剖显微镜(重庆奥特光学仪器有限公司), 流式细胞分选仪(美国BD FACS Calibur), IQ5实时定量荧光PCR仪(美国Bio-Rad)。
1.2 主要试剂及抗体 1.2.1 细胞培养间充质干细胞(MSCs)原代培养基(北京金泽小星生物科技有限公司, 基础成分a-MEM, 血清含量6%), 肾脏上皮细胞生长培养基(REGM)购自美国Lonza、DMEM/F12培养基、0.25%胰蛋白酶、胎牛血清(FBS)(美国Gibco)、胶原酶I (美国Sigma)。诱导培养基的配制MSC培养基中加入3种生长因子:Activin A 10 ng/ml (美国Peprotech), BMP-7 10 ng/ml (美国Peprotech), 维甲酸5 mmol/L (美国Sigma)。
1.2.2 试剂与抗体免疫荧光:小鼠抗E-Cadherin多抗、兔抗ZO-1多抗(santa cruz)、二抗购自中杉金桥公司。细胞流式:小鼠抗CK-18多抗(abcam)、山羊抗小鼠647 (Invitrogen Alexa)。qRT-PCR试剂:cDNA反转录试剂盒、qPCR扩增试剂盒(日本TOYOBO)。
1.3 动物及细胞来源4周龄清洁级雄性Sprague-Dawley (SD)大鼠, 由中国医学科学院协和医科大学实验动物研究所提供, 动物许可证号:SCXK (京)20090007。大鼠肾小管上皮细胞(RTEC) NRK-52E购自中科院上海细胞库。
1.4 实验方法 1.4.1 KSC分离培养、传代与鉴定4周岭雄性SD大鼠取双肾, 剥离肾被膜, 置于解剖显微镜下, 沿冠状面纵行切开肾脏, 提起输尿管可见花瓣状乳突结构, 持显微剪将乳突前尖部完整剪下置入EP管中, PBS清洗、剪碎后加入胶原酶I充分消化, 离心, 弃上清, 接种于25 cm培养瓶中, 置于37℃二氧化碳细胞培养箱内, 72 h后于显微镜下观察细胞的贴壁生长情况并换液, 之后每隔2~3 d换液, 当细胞生长至70%~80%融合时以1:2的比例进行细胞传代。KSC的鉴定方法见参考文献[8], 简言之, 通过细胞流式检测KSC表面标记(CD29, CD44, CD90阳性表达, CD45阴性表达), 通过成骨、成脂诱导培养鉴定KSC分化能力。
1.4.2 RTEC的培养和传代应用的培养基为10%胎牛血清DMEM/F12, 按1:5比例传代。
1.4.3 KSC向RTEC的诱导分化实验分组:分为诱导组(应用诱导培养基培养3 d, 更换为REGM培养基2 d, 之后再换成诱导培养基, 轮换2次共10 d, 与此同时在Transwell培养板上室加入缺氧损伤的RTEC, 每3 d更换1次上室细胞), 对照组(继续应用MSC培养基培养)。缺氧损伤的RTEC Transwell上室的准备:将RTEC消化成单细胞悬液, 接种于Transwell的上室(24孔板上室2000 cells/孔, 6孔板上室2×104 cells/孔), 此时6孔板或24孔板下室未放置细胞, 稳定生长24 h后PBS冲洗RTEC表面2遍(上下室均冲洗), 然后上下室均更换为含1%FCS的DMEM/F12培养基, 置于三气培养箱中进行低氧刺激培养(1% O2+5% CO2+94% N2)4 h后取出, PBS冲洗上下室2遍, 然后更换为含10%FCS的DMEM/F12培养基, 置于21%二氧化碳培养箱中进行复氧2 h, 再次PBS冲洗上下室2遍, 上室更换为REGM培养基。诱导方案模式图见图 1。

|
图 1 诱导方案模式图 Figure 1 Schematic protocol of induction of the KSCs. |
P3代细胞以1× 105/孔的密度接种于6孔培养板中, 24 h后细胞贴壁生长, 分别按照对照组、诱导组方案处理KSC, 10 d后通过细胞流式检测CK18细胞阳性率。具体方法KSC重悬于100 ml PBS中, 加入一抗2 ml, 4℃摇床反应30 min, 再加入相应二抗1 ml, 4℃摇床, 避光反应30 min, PBS清洗3次经100目筛网过筛后上机检测。
1.4.5 细胞的免疫荧光检测P3代KSC以1×104/孔的密度接种于24孔培养板中, 24 h后细胞贴壁生长, 分别按照对照组、诱导组方案处理KSC, 10 d后进行免疫荧光染色观察CK-18、E-cadherin、ZO-1的表达。具体方法KSC经4%多聚甲醛室温固定、0.1% Triton-x-100破膜、10%山羊血清封闭30 min后, 加入一抗4℃过夜, 再依次加入二抗、DIPI, 置于共聚焦荧光显微镜下观察拍照。
1.4.6 qRT-PCR方法检测细胞基因表达差异应用qRTPCR方法分别检测对照组和诱导组CK-18、E-cadherin和AQP-1基因表达量差异。用Trizol法提取总RNA, 按照cDNA反转录试剂盒说明将RNA反转录成cDNA, 然后进行PCR反应:引物序列、退火温度(Tm)、产物片断见表1, 每个标本设3个重复管, 反应条件:95℃预变性2 min→(95℃ 15 s→Tm℃ 20 s→72℃ 30 s→80℃ 10 s)×45循环→95℃终末延伸10 s, 软件分析基因相对表达量。所有引物均由Iinvitrogen公司设计合成。GAPDH上游引物序列5'-AGACAGCCGCATCTTCTTGT-3', 下游引物序列5'-TTCCCATTCTCAGCCTTGAC-3', 产物238 bp; E-cadherin上游引物序列5'-AAA GCAGGAAGAAAACACCACTC-3', 下游引物序列5'-AAAGGGCACGCTATCAACATTAG-3', 产物172 bp; CK-18上游引物序列5'-TTGAAACCCGAGATGG GAAA-3', 下游引物序列5'-GGCCATTCACTTGGAC ATGAT-3', 产物62 bp; AQP1上游引物序列5'-GGCTTGTCTGTGGCTCTTG-3', 下游引物序列5'-ATCATCAGCATC CAGGTCATAC-3', 产物261 bp。
1.5 数据的统计分析采用SPSS13.0软件进行统计学分析, 计量资料以均数±标准差表示, 两组间比较采用成组t检验, P < 0.05为差异有统计学意义。
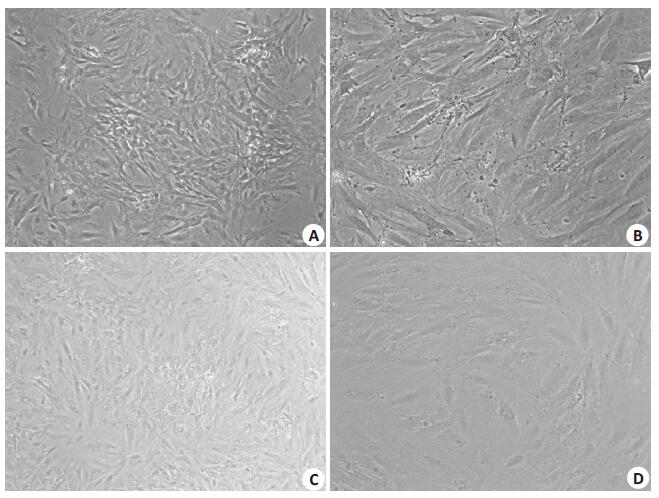
2 结果 2.1 形态变化未诱导KSC呈纺锤形、成纤维状生长, 经诱导培养后, KSC生长旺盛, 部分变成圆形、椭圆形, 为类上皮细胞样形态(图 2)。
|
图 2 诱导培养后细胞形态变化 Figure 2 Morphological changes of KSCs in control (A, B) and induced (C, D) groups (Riginal magnification:A, C: original magnification:× 40; B, D: original magnification:×100). |
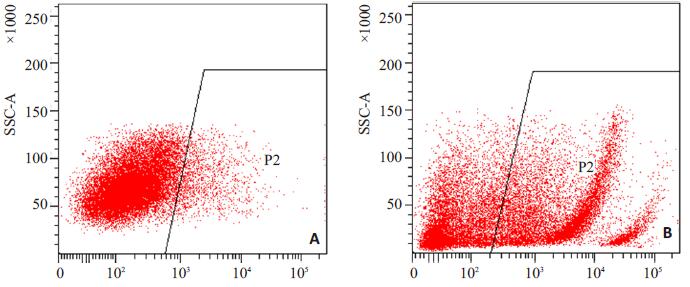
细胞流式结果显示, 对照组CK-18阳性率为6.5%, 而经细胞因子联合缺氧损伤RTEC共培养诱导后, 诱导组CK-18阳性率为44.2%, 较对照组明显升高(图 3)。
|
图 3 细胞流式检测CK-18阳性率 Figure 3 Flow cytometry for detecting CK-18 positive rate in the control and induced cells. A: Control group (P2, 6.5%); B: Induced group (P2, 44.2%). |
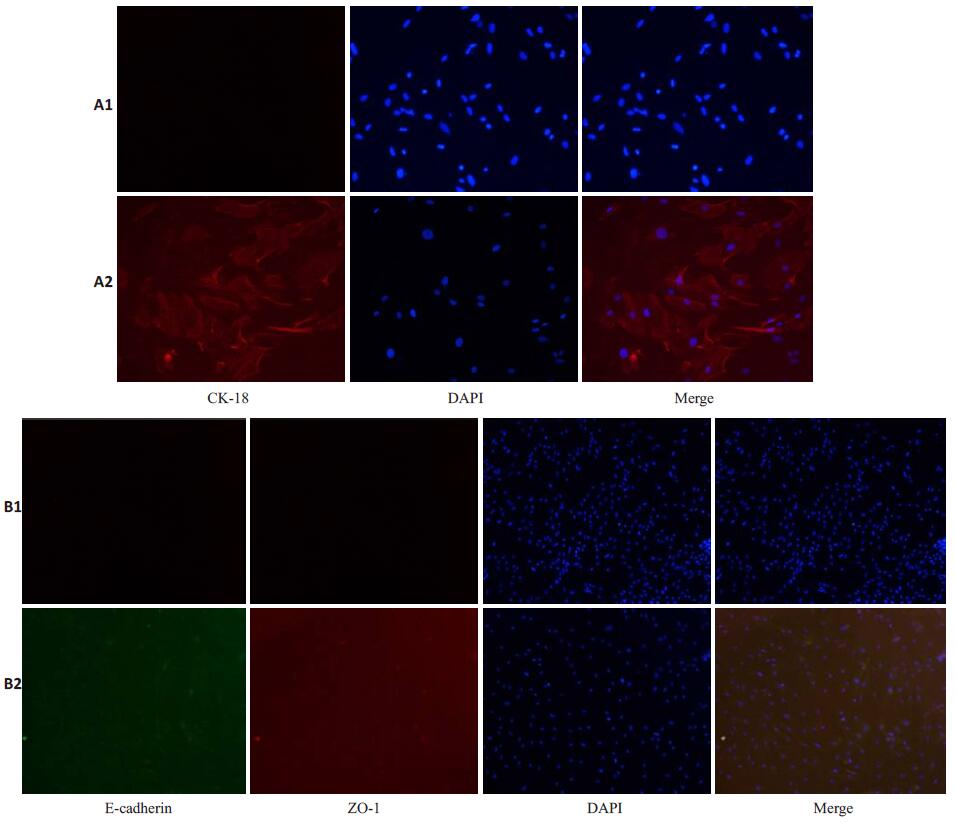
对照组KSC成熟上皮细胞标记物CK-18、Ecadherin、ZO-1表达阴性, 而经共培养体系诱导培养后, 成熟上皮细胞标记CK-18、E-cadherin、ZO-1部分阳性表达(图 4)。
|
图 4 免疫荧光检测成熟上皮细胞表面标记物 Figure 4 Immunofluorescence detection of the mature epithelial cell markers in the two groups. A1, B1:Control group; A2, B2:Induced group (Original magnification:A1, A2:original magnification:×200; B1, B2:original magnification:×100). |
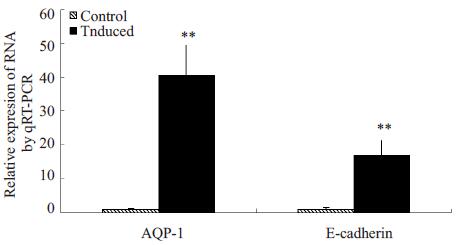
通过qRT-PCR检测成熟上皮标记E-Cadherin、AQP-1基因表达水平, 结果显示, 与对照组相比, 诱导组E-Cadherin、AQP-1基因表达水平均显著升高(P < 0.01, 图 5)。
|
图 5 qRT-PCR检测成熟上皮细胞标记物 Figure 5 Detection of the mature epithelial cell markers in the two groups using qRT-PCR (**P < 0.01). |
干细胞对损伤组织的修复主要是通过两方面作用实现的, 一是旁分泌作用, 二是直接迁移到损伤部位并分化为受损伤细胞[9], 在我们之前的研究中已经观察到了KSC的旁分泌作用可以对缺氧损伤的肾小管上皮细胞具有一定的修复作用, 并可以减少缺氧损伤肾小管的氧化应激水平[7-8], 那么KSC是否可以直接分化为肾小管上皮细胞?在本研究得到了进一步的验证。
关于肾乳头处KSC的迁移与分化能力, 已经得到了一些相关研究的证实。如Ward等研究发现将肾乳头处分离的CD133/1+干细胞与皮质肾小管上皮细胞(RTEC)共培养, CD133/1+干细胞可以掺入到RTEC细胞中, 并形成中空的球状骨针形状, β-catenin呈蜂巢状染色阳性; 将CD133/1+干细胞注射到小鼠胚胎肾脏中, 结果发现该细胞参与了肾小管的形成[10]。Oliver等[5]观察到BrdU标记的KSC在急性肾损伤时移出了肾乳头, 并参与了损伤的肾小管的修复, 并且具有这种具有修复作用的KSC主要存在于肾乳头靠近肾髓质的部位[6], KSC是通过哪些途径移动到损伤部位的, 还有待于进一步研究。为了更直观的评估KSC是否具有分化为RTEC的能力, 我们通过体外培养的方式, 对KSC向肾小管上皮细胞进行诱导, 结果显示经诱导培养后, 成熟上皮细胞标记物CK-18阳性表达比例可达到40%以上, 并且免疫荧光提示E-cad、CK-18、ZO-1阳性表达, 提示KSC具有分化为RTEC的能力。在本研究中我们的诱导体系为诱导培养基和REGM培养基的交替作用, 其中诱导培养基的主要成分包括BMP-7、Activin A和维甲酸, 3种均是向上皮细胞转分化的关键因子, 这主要是借鉴了骨髓间充质干细胞和胚胎干细胞的诱导方案[11-13], 而REGM培养基有利于上皮细胞表型的维持, 在培养过程中一些非上皮细胞会发生凋亡, 从而起到进一步纯化细胞的作用。与此同时, 我们的诱导体系还结合了缺氧损伤的肾小管上皮细胞, 有助于提高诱导效率, 这也与相关文献报道相符, 如Singaravelu等[14]直接应用受损的肾小管上皮细胞与MSC共培养7 d后MSC可表达上皮细胞表型Ksp-cadherin和AQP1, 考虑与细胞损伤过程中会释放一些诱导因子有关, 这也能更好的模拟体内急性肾损伤的微环境。
综上所述, 在细胞因子结合缺氧损伤的RTEC共培养的诱导体系下, KSC可以在体外分化为RTEC, 从而间接证实了KSC可能是具有修复肾小管损伤作用的干细胞来源之一。
| [1] | Mccampbell KK, Wingert RA. Renal stem cells:fact or science fiction[J]. Biochem J,2012, 444 : 153-68. DOI: 10.1042/BJ20120176. |
| [2] | Gupta S, Verfaillie C, Chmielewski D, et al. Isolation and characterization of kidney-derived stem cells[J]. J Am Soc Nephrol,2006, 17 (11) : 3028-40. DOI: 10.1681/ASN.2006030275. |
| [3] | Burst VR, Gillis M, Pütsch F, et al. Poor cell survival limits the beneficial impact of mesenchymal stem cell transplantation on acute kidney injury[J]. Nephron Exp Nephrol,2010, 114 (3) . |
| [4] | Kristen KM, Rebecca AW. Renal stem cells:fact or science fiction[J]. Biochem J,2012, 444 : 153-68. DOI: 10.1042/BJ20120176. |
| [5] | Oliver JA, Maarouf O, Cheema FH, et al. The renal papilla is a niche for adult kidney stem cells[J]. J Clin Invest,2004, 114 (6) : 795-804. DOI: 10.1172/JCI20921. |
| [6] | Oliver JA, Klinakis A, Cheema FH, et al. Proliferation and migration of Label-Retaining cells of the kidney papilla[J]. J Am Soc Nephrol,2009, 20 (11) : 2315-27. DOI: 10.1681/ASN.2008111203. |
| [7] | 温静, 程庆砾, 马强, 等. 肾组织干细胞对人肾小管上皮细胞损伤修复的作用[J]. 北京大学学报:医学版,2013, 45 (4) : 619-24. |
| [8] | 温静, 程庆砾, 马强, 等. 大鼠肾乳头组织干细胞的分离与鉴定[J]. 中国组织工程研究,2012, 16 (19) : 3502-6. |
| [9] | Morigi M, Benigni A. Mesenchymal stem cells and kidney repair[J]. Nephrol Dial Transplant,2013, 28 (4) : 788-93. DOI: 10.1093/ndt/gfs556. |
| [10] | Ward HH, Romero E, Welford A, et al. Adult human CD 133/1+ kidney cells isolated from papilla integrate into developing kidney tubules[J]. Biochim Biophys Acta,2011, 1812 : 1344-57. DOI: 10.1016/j.bbadis.2011.01.010. |
| [11] | Kang M, Han YM. Differentiation of human pluripotent stem cells into nephron progenitor cells in a serum and feeder free system[J]. PLoS One,2014, 9 (4) . |
| [12] | 田寿福, 郭烨, 牛鑫, 等. 细胞生长因子联合诱导ES细胞向肾脏前体细胞分化的实验研究[J]. 中国中西医结合肾病杂志,2012, 13 (12) : 1058-61. |
| [13] | Kang M, Han YM. Differentiation of human pluripotent stem cells into nephron progenitor cells in a serum and feeder free system[J]. PLoS One,2014, 9 (4) . |
| [14] | Singaravelu K, Padanilam BJ. In vitro differentiation of MSC into cells with a renal tubular epithelial-like phenotype[J]. Ren Fail,2009, 31 (6) : 492-502. DOI: 10.1080/08860220902928981. |
 2015, Vol. 35
2015, Vol. 35
