宫颈癌是全球女性最常见的恶性肿瘤之一,发病率仅次于乳腺癌[1]。顺铂(cisplatin, DDP)广泛应用于恶性肿瘤的化学治疗,宫颈癌新辅助化疗方案多以顺铂为基础,疗效肯定。但顺铂的毒性反应突出,主要为肾功能损害、耳毒性、血液毒性、胃肠道反应等,寻找一类安全可靠的可增强肿瘤化疗敏感性的基因靶点药物以降低DDP用量、减轻毒副作用,具有重要的应用价值。
信号转导和转录激活子-1(signal transducers and activators of transcription1, Stat1)被认为是一种抑癌因子,可通过直接调控多种靶基因的转录如c-Myc,CDKs等调控肿瘤细胞的生长与凋亡[2-3]。癌基因c-Myc与肿瘤的发生、发展和演变转归有重要关系,宫颈癌等多种肿瘤中都有c-Myc基因的扩增或过度表达[4]。T细胞淋巴瘤和卵巢癌的研究发现Stat1可以改善肿瘤细胞对化疗药物耐药性[5-6]。而Stat1及c-Myc在宫颈癌化疗敏感性中的研究,尚未见文献报道。
本研究通过研究顺铂、Stat1-siRNA处理宫颈癌Hela细胞后Stat1、c-Myc表达及细胞生长、增殖能力的差异,探讨Stat1蛋白对于Hela细胞生长与增殖的影响以及Stat1、c-Myc在宫颈癌顺铂化疗敏感性中的作用及机制,为开发协同顺铂化疗的基因靶点药物提供实验依据。
1 材料与方法 1.1 材料人宫颈癌细胞株Hela由中国科学院细胞库提供,注射用DDP购自江苏豪森药业股份有限公司,3(-4,5-二甲基噻唑-2)-2、5-二苯基四氮唑溴盐(商品名:噻唑蓝,MTT)购自美国Sigma公司,BrdU试剂盒购自南京凯基生物科技发展有限公司,兔抗Stat1抗体、β-actin抗体、兔抗c-Myc抗体均购自美国Abcam公司,应用于RNA干扰实验的对照小RNA片段Con-siRNA和Stat1干扰片段Stat1-siRNA均购自上海纽恩生物技术有限公司,细胞转染试剂lipo-2000购自美国Life Technology公司。
1.2 方法 1.2.1 细胞培养人宫颈癌细胞Hela在含10%胎牛血清、100 U/ml青霉素、100 mg/L链霉素的1640高糖培养基中,置于37 ℃、5% CO2、饱和湿度培养箱内常规传代培养。实验用细胞均为对数生长期细胞。
1.2.2 细胞转染在6孔细胞培养板中种入状态良好的Hela细胞1×105/ml,8 h后,依据lipo-2000转染试剂说明书加入适量lipo-2000转染试剂和50 ng/ml的Stat1-siRNA及其对照siRNA,24 h后取细胞裂解提蛋白。
1.2.3 Western blot检测蛋白表达提取各组全细胞蛋白质,Bradford法测定蛋白质含量。按每孔10 μg上样,常规SDS-PAGE电泳。电泳完成后以半干式电泳转移法将蛋白条带转移到PVDF膜上。电转完成后取出PVDF膜,3% BSA 4℃封闭过夜。倾去BSA,在其上加入相关蛋白的一抗,β-actin作为内参与PVDF膜在室温共孵育2 h。PBS漂洗后再分别用结合辣根过氧化物酶的二抗孵育。ECL化学发光法进行显色,X光胶片上曝光,随后显影、定影,用图像分析系统测定蛋白条带的光密度,进行定量分析。
1.2.4 MTT检测细胞生长曲线收集各组处于对数生长期的Hela细胞,把细胞悬液浓度调节为1×105/ml。将100 μl(含1×104 cell)的细胞悬液种入每孔中,每组设5个复孔,种5块96孔板。置于37 ℃,5% CO2培养箱孵育,把种板时间作为起始时间点0 h,在0 h取出一块96孔细胞培养板,每孔加入10 μl 0.5% MTT溶液,继续培养4 h。离心(1000 r/min×10 min),小心吸掉孔内上清液,每孔均加入100 μl二甲基亚砜,将96孔板置摇床上,低速振荡10 min,充分溶解结晶物。在酶联免疫检测仪OD490 nm,分别测量各孔的吸光值。同时设置调零孔(MTT、培养基、二甲基亚砜)。此后每隔1 d取1块培养板检测490 nm的D值,一共检测5 d。
1.2.5 BrdU检测细胞增殖能力细胞以1.5×105/ml细胞数接种于直径35 mm培养皿中(内放置一盖玻片),培养1 d,用含0.4% FCS培养液同步化3 d,使绝大多数细胞处于G0期。终止细胞培养前,加入BrdU(终浓度为30 μg/L),37 ℃,孵育40 min。弃培养液,玻片用PBS洗涤3次。甲醇/醋酸固定10 min。经固定的玻片空气干燥,0.3% H2O2甲醇30 min灭活内源性氧化酶。5%正常兔血清封闭。甲酰胺100 ℃,5 min变性核酸。冰浴冷却后PBS洗涤,加1抗即抗兔抗BrdU单抗(工作浓度1: 50),阴性对照加PBS或血清。按ABC法进行检测,苏木素或伊红衬染,在显微镜下随机计数10个高倍视野中细胞总数及BrdU阳性细胞数,计算标记指数。
1.2.6 统计学分析采用SPSS 17.0统计软件储存和分析数据,计量资料以均数±标准差表示,两个独立样本均数比较呈正态分布的采用t检验,P < 0.05为差异有统计学意义。
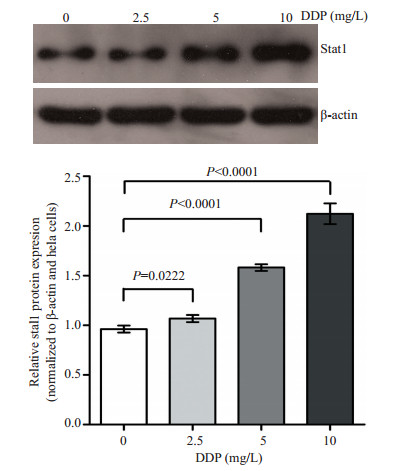
2 结果 2.1 DDP对Stat1蛋白表达的影响为了在Hela细胞中验证DDP对Stat1表达的影响,分别用0,2.5,5,10 mg/L浓度的DDP处理Hela细胞48 h,收集细胞进行蛋白提取,经过电泳、转膜和抗体杂交得到Western blot结果(图 1)。结果显示:DDP刺激Hela细胞48 h后,随着DDP浓度的升高,Stat1表达逐步增加,在5 mg/L时与对照组比较有显著差异(P < 0.001);至10 mg/L时更明显,上调蛋白表达量超过2倍,说明DDP可上调Stat1的表达,Stat1的上调程度与DDP处理浓度成正相关。
|
图 1 不同浓度DDP处理Hela细胞后Stat1蛋白的表达 Figure 1 Expression of Stat1 protein in Hela cells exposed to different concentrations of DDP. |
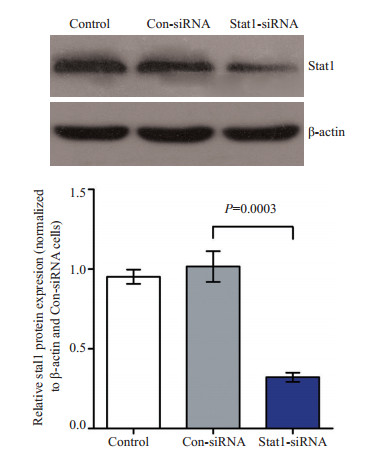
用化学合成的Con-siRNA和Stat1-siRNA分别用脂质体转染Hela细胞48 h,收集细胞,进行处理后,进行western blot检测(图 2)。结果显示:Stat1-siRNA转染的Hela细胞中Stat1蛋白的表达量较阴性对照Con-siRNA转染组显著下调,通过灰度分析得出可下调70%左右,说明Stat1-siRNA转染Hela细胞后可有效下调Stat1蛋白的表达。
|
图 2 Stat1沉默后蛋白的表达 Figure 2 Expression of Stat1 protein in Hela cells after Stat1 gene silencing. |
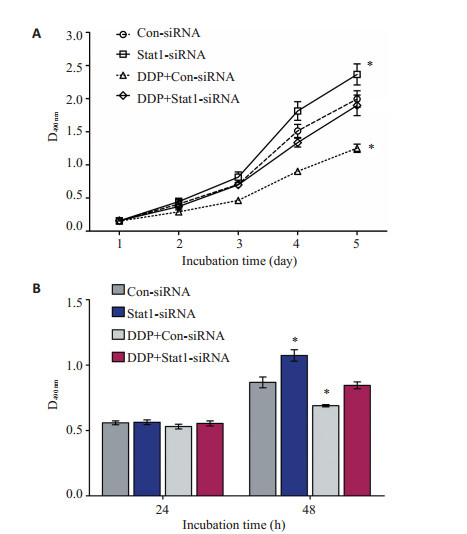
为验证DDP是否可以通过上调Stat1来达到抑制Hela细胞生长增殖的作用,用DDP(10 mg/L)联合Stat1-siRNA处理Hela细胞,得到四个实验组,Con-siRNA,Stat1-siRNA,DDP + Con-siRNA以及DDP + Stat1-siRNA,采用MTT及Brdu实验检测各组细胞生长与增殖情况。在细胞培养期间,每24 h取细胞转移到96孔板,加MTT,490 nm检测吸光值,一共测5个时间点,每个检测点3个平行,取每个检测点的平均值做折线图,得到MTT结果(图 3A)。同样的分组,BrdU 24 h四组增殖能力无明显变化(图 3B),但在48 h时,亦得到MTT相同的结果。结果显示:Stat1-siRNA组Stat1下调,Hela细胞的生长增殖状态最佳,DDP组Hela细胞生长增殖抑制最明显;DDP+Stat1沉默组Hela细胞的生长增殖介于DDP组及Stat1-siRNA组之间,说明Stat1抑制Hela细胞生长增殖;DDP通过上调Stat1抑制细胞生长增殖;下调Stat1后,DDP对Hela细胞生长增殖的抑制作用被削弱。
|
图 3 Hela细胞生长(A)和增值能力(B)的变化 Figure 3 Cisplatin inhibits the proliferation of Hela cells by up-regulating Stat1 expression. |
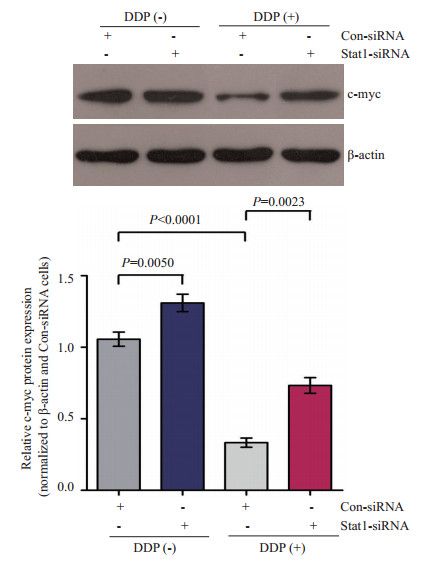
Western blot实验验证DDP是否可以通过上调Stat1来抑制其下游因子c-Myc蛋白的表达,采用检测前述各组细胞,得到。结图 4果表明:未经DDP处理的两组,c-Myc蛋白表达高于DDP处理的两组;DDP未处理组中,Stat1沉默组c-Myc蛋白的表达高于空白对照组;经DDP处理的两组中,DDP+Stat1沉默组c-Myc蛋白表达高于DDP组;同时可以看出,DDP+Stat1沉默组c-Myc蛋白的表达,介于DDP组及Stat1沉默组之间,说明:Stat1可介导DDP对c-Myc抑制作用;DDP通过上调Stat1抑制c-Myc的表达,下调Stat1后,DDP对c-Myc蛋白表达的抑制被削弱。
|
图 4 四组Hela细胞c-Myc蛋白的表达 Figure 4 Expression of c-Myc protein in Hela cells after Stat1 gene silencing. |
酪氨酸蛋白激酶-信号传导和转录激活因子(janus kinase-signal transducers and activators of transcription, JAK-Stats)途径是一条极为快速的信号通路, 激活后,可以将细胞外信号传递到细胞核[7]。在人类多种实体肿瘤(如乳腺癌、结肠癌、前列腺癌等[8-10])和血液病[11-12](如淋巴瘤)的研究中发现,其参与了肿瘤发生、发展、浸润和转移。Stat1是其中重要成员之一,参与细胞生长调节、抗病毒和免疫防御[13],主要可触发抗增殖和促凋亡反应,在肿瘤细胞和免疫系统中被认为是一种肿瘤抑制因子[3]。Stat1主要是直接通过对多种靶基因的转录调控如c-Myc, CDKs等[2-3],或间接地通过调节肿瘤血管生成、组织浸润或抗肿瘤免疫反应对肿瘤细胞生长和凋亡进行调控。而宫颈癌细胞中Stat1及c-Myc的相关研究较少。
Beppuetal研究发现,IFN-γ可同时促进宫颈癌细胞系Caski中Stat1(促凋亡)和NF-κB(抑凋亡)表达上调,当IFN-γ和环孢菌素A(抑制NF-κB活性)同时使用时,生长停滞明显增加[14]。本研究通过用靶向Stat1干扰RNA对Hela细胞进行转染,有效沉默Stat1的表达后发现Stat1对Hela细胞的生长与增殖有抑制作用,同时发现在宫颈癌Hela细胞中c-Myc受到Stat1的调控,c-Myc的表达量与细胞的生长增殖状态呈正相关。c-Myc基因是最早于禽类骨髓瘤病毒中发现的一种癌基因,其表达水平与细胞的增殖及分化状态有关,其表达产物在调节细胞生长、分化或恶性转化中发挥作用[4]。结合文献得出,在宫颈癌Hela细胞中,癌基因c-Myc具有促进其生长增殖的作用,c-Myc是Stat1发挥抑癌作用的靶点基因。
3.2 DDP对Hela细胞Stat1表达的影响DDP是广谱抗癌药,属细胞周期非特异性药物,主要作用靶点为DNA,属细胞周期非特异性药物,在宫颈癌的化疗中占有重要地位,其具体作用机制仍未完全探明。有文献报道DDP可通过ERK途径下调Stat3抑制肿瘤细胞的生长与增殖[3, 18],另有文献显示DDP可通过抑制c-Myc的表达而抑制肿瘤细胞的生长与增殖[19-20],而宫颈癌中DDP与Stat1的关系并无相关研究。
本研究通过DDP对Hela细胞的梯度浓度处理,发现DDP抑制Hela细胞生长与增殖的过程中显著上调了Stat1的表达,且其上调程度与DDP的处理浓度呈正相关。
3.3 Stat1在顺铂抑制Hela细胞过程中的作用本研究进一步使用靶向Stat1干扰RNA与DDP联合处理细胞,发现Stat1-siRNA可以削弱DDP对Hela细胞生长和增殖的抑制效应;另一方面,DDP可以抑制Stat1下游因子c-Myc的表达,Stat1-siRNA可削弱DDP对c-Myc的抑制作用。证明随着Stat1的下调,Hela细胞对DDP的敏感性被削弱,Stat1可增强Hela细胞对顺铂的敏感性;Stat1介导了DDP对Hela细胞的抑制效应,Stat1是宫颈癌顺铂化疗的作用新靶点。另外证明文献中报道DDP对c-Myc的抑制作用,是通过Stat1介导的。
3.4 靶向Stat1的化疗增敏研究的意义在接受单次单药的顺铂化疗(50 mg/m2)患者中,约28~36%出现肾毒性,约31%出现耳毒性,约1/3出现血液学毒性,大部分患者胃肠道反应重[17]。随着分子靶向药物问世,多种靶向药物已在临床上和铂类抗癌药物联合应用,并取得了不错的疗效。如盐酸厄洛替尼片(tarceva)[21]、吉非替尼(gefitinib)[22]与顺铂联用都可有效治疗中晚期肺癌患者,此外,还有多靶点药物索拉菲(sorafenib)等与铂类联合治疗肝癌患者[23],在改善化疗耐药性、提高化疗敏感性、减轻化疗副作用方面有可喜的效果。最近在T细胞淋巴瘤和卵巢癌的研究中发现Stat1可以改善肿瘤细胞对化疗药物耐药性[5-6],而本研究在宫颈癌Hela细胞中证明了Stat1也具有同样的作用,提示开发以Stat1为靶点的化疗协同药物有诱人的前景。
综上所述,Stat1、c-Myc介导了DDP抑制Hela细胞生长、增殖的作用;Stat1可增强Hela细胞对顺铂的敏感性。本研究补充了DDP对宫颈癌的作用靶点,揭示了宫颈癌细胞中可能存在STAT1/c-Myc通路,初步探讨了其在DDP化疗中可能的机制及作用。在宫颈癌及其他细胞株或者宫颈癌在体实验中的进一步研究,以及DDP能激活Stat1/c-Myc通路是靶向调控哪个蛋白等等,都将在本课题组后期的研究中进行进一步探讨。
| [1] | 魏丽惠. 子宫颈癌防治任重道远[J]. 中华妇产科杂志,2013, 48 (4) : 304-6. |
| [2] | Ramana CV, Grammatikakis N, Chernov M, et al. Regulation of c-myc expression by IFN-gamma through Stat1-dependent andindependent pathways[J]. EMBO J,2000, 19 (2) : 263-72. DOI: 10.1093/emboj/19.2.263. |
| [3] | Avalle L, Pensa S, Regis G, et al. STAT1and STAT3in tumorigenesis:A matter of balance[J]. JAKSTAT,2012, 1 (2) : 65-72. |
| [4] | Matsushita K, Shimada H, Ueda Y, et al. Non-transmissible Sendai virus vector encoding c-myc suppressor FBP-interacting repressor for cancer therapy[J]. World J Gastroenterol,2014, 20 (15) : 4316-28. DOI: 10.3748/wjg.v20.i15.4316. |
| [5] | Fantin VR, Loboda A, Paweletz CP, et al. Constitutive activation of signal transducers and activators of transcription predicts vorinostat resistance in cutaneous T-cell lymphoma[J]. Cancer Res,2008, 68 (10) : 3785-94. DOI: 10.1158/0008-5472.CAN-07-6091. |
| [6] | Stronach EA, Alfraidi A, Rama N, et al. HDAC4-regulated STAT1activation mediates Platinum resistance in ovarian cancer[J]. Cancer Res,2011, 71 (13) : 4412-22. DOI: 10.1158/0008-5472.CAN-10-4111. |
| [7] | Darnell JE, Kerr IM, Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins[J]. Science,1994, 264 (5164) : 1415-21. DOI: 10.1126/science.8197455. |
| [8] | Proietti C, Salatino M, Rosemblit C, et al. Progestins induce transcriptional activation of signal transducer and activator of transcription3(Stat3) via a Jak-and Src-dependent mechanism in breast cancer cells[J]. Mol Cell Biol,2005, 25 (12) : 4826-40. DOI: 10.1128/MCB.25.12.4826-4840.2005. |
| [9] | Lin Q, Lai R, Chirieac LR, et al. Constitutive activation of JAK3/STAT3in colon carcinoma tumors and cell lines:inhibition of JAK3/STAT3signaling induces apoptosis and cell cycle arrest of colon carcinoma cells[J]. Am J Pathol,2005, 167 (4) : 969-80. DOI: 10.1016/S0002-9440(10)61187-X. |
| [10] | Abdulghani J, Gu L, Dagvadorj A, et al. Stat3promotes metastatic progression of prostate cancer[J]. Am J Pathol,2008, 172 (6) : 1717-28. DOI: 10.2353/ajpath.2008.071054. |
| [11] | Derenzini E, Younes A. Targeting the JAK-STAT pathway in lymphoma:a focus on pacritinib[J]. Expert Opin Investig Drugs,2013, 22 (6) : 775-85. DOI: 10.1517/13543784.2013.775244. |
| [12] | Mitchell TJ, John S. Signal transducer and activator of transcription (STAT) signalling and T-cell lymphomas[J]. Immunology,2005, 114 (3) : 301-12. DOI: 10.1111/imm.2005.114.issue-3. |
| [13] | Schindler C, Brutsaert S. Interferons as a paradigm for cytokine signal transduction[J]. Cell Mol Life Sci,1999, 55 (12) : 1509-22. DOI: 10.1007/s000180050391. |
| [14] | Reed JC, Bischoff JR. BIRinging chromosomes through cell division--and survivin'the experience[J]. Cell,2000, 102 (5) : 545-8. DOI: 10.1016/S0092-8674(00)00076-3. |
| [15] | Leppert U, Henke W, Huang X, et al. Post-transcriptional finetuning of COP9signalosome subunit biosynthesis is regulated by the c-Myc/Lin28B/let-7pathway[J]. J Mol Biol,2011, 409 (5) : 710-21. DOI: 10.1016/j.jmb.2011.04.041. |
| [16] | Gerbitz A, Sukumar M, Helm F, et al. Stromal interferon-γ signaling and cross-presentation are required to eliminate antigen-loss variants of B cell lymphomas in mice[J]. PLoS One,2012, 7 (3) : e34552. DOI: 10.1371/journal.pone.0034552. |
| [17] | Long HJ. Management of metastatic cervical cancer:review of the literature[J]. J Clin Oncol,2007, 25 (20) : 2966-74. DOI: 10.1200/JCO.2006.09.3781. |
| [18] | 李银燕, 王秀君. 铂类抗癌药物作用靶点及耐药机制的研究进展[J]. 中国细胞生物学学报,2013 (7) : 1008-17. |
| [19] | Phesse TJ, Myant KB, Cole AM, et al. Endogenous c-Myc is essential for p53-induced apoptosis in response to DNA damage in vivo[J]. Cell Death Differ,2014, 21 (6) : 956-66. DOI: 10.1038/cdd.2014.15. |
| [20] | Xie X, Ye Z, Yang D, et al. Effects of combined c-myc and Bmi-1siRNAs on the growth and chemosensitivity of MG-63osteosarcoma cells[J]. Mol Med Rep,2013, 8 (1) : 168-72. |
| [21] | Di Maio M, Leighl NB, Gallo C, et al. Quality of Life analysis of TORCH, a randomized trial testing first-line erlotinib followed by second-line cisplatin/gemcitabine chemotherapy in advanced nonsmall-cell lung cancer[J]. J Thorac Oncol,2012, 7 (12) : 1830-44. DOI: 10.1097/JTO.0b013e318275b327. |
| [22] | Yu H, Zhang J, Wu X, et al.A phase Ⅱ randomized trial evaluating gefitinib intercalated with pemetrexed/Platinum chemotherapy or pemetrexed/Platinum chemotherapy alone in unselected patients with advanced non-squamous non-small cell lung cancer[J].Cancer Biol Ther, 2014, 15(7):[Epub ahead of print]. |
| [23] | Wei Y, Shen N, Wang Z, et al. Sorafenib sensitizes hepatocellular carcinoma cell to cisplatin via suppression of Wnt/β-catenin signaling[J]. Mol Cell Biochem,2013, 381 (1/2) : 139-44. |
 2015, Vol. 35
2015, Vol. 35
