2. 广州医科大学附属第二医院,广东 广州 510260
2. Department of Cardiology, Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260, China
子痫前期是妊娠晚期所特有的多因素、多系统疾病,发病率为7%~10%,是导致孕产妇及围生儿死亡的主要原因之一。研究证实,母胎免疫耐受的形成对正常妊娠的维持起重要作用,一旦免疫耐受机制失衡,将导致病理性妊娠如流产、子痫前期等发生,其中CD4+ CD25+Foxp3+调节性T细胞在母体对胎儿的耐受方面起着重要作用[1]。有研究[1]发现子痫前期患者外周血CD4+CD25+Foxp3+T细胞所占比例与正常妊娠妇女相比显著减少,提示Foxp3参与子痫前期的发病。已有研究发现在人类Foxp3基因有13个突变点与自身免疫病有关, 目前国内外对Foxp3基因-924(rs2232365)基因位点多态性与子痫前期发生关系研究较少,本研究拟通过免疫组化方法检测胎盘附着处蜕膜Foxp3的表达的水平,同时观察Foxp3-924基因位点多态性在子痫前期患者和正常妊娠妇女中的分布,从而探讨子痫前期发生的分子遗传学机制及遗传因素对子痫前期发生的影响。
1 材料与方法 1.1 研究对象选取2010年10月~2011年12月在广州医医科大学附属第三医院产科住院的子痫前期患者156例,诊断标准以《妇产科学》第7版为准;选取同期住院分娩的正常足月妊娠孕妇252例作为对照组;排除有内科合并症和产科并发症的病例。病例组及对照组临床资料(表 1),孕前均无高血压、心脏病、肾病、糖尿病、血小板减少等病史。全部研究对象取清晨空腹静脉血3 ml,置含乙二胺四乙酸(EDTA)抗凝剂的真空无菌管中混匀,离心分离血清,4 ℃保存备用,在上述对象中随机选择子痫前期患者68例,其中轻度痫前期患者33例,重度痫前期患者35例,正常晚期妊娠患者30例,分娩后留取胎盘标本。
| 表 1 子痫前期组与正常妊娠组基本临床资料比较 Table 1 Demographic and clinicopathological characteristics of the subjects (Mean±SD) |
Foxp3-924(rs2232365)基因位点PCR引物序列如下:上游引物P1 5'-CTGGCTCTCTCCCCAACTG A-3',P2 5'-CTGGCTCTCTCCCCAACTGC-3';下游引物R 5'-ACAGAGCCCATCATCAGACTCTCTA-3',引物由上海生工公司合成。Taq DNA聚合酶和dNTP由北京鼎国生物技术公司提供。Foxp3抗体购自BioLegend,SP免疫组化染色试剂盒购自福州迈新生物技术公司。
1.3 方法取胎盘母体面正中1 cm×1 cm×1 cm组织块,10%福尔马林液固定, 常规石蜡包埋,4 μm厚连续切片,除常规HE染色观察蜕膜形态外,组织切片均采用免疫组化SP法检测子痫前期和正常对照组蜕膜中Foxp3的表达情况,Foxp3抗体的工作浓度均为1:200,用乳腺癌石蜡切片作为Foxp3的阳性对照,以PBS代替一抗作为空白对照,每批实验均同时设立阳性和空白对照。结果判定:在不知任何背景资料的情形下,采用双盲法进行。显微镜下观察,按每张切片的阳性细胞比例及着色深浅计分,行半定量分析。阳性细胞着色判断(A): < 5%为0分,5%~25%为1分,26%~50%为2分, > 50%为3分。阳性强度(B):无着色或与背景均匀一致的淡黄色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。根据两项指标的积分数(积分=A×B)进行计分。积分0分为-,1~3分为+,4~6分为++,7~9分为+++。
1.4 制备标本基因组DNA采用苯酚-氯仿法抽提。
1.5 Foxp3-924基因位点多态性检测采用PCR-SSP(polymerase chain reaction with sequence-specific primers)法,在灭菌的0.5 ml离心管中,按下列顺序加样,建立30 μl的反应体系:模板DNA 3.0 μl,Primer 1 1.0 μl,Primer 2 1.0 μl,dNTP 3.0 μl,10 × PCR Buffer 3.0 μl,Taq DNA Polymerase 1.0 μl,加H2O至总体积30 μl。PCR条件:94 ℃预变性3 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,循环31次;72 ℃延伸5 min。PCR扩增后用1.5%琼脂糖凝胶电泳检测是否有特异性的扩增产物。
1.6 统计学分析用SPSS 11.5统计软件分析,计算基因的等位基因频率与基因型频率,分析基因多态性与疾病的相关性及相对危险度,组间比较用χ2检验,临床资料采用t检验;表达强度用等级资料秩和检验。
2 结果 2.1 子痫前期和正常妊娠组临床资料子痫前期组和正常妊娠组对照组的基本临床资料和临床病理特征见表 1。对照组和子痫前期组的平均年龄分别为30.5±4.5岁和28.3±3.9岁。与对照组相比较,子痫前期组胎儿出生体质量(1821.48 g vs. 3186.30 g,P < 0.01)、胎盘重量(645.4 g vs 723.3 g,P < 0.01)均更轻,分娩时的孕周显著缩短(33+3周 vs 38+6周,P < 0.05),蛋白尿(3.986 g vs 0.084 g,P < 0.05)、早产率(80.37% vs 6.90%,P < 0.05)及血压(164.89 mmHg vs 134.67 mmHg,P < 0.05)较对照组更高。
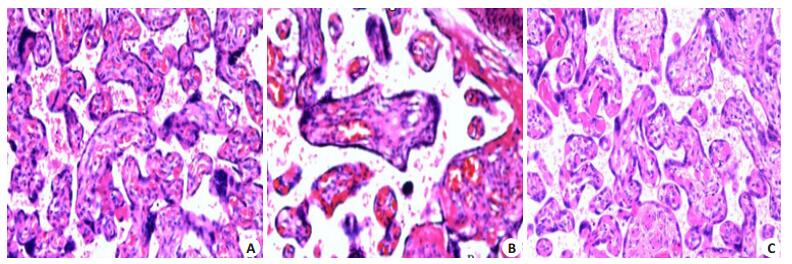
2.2 胎盘组织HE染色正常妊娠组:胎盘绒毛滋养细胞正常,间质组织结构完整、层次分明、无沉积物,血管清晰可见,其管腔大小正常、内膜完整光滑。子痫前期组:胎盘绒毛合体滋养细胞明显增生,合体细胞结节增多,绒毛间质纤维蛋白沉积,绒毛血管增多,血管管腔变小(图 1)。
|
图 1 胎盘组织HE染色 Figure 1 Placenta tissues of a normal pregnant women (A), a patient with mild preeclampsia (B) and one with severe preeclampsia (C) (HE staining, original magnification: ×20). |
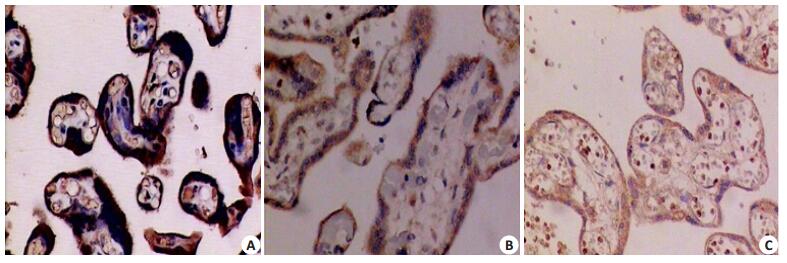
免疫组化法检测胎盘组织Foxp3表达水平,结果显示Foxp3主要表达于胎盘绒毛滋养细胞及蜕膜细胞,胎盘绒毛血管内皮细胞有少量表达。主要表达部位在细胞浆和细胞膜。Foxp3在正常妊娠组和子痫前期组中分布基本一致,子痫前期组与正常妊娠组比较,子痫前期组阳性反应着色强度明显减低,Foxp3表达显著减少,P < 0.05。Foxp3在轻度、重度子痫前期组及正常妊娠组蜕膜中的表达阳性率分别为:51.52%、28.57%和86.67%。轻度和重度子痫前期组Foxp3表达阳性率显著低于正常妊娠组,P < 0.05(图 2,表 2)。
|
图 2 免疫组化法检测Foxp3在胎盘组织中的表达 Figure 2 Foxp3 expression in placenta tissues detected using immunohistochcmistry in a normal pregnant women (A), a patient with mild preeclampsia (B) and one with severe preeclampsia (C) (Original magnification: ×20). |
| 表 2 子痫前期和正常妊娠组胎盘组织中Foxp3表达水平比较 Table 2 Foxp3 expression levels in the placenta tissues in preeclampsia patients and control subjects |
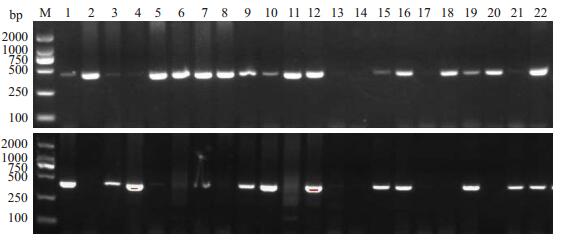
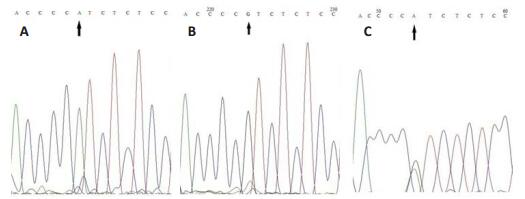
采用Foxp3-924位点G等位基因特异性引物进行PCR扩增,可见大小约442 bp片段,采用Foxp3-924位点A等位基因特异性引物进行PCR扩增,可见大小约427 bp片段,均与目的片段大小相符。G等位基因引物扩增GG基因型纯合子,A等位基因引物扩增AA基因型纯合子,A、G两对引物分别扩增时,可同时出现阳性条带的基因型为AG杂合子(图 3)。将各基因型进行序列测定,结果显示:GG、AA和AG三种基因型与PCR结果相符(图 4)。
|
图 3 Foxp3-924位点基因型PCR-ARMS分析电泳图 Figure 3 Typical band patterns of PCRARMS for Foxp3-924 genotyping. M: DNA marker; 1, 2, 4-12, 14-18, 22: C allele positive; 3, 13, 19-21, 23: C allele negative. B: M: DNA marker; 4, 7-8, 12-14, 16-18, 20-22: A allele positive; 1-3, 5, 6, 9-11, 15, 19, 23: A allele neg |
|
图 4 Foxp3-924位点各基因型测序图 Figure 4 DNA sequencing for Foxp3-924 genotypes. A: AA homozygote genotype sequence; B: GG homozygote genotype sequence; C: AG heterozygote genotype sequence. |
Foxp3-924位点各基因型在所研究对象群体中的分布经Hardy-Weinberg定律吻合度检测,Foxp3-924位点的∑χ2值为1.87,P > 0.05,说明研究群体基因遗传平衡。
对Foxp3-924位点的基因型及等位基因频率分析,结果显示:各基因型和等位基因在子痫前期组和正常妊娠组之间无显著性差异(表 3)。
| 表 3 子痫前期和正常妊娠组Foxp3-924位点基因型及等位基因频率 Table 3 Allele and genotypic frequencies of Foxp3-924 in preeclampsia patients and control subjects |
母胎界面是母体组织与胎儿成分直接接触的界面,亦是免疫应答最重要的部位,成功妊娠的维持表明母体处于免疫耐受状态。国内外研究均证实Foxp3在维持正常妊娠中起重要作用,可能在胚泡着床期及孕早期参与了对T细胞的调节,是调控母胎界面局部免疫耐受形成的重要因素。
CD4+CD25+Tre细胞的主要功能是参与免疫耐受与免疫排斥[2-5]。Foxp3是CD4+CD25+Treg细胞的核转录因子,也是Treg细胞分化发育和功能维持的一个重要调控基因。目前已证实Foxp3只特异性地表达于CD4+CD25+Treg细胞,当Foxp3的表达异常时会导致CD4+CD25+Treg细胞数量和功能下降。目前有研究表明有多种疾病的发生均与Foxp3的表达减少相关:诱导Foxp3的表达有利于预防和治疗1型糖尿病[6];重症肌无力患者Foxp3表达明显减少[7];多发性硬化症患者Foxp3信号传导和蛋白表达异常[8];系统性红斑狼疮(systemic lupus erythematosus, SLE)患者的外周血Foxp3水平显著低于正常对照组[9];Treg细胞数量减少和Foxp3表达降低所造成的细胞免疫抑制功能受损可能是白癜风发病的一个重要因素[10];Yang等[11]的研究证实妊娠的蜕膜组织中有Foxp3表达,原因不明的复发性流产(unexplained recurrent spontaneous abortion, URSA)患者Foxp3表达水平均显著低于正常妊娠者,证实了Foxp3可能参与了URSA的发生。
Foxp3是如何参与CD4+CD25+Treg细胞的功能调控和母胎免疫耐受,其确切机制尚不清楚。我们前期的工作发现子痫前期患者外周血检测发现CD4+CD25+ Treg比例明显低于正常妊娠者,提示CD4+CD25+Treg细胞减少可能参与了子痫前期的发生。而Foxp3是否影响和参与了母胎免疫耐受维持,值得我们深入研究。
本实验对68例子痫前期患者胎盘组织中Foxp3的表达进行了观察,结果显示Foxp3的表达阳性率显著低于正常妊娠对照组,这一结果与子痫前期患者外周血中CD4+CD25+ Treg细胞数量减少相一致,且Foxp3的表达水平随病情严重程度的增加而明显下降,说明Foxp3表达下降影响了CD4+CD25+ Treg细胞的数量与功能,该研究结果与Toldi G等人研究相符[12],提示Foxp3在蜕膜细胞及滋养细胞中的表达水平降低与子痫前期的发生相关。Foxp3作为CD4+CD25+ Treg细胞的功能性转录因子在机体免疫耐受及内环境稳定中发挥着作用,Foxp3表达异常与多种疾病的发生密切相关。Foxp3表达异常的原因及其在子痫前期发生中的作用目前尚不十分清楚,是否与基因突变及基因位点多态性相关?基因变异是否参与子痫前期的发生?值得深入研究。
人类Foxp3基因定位于染色体Xp11.23,含有11个外显子和10个内含子。人类Foxp3基因突变主要包括点突变、mRNA剪切缺失及亮氨酸拉链区改变。Fon-tenot等[13]发现Foxp3突变鼠和Foxp3缺失鼠体内CD4+CD25+ Treg细胞数目减少。Shen等[14]研究证实Foxp3基因多态性改变能够降低Foxp3基因的转录水平,从而降低Treg细胞数量和活性。研究[15]发现人类Foxp3基因中有13个突变点与自身免疫病相关,可导致1型糖尿病、SLE、类风湿性关节炎、Crohn's病及过敏性疾病等多种疾病[16-24]。其中研究较多的是-3279位点,Yang等[17]、Lin等[18]和Fodor等[20]发现Foxp3 -3279基因多态性位点分别与斑秃、系统性红斑狼疮和过敏性鼻炎发病相关。而Foxp3 -924基因多态性位点与疾病的相关性研究不多,Wu等[19]和André等[22]发现Foxp3-924基因多态性位点分别与习惯性流产和子宫内膜异位导致的不孕症发病相关。
为了进一步研究Foxp3基因变异与子痫前期发生的关系,探讨Foxp3多态性位点基因型和等位基因罹患子痫前期的易感性。本研究对156例子痫前期患者和252例同龄正常妊娠者进行了Foxp3 -924等3个位点的多态性检测和分析,Foxp3-924位点GG、GA、AA三种基因型频率在子痫前期患者中分别占13.46%、46.15%和40.38%,在正常对照组中分别占15.08%、40.87%、44.05%,各基因型频率在子痫前期患者与正常对照组间无显著差异。提示Foxp3-924位点可能不单独参与对子痫前期易感性的影响,与国外研究结果一致[12]。提示子痫前期可能与Foxp3-924位点基因多态性无关联,说明Foxp3-924基因多态性位点可能不是影响Foxp3表达的重要因素,这与Gao等[25]的研究结论相似。虽然本研究没有发现Foxp3-924位点单核苷酸多态性与子痫前期易感性有关,但-924位点多态性参与组成的Foxp3单倍体也可能与子痫前期易感性有关。Park等[16],André等[22]和Hassannia等[26]都发现Foxp3单倍体与有些疾病关联。这些发现提示我们在研究基因突变对疾病发病的影响时,不应局限于单基因的分析,还应重视说明Foxp3-924基因型与Foxp3其他位点的相互作用。本研究没有发现Foxp3-924单核苷酸多态性与子痫前期的相关性,可能与本研究的病例不够及未做其它位点的相关性研究有关。因此,不能完全排除该基因与子痫前期易感性无关,有必要进一步检测Foxp3其它突变位点与区域(如外显子和启动子区域等)的多态性研究。要进一步明确Foxp3与子痫前期的发生及发展的关系,还需采用大样本和单倍体研究,这将有助于阐明Foxp3基因多态性与子痫前期发生的关系。
| [1] | Szarka A, Rigó Jr J, Lázár L, et al. Circulating cytokines, chemokines and adhesion molecules in normal pregnancy and preeclampsia determined by multiplex suspension array[J]. BMC Immunol,2010, 11 : 59-66. DOI: 10.1186/1471-2172-11-59. |
| [2] | Graca L, Thompson S, Lin CY, et al. Both CD4(+) CD25(+) and CD4(+) CD25(-) regulatory cells mediate dominant transplantation tolerance[J]. J Immunol,2002, 168 (11) : 5558-65. DOI: 10.4049/jimmunol.168.11.5558. |
| [3] | Demirkiran A, Hendrikx TK, Baan CC, et al. Impact of immunosuppressive drugs on CD4+CD25+FOXP3+regulatory T cells:does in vitro evidence translate to the clinical setting?[J]. Transplantation,2008, 85 (6) : 783-9. DOI: 10.1097/TP.0b013e318166910b. |
| [4] | Jarvinen LZ, Blazar BR, Adeyi OA, et al. CD154 on the surface of CD4+CD25+regulatory T cells contributes to skin transplant tolerance[J]. Transplantation,2003, 76 (9) : 1375-9. DOI: 10.1097/01.TP.0000093462.16309.73. |
| [5] | Joffre O, Santolaria T, Calise D, et al. Prevention of acute and chronic allograft rejection with CD4+CD25+Foxp3+regulatory T lymphocytes[J]. Nat Med,2008, 14 (1) : 88-92. DOI: 10.1038/nm1688. |
| [6] | Cai B, Zhang J, Zhang M, et al. Micro-inflammation characterized by disturbed Treg/Teff balance with increasing sIL-2R in patients with type 2 diabetes[J]. Exp Clin Endocrinol Diabetes,2013, 121 (4) : 214-9. DOI: 10.1055/s-00000017. |
| [7] | Xu WH, Zhang AM, Ren MS, et al. Changes of Treg-associated molecules on CD4+CD25+Treg cells in myasthenia gravis and effects of immunosuppressants[J]. J Clin Immunol,2012, 32 (5) : 975-83. DOI: 10.1007/s10875-012-9685-0. |
| [8] | Emamgholipour S, Eshaghi SM, Hossein-Nezhad A, et al. Adipocytokine Profile, Cytokine Levels and Foxp3 Expression in multiple sclerosis:a possible link to susceptibility and clinical course of disease[J]. PLoS One,2013, 8 (10) : 1234-45. |
| [9] | Mengya Z, Hanyou M, Dong L, et al. Th17/Treg imbalance induced by increased incidence of atherosclerosis in patients with systemic lupus erythematosus (SLE)[J]. Clin Rheumatol,2013, 32 (7) : 1045-1052. DOI: 10.1007/s10067-013-2237-z. |
| [10] | Elela MA, Hegazy RA, Fawzy MM. Interleukin 17, Interleukin 22 and FoxP3 expression in tissue and serum of non-segmental vitiligo:A case-controlled study on eighty-four patients[J]. Eur J Dermatol,2013, 89 (6) : 1023-132. |
| [11] | Yang H, Qiu L, Chen G, et al. Proportional change of CD4+CD25+ regulatory T cells in decidua and peripheral blood in unexplained recurrent spontaneous abortion patients[J]. Fertil Steril,2008, 89 (3) : 656-61. DOI: 10.1016/j.fertnstert.2007.03.037. |
| [12] | Torri D, Me tz, Lesa M, et al. FOXP3 gene polymorphisms in preeclampsia[J]. Am J Obstet Gynecol,2012, 206 (2) : 165-72. |
| [13] | Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J]. Nat Immunol,2003, 4 : 330-6. DOI: 10.1038/ni904. |
| [14] | Shen Z, Chen L, Hao F, et al. Intron-1 rs3761548 is related to the defective transcription of foxp3 in psoriasis through abrogating E47/ c-Myb binding[J]. J Cell Mol Med,2010, 14 (1-2) : 226-31. DOI: 10.1111/j.1582-4934.2008.00370.x. |
| [15] | ChatilaTA, Blaeser F, Ho N, et al. Jm2 encoding a fork head-related protein, is mutated in X-linked autoimmtmity-allergic disregulation syndrome[J]. J Clin Invest,2000, 106 (12) : 75-81. DOI: 10.1172/JCI11679. |
| [16] | Park O, Grishina I, Leung PS, et al. Analysis of the Foxp3/scurfin gene in Crohn's disease[J]. Ann NYAcad Sci,2005, 1051 : 218-28. DOI: 10.1196/annals.1361.125. |
| [17] | Yang SY, Guo X, Song ZQ, et al. FOXP3 gene polymorphism and alopecia areata association studies[J]. J of Immu,2010, 26 (4) : 320-24. |
| [18] | Lin YC, Lee JH, Wu AS, et al. Association of single-nucleotide polymorphisms in Foxp3 gene with systemic lupus erythematosus susceptibility:a case-control study[J]. Lupus,2011, 20 (2) : 137-43. DOI: 10.1177/0961203310382428. |
| [19] | Wu Z, You Z, Zhang C, et al. Association between functional polymorphisms of Foxp3 gene and the occurrence of unexplained recurrent spontaneous abortion in a Chinese Han population[J]. Clin Dev Immunol,2012, 2012 : 89-98. |
| [20] | Fodor E, Garaczi E, Polyánka H, et al. The rs3761548 polymorphism of Foxp3 is a protective genetic factor against allergic rhinitis in the Hungarian female population[J]. Hum Immunol,2011, 72 (10) : 926-9. DOI: 10.1016/j.humimm.2011.06.011. |
| [21] | Yang Q, Chen Y, Yong W. FOXP3 genetic variant and risk of acute coronary syndrome in Chinese Han population[J]. Cell Biochem Funct,2013, 31 (7) : 599-602. |
| [22] | André GM, Barbosa CP, Teles JS, et al. Analysis of FOXP3 polymorphisms in infertile women with and without endometriosis[J]. Fertil Steril,2011, 95 (7) : 2223-7. DOI: 10.1016/j.fertnstert.2011.03.033. |
| [23] | Metz TD, Nelson LM, Stoddard GJ, et al. FOXP3 gene polymorphisms in pre-eclampsia[J]. Am J Obstet Gynecol,2012, 206 (2) : 165-76. |
| [24] | Jahan P, Sreenivasagari R, Goudi D, et al. Role of Foxp3 Gene in Maternal Susceptibility to Pre-eclampsia-A Study From South India[J]. Scand J Immunol,2013, 77 (2) : 104-8. DOI: 10.1111/j.1365-3083.2012.02760.x. |
| [25] | Gao L, Li K, Li F, et al. Polymorphisms in the FOXP3 gene in Han Chinese psoriasis patients[J]. J Dermatol Sci,2010, 57 (1) : 51-6. DOI: 10.1016/j.jdermsci.2009.09.010. |
| [26] | Hassannia H, Abediankenari S, Ghaffari J, et al. FOXP3 and TGF-β Gene Polymorphisms in Allergic Rhinitis[J]. Iran J Immunol,2011, 8 (4) : 218-25. |
 2015, Vol. 35
2015, Vol. 35
