2. 武汉大学公共卫生学院营养与食品卫生学系,湖北 武汉 430071
2. Department of Nutrition and Food Health, School of Public Health, Wuhan University, Wuhan 430071, China
肥胖症是一种由多种因素引起的慢性代谢性疾病,主要表现为体内脂肪细胞的体积和细胞数增加。人群流行病学和动物实验研究均证实,肥胖增加高血压、心血管疾病、Ⅱ型糖尿病等多种其他慢性疾病的发病风险[1-2]。本实验室前期研究显示,CYP1B1基因敲除对小鼠营养性肥胖有抑制作用,并能改善肥胖相关的胰岛素抵抗[3]。推测抑制CYP1B1基因表达可能影响脂肪细胞的分化。本次研究使用的TMS(2, 3’, 4, 5’ -tetramethoxystilbene)是一种合成的黄酮类化合物,与白藜芦醇结构类似,是CYP1B1的特异性抑制剂。
C3H10T1/2细胞是鼠胚胎多潜能间充质干细胞,在不同的刺激因素作用下,具有向不同细胞系分化的能力,如骨细胞、肌腱细胞、脂肪细胞等[4-6]。脂肪细胞主要是机体内前脂肪细胞定向分化而来,而前脂肪细胞主要是由多潜能细胞选择性分化而来[5]。因此用该细胞作为脂肪分化的模型更贴近机体的真实情况,且该细胞增殖能力好,培养条件简单。本研究拟对激素刺激混合物(IDM)诱导分化的C3H10T1/2细胞施加不同浓度的TMS干预,通过观察各组细胞的分化程度,脂肪分化关键基因的表达等,研究TMS对于C3H10T1/2细胞脂肪分化的影响及可能机制。
1 材料与方法 1.1 材料本实验所用的C3H10T1/2多潜能干细胞系来自ATCC。细胞诱导分化试剂IDM(10 μg/ml胰岛素,2 μmol/L地塞米松和0.5 mmol/L 3-异丁基1-甲基黄磦呤)、SybrGreen MIX(美国ABI公司),cDNA第一链合成试剂盒(美国Invitrogen公司),核酸蛋白定量仪(美国Eppendorf公司),一抗(PPARγ兔抗鼠抗体:Sant Cruz),二抗(HRP-鼠抗兔来自CST),荧光定量PCR仪(美国BioRad公司)。
1.2 方法 1.2.1 细胞培养用10%小牛血清、l%青霉素/链霉素的DMEM高糖培养基,在37 ℃、5% CO2条件下培养,细胞密度达到70%~90%时,胰蛋白酶消化以1:2或l:3比例传代。
1.2.2 油红染色TMS抑制剂诱导分化第8天,PBS冲洗细胞2次,10%福尔马林固定30 min,去离子水冲洗2次,60%异丙醇作用5 min后弃去,加油红O工作液染色5 min,移去油红O,自来水冲洗3次,自来水洗3次,每次30 s,每孔加入2 ml水,倒置显微镜下观察拍照。
1.2.3 实时定量PCR以1 ml Trizol:100 mg组织提取总RNA,检测其浓度和纯度,取1.5 μg总RNA进行逆转录,所得的cDNA稀释5倍后取5 μl,反应体系10 μl。PCR程序:95 ℃预变性5 min;95 ℃变性15 s,58 ℃退火30 min,72 ℃延伸30 s,40个循环。PPARγ上游引物:5'-ACCCCCTGCTCCAGGAGAT-3';下游引物:5'-TG CAATCAATAGAAGGAACACGTT-3';β-actin上游引物:5'-CATCCTGCGTCTGGAACCTG-3';下游引物:5'-ATCTCCTTCTGCATCCTGTC-3';CD36上游引物:5'-TCCTCTGACATTTGCAGGTCTATC-3';下游引物:5'-AAAGGCATTGGCTGGAAGAA-3';FABP4上游引物:5'-AACATTAAATCAGAAAGCAC-3';下游引物:5'-ACAGCACATCCAACAGAA-3'。扩增效率用Sequence Detection软件分析,PCR产物特异性用溶解曲线和1.5%琼脂糖凝胶电泳进行检验。
1.2.4 蛋白印记RIPA缓冲液200 μl中加入50 mg所培养的细胞匀浆,低温离心除去碎片,取上清液进行蛋白定量、变性、电泳、转膜、ECL检测及条带的密度分析,观察PPARγ的表达。
1.2.5 免疫组化常规ABC法免疫组化,一抗PPARγ(Sant Cruz)浓度为1:200,4 ℃过夜,二抗(Cell Signaling)浓度1: 2000,室温1 h。
1.3 统计分析实验资料以均数±标准差表示,两组之间的比较用独立的t检验;多组间的比较用单因素方差分析(ANOVA),有统计学意义时,再用LSD进行组间两两比较。所有统计分析在SPSS 17.0软件进行,以P < 0.05为差异有统计学意义。
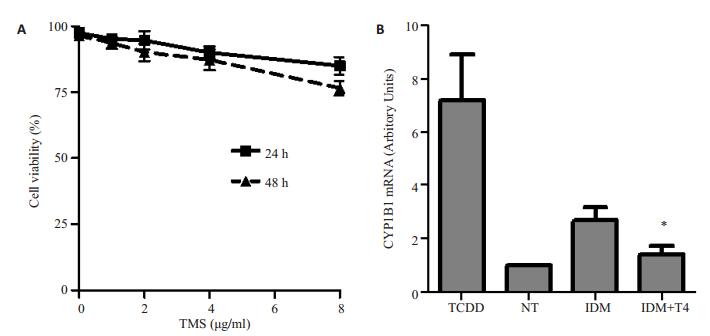
2 结果 2.1 TMS对C3H10T1/2细胞生存率的影响虽然随着TMS浓度增高,C3H10T1/2细胞的生存率逐渐下降,但是在TMS 8 μg/ml情况下48 h的存活率依然达到80%左右,而本实验最大剂量4 μg/ml,对细胞的生存没有明显影响(图 1A)。在mRNA水平,TMS抑制了CYP1B1的表达(图 1B)。TCDD作为CYP1B1的诱导剂设置为阳性对照。
|
图 1 不同浓度TMS对C3H10T1/2多潜能干细胞生存率和CYP1B1表达的影响 Figure 1 Effects of different concentrations of TMS on the viability (A) of C3H10T1/2 multi-potent mesenchymal cells and CYP1B1 mRNA expression (B). TCDD: Dioxin (positive control); T4: 4 μg/ml TMS; NT: No treatment. |
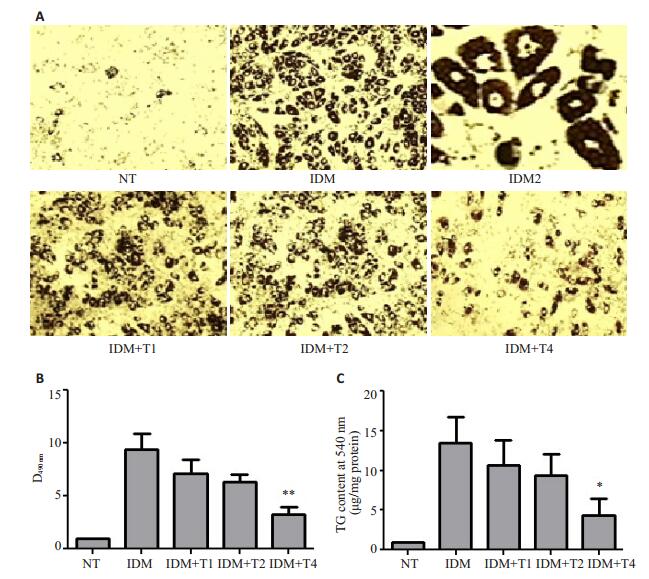
C3H10T1/2细胞经过8 d的诱导分化后,80%以上成为富含脂滴的脂肪细胞,而TMS的加入明显抑制了C3H10T1/2细胞向脂肪细胞分化,且抑制的程度与TMS的剂量相关,浓度越高,抑制作用越大(图 2A)。我们以异丙醇提取各组细胞中油红,并测定其490 nm吸光度,结果显示吸光度随着TMS剂量的增加而下降(图 2B)。其次,对不同组细胞中甘油三酯(TG)含量的检测,进一步证实TMS对C3H10T1/2细胞脂肪分化的抑制作用(图 2C)。
|
图 2 TMS抑制C3H10T1/2多潜能干细胞的脂肪分化 Figure 2 TMS suppresses induced adipogenic differentiation of C3H10T1/2 cells. A: Oil Red-O staining; B: Quantitative analysis of Oil Red-O staining results (absorbance at 490 nm); **P < 0.01 vs IDM group. C: TG contents. *P < 0.05 IDM group. NT: No Treatment; T1, T2, T4: 1, 2, 4 μg/ml TMS, respectively. IDM2 presents a magnified section of IDM. |
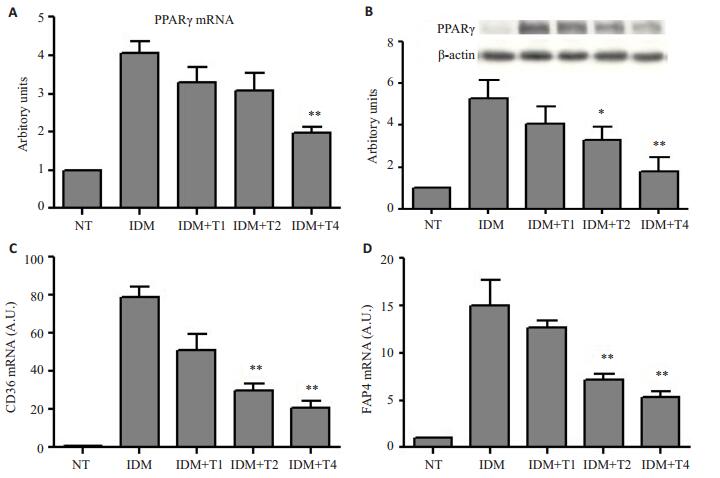
TMS明显抑制细胞中核转录因子PPARγ的mRNA和蛋白表达,且抑制的程度与TMS剂量相关,浓度越高,抑制作用越大(图 3A,B)。此外,TMS还抑制PPARγ下游靶基因CD36和FABP4的基因表达(图 3C,D)。两者均证实TMS显著抑制C3H10T1/2细胞脂肪分化过程中关键基因的表达。
|
图 3 TMS抑制IDM诱导的C3H10T1/2多潜能干细胞脂肪分化过程中PPARγ的表达 Figure 3 TMS inhibits PPARγ expression in C3H10T1/2 cells induced by IDM. A: Expression of PPARγ mRNA; B: Expression of PPARγ protein; C: Expression of CD36 mRNA; D: Expression of FABP4 mRNA. *P < 0.05, **P < 0.01 vs IDM group. |
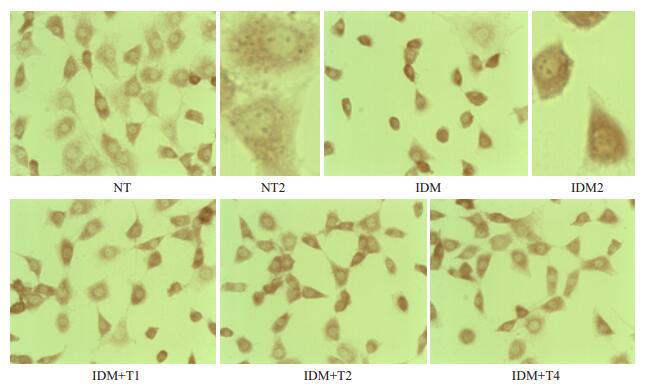
PPARγ主要表达于胞浆。与正常对照组相比,IDM组细胞胞浆深染,但随着TMS浓度的增加,细胞胞浆染色变浅,表明TMS对PPARγ蛋白的表达有抑制作用(图 4)。也可见C2H10T1/2细胞随着分化的进展,细胞回缩变圆,细胞间质粘附分子减少,而TMS可部分逆转这种现象。
|
图 4 TMS抑制C3H10T1/2多潜能干细胞PPARγ表达 Figure 4 TMS attenuates expression of PPARγ in C3H10T1/2 cells during adipogenesis (Immunohistochemistry, DAB staining). NT2 and IDM2 present magnified images (Original magnification: × 400) of NT and IDM (Original magnification: ×200), respectively |
本研究发现TMS可剂量依赖性抑制IDM诱导的C3H10T1/2细胞的脂肪分化作用。肥胖主要是体内脂肪细胞的体积的增大和/或细胞数增加所致。由于我国经济的快速发展和生活方式的转变,肥胖已成为重要的公共卫生问题。虽然节食和运动是减重的有效措施,但均需要持之以恒的毅力和周围环境及政策的支持,而一旦停止,容易反弹。因此,对脂肪分化控制因子的研究以寻求解决肥胖问题已经成为近年来的热点[7]。
本研究结果表明,与未使用TMS的IDM诱导分化组相比,添加TMS抑制CYP1B1基因表达之后,不仅C3H10T1/2细胞的形态发生变化,并且还抑制了脂肪分化启动的关键基因PPARγ mRNA基因,蛋白表达水平以及下游靶基因CD36和FABP4的基因表达。
CD36作为PPARγ下游效应基因,广泛存在于各种组织细胞中,参与长链脂肪酸的跨膜转运和胰岛素抵抗等形成过程。同时相关研究也表明,当CD36表达水平减少时,脂肪酸的摄取也会相应减少[8]。这提示当关键靶基因PPARγ表达受到抑制时,其下游靶基因CD36基因和FABP4基因的表达也会受到抑制,从而影响C3H10T1/2细胞的脂肪分化。
TMS是氧化白藜芦醇的甲氧基衍生物,是一种人工合成的CYP1B1基因特异性抑制剂,对CYP1B1基因表现出很强的选择性和抑制活性[9-10]。现有研究显示,TMS在氧皮质酮和血管紧张素诱导的大鼠高血压中起重要作用[11-12],前者主要是CYP1B1在机体内氧化应激中的角色[11],后者主要是CYP1B1在血管内皮功能中的作用[12],TMS通过抑制CYP1B1的表达和活性而起作用。其次,TMS在肾脏和心血管损伤中也扮演重要角色[13-14]。我们的实验结果发现TMS会抑制CYP1B1基因表达。CYP1B1抑制剂广泛存在于食物和水果中,如葡萄、槲皮素、白藜芦醇等。植物的可及性好,经济实惠。因此可通过膳食干预来抑制机体的脂肪分化,从而达到预防肥胖的目的。
本研究仅局限于关键因子PPARγ及其下游靶基因CD36、FABP4的表达,对于其他相关因子C/EBPs家族、ADD1/SREBP1、ERR等具体影响尚未明确[15];并且对这过程中涉及的具体信号通路尚不完全清楚,因此要阐明TMS对多潜能细胞C3H10T1/2脂肪分化的影响,后期仍需要进行大量研究。
综上所述,TMS可剂量依赖性抑制脂肪分化过程中关键核转录因子PPARγ以及下游靶基因CD36和FABP4的表达,从而抑制多潜能细胞C3H10T1/2的脂肪分化。
| [1] | Mathieu P, Pibarot P, Larose É, et al. Visceral obesity and the heart[J]. Int J Biochem Cell Biol,2008, 40 (5) : 821-36. DOI: 10.1016/j.biocel.2007.12.001. |
| [2] | Muoio DM, Newgard CB. Obesity-related derangements in metabolic regulation[J]. Annu Rev Biochem,2006, 75 : 367-401. DOI: 10.1146/annurev.biochem.75.103004.142512. |
| [3] | 姚聪, 赵显茂, ColinRJ, 等. CYP1B1基因敲除对高脂膳食诱导小鼠肥胖的抑制作用[J]. 环境与健康杂志,2011, 28 (4) : 288-92. |
| [4] | Boström KL, Tintut Y, Kao SC, et al. HOXB7 overexpression promotes differentiation of C3H10T1/2 cells to smooth muscle cells[J]. J Cell Biochem,2000, 78 (2) : 210-21. DOI: 10.1002/(ISSN)1097-4644. |
| [5] | Denker AE, Haas AR, Nicoll SB, et al. Chondrogenic differentiation of murine C3H10T1/2 multipotential mesenchymal cells:Ⅰ. Stimulation by bone morphogenetic protein-2 in high-density micromass cultures[J]. Differentiation,1999, 64 (2) : 67-76. DOI: 10.1046/j.1432-0436.1999.6420067.x. |
| [6] | Huang H1, Song TJ, Li X, et al. BMP signaling pathway is required for commitment of C3H10T1/2 pluripotent stem cells to the adipocyte lineage[J]. Proc Natl Acad Sci U S A,2009, 106 (31) : 12670-5. DOI: 10.1073/pnas.0906266106. |
| [7] | Moldes M, Zuo Y, Morrison RF, et al. Peroxisome-proliferatoractivated receptor gamma suppresses Wnt/beta-catenin signalling during adipogenesis[J]. Biochem J,2003, 376 (Pt 3) : 607-13. |
| [8] | Cao Y. Adipose tissue angiogenesis as a therapeutic target for obesity and metabolic diseases[J]. Nat Rev Drug Discov,2010, 9 (2) : 107-15. DOI: 10.1038/nrd3055. |
| [9] | Chun YJ, Oh YK, Kim BJ, et al. Potent inhibition of human cytochrome P4501B1 by tetramethoxystilbene[J]. Toxicol Lett,2009, 189 (1) : 84-9. DOI: 10.1016/j.toxlet.2009.05.005. |
| [10] | Chun YJ, Lee SK, Kim MY. Modulation of human cytochrome P4501B1 expression by 2, 4, 3', 5'-tetramethoxystilbene[J]. Drug Metab Dispos,2005, 33 (12) : 1771-6. |
| [11] | Malik KU, Jennings BL, Yaghini FA, et al. Contribution of cytochrome P4501B1 to hypertension and associated pathophysiology:a novel target for antihypertensive agents[J]. Prostaglandins Other Lipid Mediat,2012, 98 (3-4) : 69-74. DOI: 10.1016/j.prostaglandins.2011.12.003. |
| [12] | Sahan-Firat S, Jennings BL, Yaghini FA, et al. 2, 3', 4, 5'-Tetramethoxystilbene prevents deoxycorticosterone-salt-induced hypertension:contribution of cytochrome P-4501B1[J]. Am J Physiol Heart Circ Physiol,2010, 299 (6) : H1891-901. DOI: 10.1152/ajpheart.00655.2010. |
| [13] | Jennings BL, Anderson LJ, Estes AM, et al. Involvement of cytochrome P-4501B1 in renal dysfunction, injury, and inflammation associated with angiotensin II-induced hypertension in rats[J]. Am J Physiol Renal Physiol,2012, 302 (4) : F408-20. DOI: 10.1152/ajprenal.00542.2011. |
| [14] | Jennings BL, Montanez DE, May ME Jr, et al. Cytochrome P4501B1 contributes to increased blood pressure and cardiovascular and renal dysfunction in spontaneously hypertensive rats[J]. Cardiovasc Drugs Ther,2014, 28 (2) : 145-61. DOI: 10.1007/s10557-014-6510-4. |
| [15] | Ross SE, Hemati N, Longo K, et al. Inhibition of adipogenesis by Wnt signaling[J]. Science,2000, 289 (5481) : 950-953. DOI: 10.1126/science.289.5481.950. |
 2015, Vol. 35
2015, Vol. 35
