肺微血管内皮细胞(PMVECs)内衬于肺泡微血管内壁,与多种肺部疾病如肺动脉高压、急性肺损伤和全身炎症反应综合征等的发病关系紧密,且这些疾病的发生均伴随着肺毛细血管通透性增高[1]。细菌脂多糖(LPS)是细菌内毒素的主要成分,诸多疾病如脓毒血症患者的肺微血管内皮细胞通透性增高均与内毒素有关,在脓毒症发病过程中,血管内皮细胞发生结构和功能上的改变,细胞间连接断裂,最终导致了屏障功能损伤[2-3];而晚期糖基化终产物受体(RAGE)则被证明可以参与到LPS介导的炎症反应中[4],但其在LPS介导内皮细胞的功能的研究少有文献报道。鉴于原代小鼠PMVEC分离难度高,目前的研究多采用人脐静脉内皮细胞和人皮肤微血管内皮细胞进行研究,其缺点是经过改造后的细胞株某些性状发生改变,在进行内皮细胞功能学研究时可能出现偏差。本研究采用免疫磁珠法,建立了一种高效的高纯度PMVECs分离方法,并采用该细胞观察RAGE在LPS刺激下内皮细胞纤维肌动蛋白F-actin变化中的作用,探讨脓毒症状态下肺通透性增高的机制,为脓毒症致肺损伤的进一步研究上提供理论依据。
1 材料和方法 1.1 主要材料清洁级6~8周龄野生型C57小鼠及RAGE敲基因小鼠各2只,雌雄不限,野生型C57小鼠购自南方医科大学实验动物中心,RAGE敲基因小鼠由日本金泽大学Kanazawa University提供,DMEM/F12培养基(Hyclone),胎牛血清、胰蛋白酶、Ⅰ型胶原酶(Gibco),内皮细胞生长因子、LPS、明胶(Sigma),大鼠抗小鼠CD31磁珠(Miltenyi),Quadaro MACs Starting kit(Miltenyi),兔抗人Ⅷ因子相关抗原多克隆抗体(北京博奥森),青/链霉素溶液(碧云天),激光共聚焦显微镜(Zeiss),Phalloidin-Rhodamine(Sigma)。
1.2 细胞分离与磁珠分选分离细胞前用1%明胶包被培养瓶37 ℃过夜,加入细胞悬液前洗出明胶并晾干残余液体。
颈椎脱臼处死小鼠后,70%乙醇消毒,迅速取小鼠肺脏,置于30 ml冰浴的基础培养基(DMEM含体积分数20%胎牛血清及1%青链霉素双抗)中,将肺叶小心剪下,去除可见的支气管,轻摇试管以去掉器官表面的红细胞。将肺组织移至干净培养皿中,用剪刀剪成碎块,并用15 ml预热的胶原酶溶液(1 mg/ml)37 ℃孵育60 min,消化过程中轻轻震荡以消化均匀。16-G金属针头接20 ml注射器抽吸研磨细胞悬液15~18次,制成单个细胞悬液,并用70 μm细胞筛将细胞悬液过滤,然后400 g/min离心10 min,弃上清,6 ml基础培养基重悬细胞。酶消化组将细胞悬液接种于包被有明胶的培养瓶内,磁珠分离组加入30 μl抗小鼠CD31磁珠,充分混匀后放入4 ℃冰箱孵育20 min,将分选柱置于磁力架上,使用含EDTA的PBS(buffer)漂洗分选柱3次,每次5 ml。漂洗后加入孵育好磁珠的细胞悬液,结合有磁珠的原代内皮细胞即贴附在分选柱管壁上,细胞悬液过完分选柱后用PBS漂洗分选柱3次,将得到的原代内皮细胞加入5 ml含20% FBS及1%双抗的培养基,接种在明胶包被的培养瓶中,48 h后换液。
1.3 细胞的传代细胞长至80%~90%融合时即可传代。吸出原有培养液,PBS液漂洗2次,0.125%胰蛋白酶消化约1 min,显微镜下观察细胞间连接疏松,细胞成片收缩时吸出消化液,加入含5%胎牛血清的DMEM液终止消化,用吸管将细胞自瓶底吹打下来,收集细胞悬液至离心管,1200 r/min离心5 min,弃上清,20% FBS的培养基重悬。
1.4 细胞生长曲线的测定采用细胞计数法进行细胞生长曲线的测定,6×104个细胞接种于3.5 cm培养皿中,共21皿,于细胞孵箱中培养,每隔24 h取出3皿,胰酶消化,完全培养基终止消化后1200 r/min离心5 min,2 ml培养基重悬为均匀细胞悬液,每皿计数两次,取平均值。连续计数7 d,最后根据细胞计数结果,以细胞个数(104/孔)为纵坐标,时间(天)为横坐标绘制生长曲线[5]。
1.5 LPS处理细胞将培养的小鼠PMVECs接种于petri皿中,待细胞长至90%融合后血清饥饿2 h,以1 mg/L LPS刺激不同时间,具体分组有WT PMVECs 60 min、120 min、240 min;RAGE(-/-)PMVECs 60 min、120 min、240 min。采用不加LPS,其余处理条件均相同的作为对照组。
1.6 免疫荧光染色采用免疫荧光法[6]检测Ⅷ因子相关抗原,培养的第3-4代细胞接种至petri皿中,细胞长成单层后弃去培养液。用PBS洗3次,每次2 min,4%多聚甲醛固定10 min,PBS洗3次,每次2 min,0.5%Triton X-100打孔10 min,PBS洗3次,每次2 min,5%BSA封闭1 h,滴加兔抗人Ⅷ因子相关抗原(1:50),4 ℃孵育过夜,PBS洗3次,每次2 min,荧光标记的羊抗兔IgG(1:200)室温避光孵育1 h,PBS洗3次,每次2 min,DAPI(1:1000)染细胞核30 min,PBS洗3次,每次2 min,缓冲甘油封片,荧光显微镜下观察、摄片。检测小鼠PMVECs细胞骨架时主要为滴加Phalloidin-Rhodamine(1:200),室温避光孵育1 h,其余同上。
1.7 细胞纯度及F-actin荧光值分析细胞纯度分析每组选3幅图,采用ImageJ软件计数细胞核数量及Ⅷ阳性细胞数量,后者与前者比值表示纯度;F-actin荧光值分析以ImageJ软件分析各组灰度值,以对照组面积灰度值为100%与实验组进行比较。
1.8 统计学处理应用SPSS 13.0统计软件,数据用均数±标准差表示。多组间显著性检验采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠PMVECs的形态学观察培养物接种4~5 d后细胞接近融合,融合的单细胞层具有血管内皮细胞铺路石样形态(图 1)。

|
图 1 DMEM/F12中培养3 d的小鼠PMVEC光镜图片 Figure 1 Microscopy of mouse pulmonary microvascular endothelial cells cultured in DMEM/F12 medium for 3 days (Original magnification: ×100). |
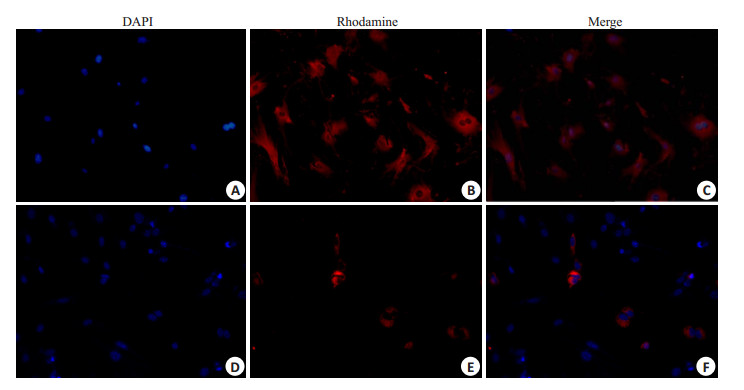
如图(图 2)为培养至第五代细胞,荧光显微镜下,经Ⅷ因子相关抗原染色的小鼠PMVECs胞浆呈红色荧光,细胞呈短梭形、多边形(图 2B),磁珠分离所获得细胞经传代纯度未见明显下降(图 2C),仍可高达95% [(95.04±1.01)%]左右,而酶消化组随传代次数增多Ⅷ因子阳性细胞明显减少,杂细胞呈优势生长(图 2F),纯度仅10%[(10.95±0.54)%]左右。
|
图 2 原代分离的小鼠PMVECⅧ因子鉴定 Figure 2 Identification of primary mouse PMVECs with factor Ⅷ (Original magnification: × 100). Cell nuclei were stained with DAPI, and the cells expressing Factor Ⅷ were stained with Rhodamine. A, B, C: Cells separated with magnetic beads; D, E, F: Cells separated with collagenase. |
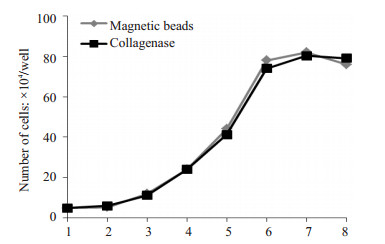
由图可见(图 3),两种分离方法的细胞生长曲线相似,均成典型的“S”形。细胞接种后24 h之内处于潜伏期,随后开始分裂增殖,第2~5天细胞增殖速度较快,为对数生长期,第6天细胞接近融合,增殖速度减慢,至第7 d细胞接触抑制,进入停止期。提示磁珠不影响细胞分裂增殖。
|
图 3 第3代PMVECs生长曲线 Figure 3 Growth curves of PMVECs in passage 3. |
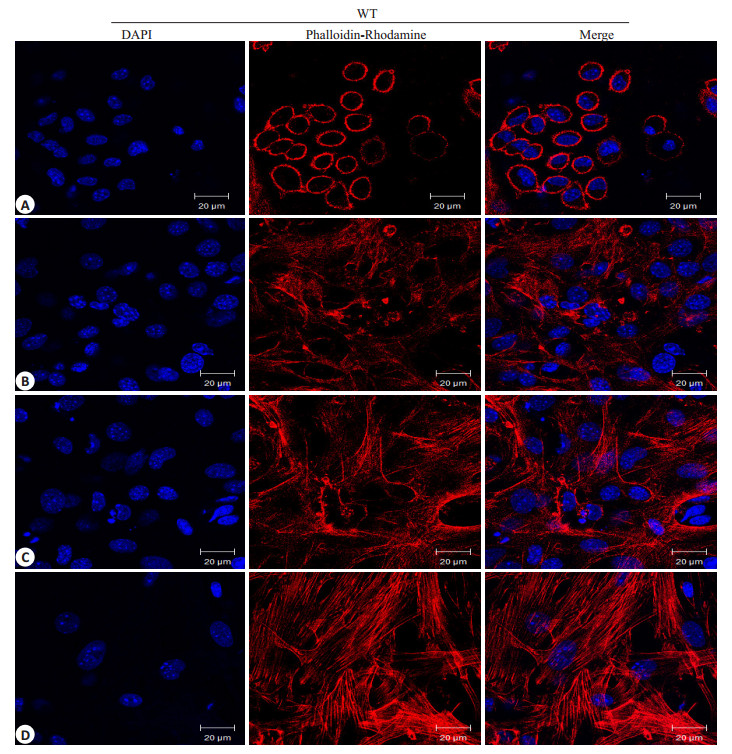
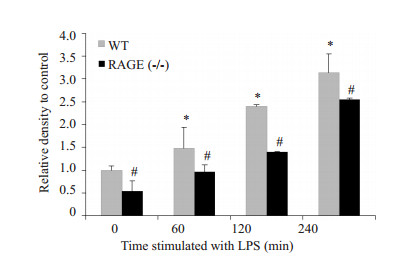
由图可见(图 4),DAPI检测细胞核(蓝色),罗丹明标记的鬼笔环肽检测F-actin(红色)。空白对照组F-actin分布于细胞周边,完整连续,无明显缝隙形成(图 4A),1 mg/L的LPS刺激60 min时细胞F-actin开始断裂,外周致密带边缘毛糙不规整(图 4B),至120 min(图 4C),240 min(图 4D)细胞骨架破坏严重,边界模糊,形成明显的应力纤维。统计结果提示LPS以时间依赖性导致小鼠PMVEC的F-actin形态及分布改变(图 6,P < 0.05)。
|
图 4 LPS刺激下WT小鼠PMVECs F-actin的改变 Figure 4 Change of F-actin in wild-type mouse PMVECs induced by LPS (Original magnification: ×630). Mouse PMVECs grown on Petri dishes were incubated with LPS (1 mg/L) for 0 (A), 60 (B), 120 (C) and 240 (D) min. Cell were probed with DAPI to label cell nucleus (Blue) and with rodamine-conjugated phalloidin to detect actin faliments (Red). |
|
图 6 LPS刺激下WT小鼠和RAGE(-/-)小鼠PMVECs F-actin的灰度值 Figure 6 Relative density of F-actin in wide type and RAGE (-/-) mouse PMVECs induced by LPS. *P < 0.05 vs WT-0; #P < 0.05 vs WT. |
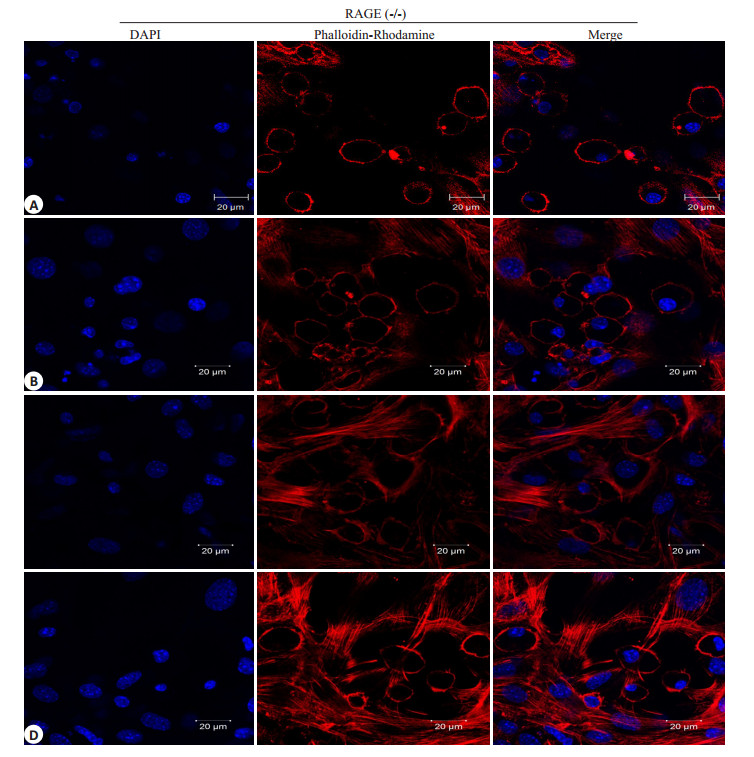
由图可见(图 5),空白对照组F-actin分布于细胞周边,完整连续,无明显缝隙形成(图 5A),1mg/L的LPS刺激60 min时细胞F-actin未见明显改变(图 5B),至120 min时F-actin发生轻微变化,外周致密带开始崩解,胞内出现少量应力纤维(图 5C),刺激240 min后骨架破坏进一步加重,胞内应力纤维增加(图 5D),但与相应WT组相比,细胞骨架破坏程度明显减轻,形成的应力纤维减少(图 6,P < 0.05),结果提示RAGE参与调控LPS介导的小鼠PMVEC骨架破坏。
|
图 5 LPS刺激下RAGE(-/-)小鼠PMVECs F-actin的改变 Figure 5 Change of F-actin in RAGE (-/-) mouse PMVECs induced by LPS (Original magnification: × 630). Mouse PMVECs grown on Petri dishes were incubated with LPS (1 mg/L) for 0 (A), 60 (B), 120 (C) and 240 (D) min. Cell were probed with DAPI to label cell nucleus (Blue) and with rodamine-conjugated phalloidin to detect actin faliments (Red). |
LPS为革兰氏阴性菌细胞外膜的主要成分,具有很强的促炎活性,在脓毒症中发挥主要作用[7];RAGE是一种具有重要功能的多配体受体,属于单穿膜片段受体,为免疫球蛋白超家族的成员,其与相应的配体结合后可启动若干信号通路, 参与炎症的发生发展[8]。多数研究认为LPS主要通过与TLR4受体结合而发挥其致炎作用[9],而近期研究证明RAGE与TLRs可与相同配体结合如LPS、HMGB1等介导下游信号转导中并协同发挥作用[10-12]。
内皮细胞呈单层连续性衬在血管内面,血管形态变化及收缩性改变主要受内皮细胞骨架蛋白F-actin和肌球蛋白的影响,当内皮细胞受到各种刺激时,F-actin发生重组和再分布,细胞中央出现大量平行束状应力纤维,中心张力增加使收缩力超过粘附力,细胞收缩,细胞间隙增大,形成细胞旁通路, 最终导致通透性升高[13-14];炎症反应会导致内皮细胞功能障碍甚至损伤,导致屏障功能受损,血管通透性升高,而脓毒症时的肺损伤与肺微血管内皮细胞功能受损密切相关[15-16],因此本实验以肺微血管内皮细胞作为实验对象,LPS为刺激物进行研究。
自从Jaffe等[17]首次体外成功培养人脐带静脉内皮细胞后,血管内皮细胞的培养技术不断改进,目前主要有酶消化法、组织块法及免疫磁珠法,前两种方法虽然步骤简单、经济易行,但是存在成纤维细胞等杂细胞干扰的缺点[18],即便使用差速贴壁和分次消化的方法也不能确切的去除杂细胞[19],从而降低了其实用性,因此本实验同时采用酶消化法及免疫磁珠两种方法分离细胞, 酶消化法混有大量杂细胞,而磁珠法成功地培养出小鼠肺微血管内皮细胞,且经第Ⅷ因子相关抗原鉴定,证明培养获得的细胞为小鼠肺微血管内皮细胞,传代至第5代细胞生长良好,未观察到明显杂细胞污染,为我们的后续研究提供了基础。本实验通过观察PMVECs细胞骨架在LPS刺激下的变化情况,提示细胞骨架的破坏是脓毒症时内皮细胞通透性增高的重要原因;比较RAGE(-/-)小鼠与WT小鼠在LPS刺激下PMVECs细胞骨架变化则证明了RAGE参与调控了LPS介导的PMVECs骨架变化。
综上所述,肺微血管内皮细胞在多种肺部疾病中发挥作用,具有重要研究意义,而人肺微血管内皮细胞较难获得,因此本实验原代分离小鼠PMVEC并以此为模型,用免疫荧光染色法显示细胞骨架F-actin在LPS不同时间作用下的形态学变化,定性的反应了LPS对PMVEC通透性的影响,通过比较WT与RAGE(-/-)小鼠PMVEC对LPS的不同反应,初步证明了RAGE参与调控了LPS介导的内皮细胞骨架变化,为脓毒症介导肺损伤的进一步研究提供理论依据,但其具体分子机制以及功能学实验有待进一步研究。
| [1] | Elias AS, Oliveira GP, Ornellas DS, et al. Effects of early and late pneumothorax drainage on the development of pulmonary oedema[J]. Respir Physiol Neurobiol,2014, 195C : 27-36. |
| [2] | Bogatcheva NV, Zemskova MA, Kovalenkov Y, et al. Molecular mechanisms mediating protective effect of cAMP on lipopolysaccharide (LPS)-induced human lung microvascular endothelial cells (HLMVEC) hyperpermeability[J]. J Cell Physiol,2009, 221 (3) : 750-9. DOI: 10.1002/jcp.21913. |
| [3] | Mutunga M, Fulton B, Bullock R, et al. Circulating endothelial cells in patients with septic shock[J]. Am J Respir Crit Care Med,2001, 163 (1) : 195-200. DOI: 10.1164/ajrccm.163.1.9912036. |
| [4] | He ZW, Qin Y H, Wang ZW, et al. HMGB1 acts in synergy with lipopolysaccharide in activating rheumatoid synovial fibroblasts via p38 MAPK and NF-kappaB signaling pathways[J]. Mediators Inflamm,2013 : 596716. |
| [5] | Gillespie KM, Saoudi A, Kuhn J, et al. Th1/Th2 cytokine gene expression after mercuric chloride in susceptible and resistant rat strains[J]. Eur J Immunol,1996, 26 (10) : 2388-92. DOI: 10.1002/(ISSN)1521-4141. |
| [6] | 吴丽丽, 王立群, 王达, 等. 形态学观察晚期糖基化终末产物诱导微血管内皮细胞核因子κB入核及其机制[J]. 中国动脉硬化杂志,2013, 21 (3) : 198-202. |
| [7] | 钟田雨, 唐靖, 刘亚伟, 等. 丝裂原活化的蛋白激酶在高迁移率族蛋白1诱导内皮细胞释放炎性细胞因子中的作用[J]. 南方医科大学学报,2009, 29 (8) : 1517-20. |
| [8] | Li Y, Wu R, Zhao S, et al. RAGE/NF-κB pathway mediates lipopolysaccharide-induced inflammation in alveolar type I epithelial cells isolated from neonate rats[J]. Inflammation,2014, 37 (5) : 1623-9. DOI: 10.1007/s10753-014-9889-y. |
| [9] | Parajuli B, Sonobe Y, Kawanokuchi J, et al. GM-CSF increases LPS-induced production of proinflammatory mediators via upregulation of TLR4 and CD14 in murine microglia[J]. J Neuroinflammation,2012, 9 : 268. DOI: 10.1186/1742-2094-9-268. |
| [10] | Ibrahim ZA, Armour CL, Phipps SA. RAGE and TLRs: relatives, friends or neighbours[J]. Mol Immunol,2013, 56 (4) : 739-44. DOI: 10.1016/j.molimm.2013.07.008. |
| [11] | Nogueira-Machado JA, De Oliveira Volpe CM, Chaves MM. HMGB1, TLR and RAGE: a functional tripod that leads to diabetic inflammation[J]. Expert Opin Ther Targets,2011, 15 (8) : 1023-35. DOI: 10.1517/14728222.2011.575360. |
| [12] | González-López A, Aguirre A, López-Alonso I, et al. MMP-8 deficiency increases TLR/RAGE ligands S100A8 and S100A9 and exacerbates lung inflammation during endotoxemia[J]. PLoS One,2012, 7 (6) : e39940. DOI: 10.1371/journal.pone.0039940. |
| [13] | 郭晓华, 陈波, 王述昀, 等. 晚期糖基化终产物诱导血管内皮细胞骨架形态改变的机制[J]. 中国动脉硬化杂志,2005, 13 (3) : 282-6. |
| [14] | Wu XD, Liu WL, Zeng K, et al. Advanced glycation end products activate the miRNA/RhoA/ROCK2 pathway in endothelial cells[J]. Microcirculation,2014, 21 (2) : 178-86. DOI: 10.1111/micc.2014.21.issue-2. |
| [15] | Suriyo T, Watcharasit P, Thiantanawat A, et al. Arsenite promotes apoptosis and dysfunction in microvascular endothelial cells via an alteration of intracellular Calcium homeostasis[J]. Toxicol In Vitro,2012, 26 (3) : 386-95. DOI: 10.1016/j.tiv.2011.12.017. |
| [16] | Jaffe EA, Nachman RL, Becker CG, et al. Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria[J]. J Clin Invest,1973, 52 (11) : 2745-56. DOI: 10.1172/JCI107470. |
| [17] | Borg M, Bakke O, Progida C. A novel interaction between Rab7b and actomyosin reveals a dual role in intracellular transport and cell migration[J]. J Cell Sci,2014 . |
| [18] | 李敏, 杨明会, 刘毅. 大鼠肺微血管内皮细胞培养方法的对比和改进[J]. 中国组织工程研究与临床康复,2008, 12 (31) : 6141-4. |
 2015, Vol. 35
2015, Vol. 35
