乳腺癌是女性中发病率高的癌症[1]。其中三阴乳腺癌(TNBC)以雌激素受体(ER)、孕激素受体(PR)和HER2/neu均为阴性表达,预后差[2-3]为特征。因缺乏针对性的治疗靶点,目前临床上结合手术的全身治疗只能依靠化疗。近年来,免疫治疗备受关注,为三阴乳腺癌的治疗提供了新的切入点。因此,本实验尝试利用免疫缺陷鼠构建具有人免疫内环境的小鼠模型,为三阴乳腺癌的免疫治疗提供研究平台。
现实验常用免疫缺陷鼠包括裸鼠、SCID鼠及NOD/ SCID鼠,裸鼠表现为T细胞免疫缺陷,B细胞免疫正常。SCID小鼠T、B细胞免疫缺陷,但体内存在正常的NK细胞[4]。NOD/SCID免疫特征为:T、B细胞缺乏,NK细胞活性降低[5]。相较裸鼠及SCID鼠,NOD/SCID鼠免疫背景更干净。故本实验尝试在NOD/SCID小鼠基础上建立人免疫重建模型,并观察其对三阴乳腺癌的产生免疫应答。
1 材料和方法 1.1 动物和细胞3~5周NOD/SCID小鼠,雌性,24只,体质量16~20 g,购自北京维通利华实验动物技术有限公司。在中山大学北校区动物实验中心于SPF条件下饲养,为避免动物运输时产生的应激反应引起实验误差,所有小鼠均在到达实验中心后5~7 d开始实验。人三阴乳腺癌细胞株MDA-MB-231由本实验室保存。新鲜健康人外周血试验用血液成分白细胞富集物由广州市中心血站提供。
1.2 主要试剂DMEM高糖培养基、RPMI 1640培养基、胎牛血清购自美国Gibco;淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司,红细胞裂解液购自广州杰特伟生物科技有限公司,注射用环磷酰胺购自山西普德药业有限公司;人、鼠IgG、ELISA检测试剂盒购自南京凯基生物科技发展有限公司;FACS Calibur流式细胞仪购自美国BD;流式细胞抗体CD3-PE及其同型对照购自美国BD。
1.3 方法 1.3.1 肿瘤细胞培养及PBMC提取人三阴乳腺癌细胞株MDA-MB-231用含10%胎牛血清的DMEM完全培养基在37 ℃、体积分数5% CO2恒温培养箱中培养。取对数生长期细胞计数5×107/ml重悬于无菌PBS。密度梯度离心法提取PBMC [6],简述如下:取白细胞富集物等量生理盐水稀释后,滴加于淋巴细胞分离液上,保持界面清晰。稀释血液和淋巴细胞分离液体积比2:1,450 g离心25 min,吸取白膜层,用5倍体积的生理盐水稀释以去除残余淋巴细胞分离液,分别用450、220 g各10 min离心洗涤,弃上清液,计数8×107/ml重悬于无菌PBS。
1.3.2 模型建立及分组NOD/SCID小鼠24只,随机分为4组,每组6只。实验前尾静脉采血测定鼠IgG,确定无免疫渗漏(IgG < 5 μg/ml)。免疫荷瘤组腹腔注射环磷酰胺(CTX)250 mg/kg,进一步抑制小鼠体内NK细胞活性,3 d后经腹腔注射[7]4×107/只健康人外周血单个核细胞(PBMC),同时背部皮下接种1×107/只MDA-MB-231三阴乳腺癌细胞;单纯免疫组仅注射同量CTX及PBMC,不荷瘤;单纯荷瘤组仅在背部皮下接种同量三阴乳腺癌细胞;空白对照组不作任何处理。
1.3.3 观察小鼠生物学特征腹腔注射CTX后每天观察小鼠精神状态,进食,毛发,体质量变化。荷瘤后游标卡尺测量肿瘤大小,并记录小鼠成瘤潜伏期及成瘤率。肿瘤成瘤后(直径≥5 mm)记录肿瘤最长径(a)和最短径(b),并按以下公式计算肿瘤的体积:V=ab2/2。绘制小鼠肿瘤生长曲线,体质量曲线,生存率曲线及自然生存时间。第9周末处死所有小鼠后取脾脏称重,并按以下公式计算脾指数:脾指数=脾脏重量/小鼠体质量。
1.3.4 ELISA检测小鼠外周血人IgG含量分别于免疫荷瘤后第2、4、6周末用含肝素试管收集小鼠尾静脉血,室温静置3 h,3000 r/min离心5 min。用ELISA双抗体夹心法检测小鼠血浆中人IgG蛋白含量,具体按说明书操作。在酶标仪波长490 nm上读取吸光度值,并按标准曲线换算成相应浓度值。
1.3.5 流式细胞术检测小鼠外周血及脾脏CD3+细胞比例分别于免疫荷瘤后第2、4、6周末取小鼠外周血及第9周末处死小鼠后取脾脏。尾静脉血加红细胞裂解液37 ℃反应10 min去除红细胞。脾脏冰上200目滤网研磨收集脾细胞,离心,去上清,加红细胞裂解液37 ℃反应10 min。两者均用PBS洗涤两次(1200 r/min,5 min),CD3-PE标记,冰上避光孵育30 min,用PBS洗涤两次(1200 r/min,5 min),流式细胞仪检测。
1.4 统计学分析所有数据以均数±标准差表示,用计算机SPSS16.0统计软件处理。小鼠生存率比较采用log-rank法分析,随时间采集数据的多组间比较采用Two-way ANOVA。两组间比较采用独立t检验。P < 0.05为有统计学差异。
2 结果 2.1 小鼠生物学特征两组接受免疫重建的小鼠(免疫荷瘤组及单纯免疫组)在CTX注射后1周内体质量下降,进食量较前减少。免疫荷瘤组小鼠中有1只于注射PBMC后明显表现出精神萎靡,毛发蓬松杂乱,并于第16天内死亡,考虑为GVHD [8]。其余小鼠GVHD表现不明显,期间小鼠精神状态可,毛发无明显脱落,无呕吐,CTX注射后2~3 d排少量稀便。
单纯荷瘤组成瘤潜伏期8~10 d。免疫荷瘤组成瘤潜伏期10~12 d,两组小鼠成瘤率均为100%。免疫荷瘤组相比单纯荷瘤组肿瘤生长减缓,同期肿瘤体积缩小(P < 0.01),第5周末肿瘤体积分别为1244.82±792.82 mm3和4308.77 mm3(图 1A)。两组肿瘤均含有丰富血管及完整包膜,切面灰白色鱼肉状,肉眼可见瘤体中心出现明显坏死。
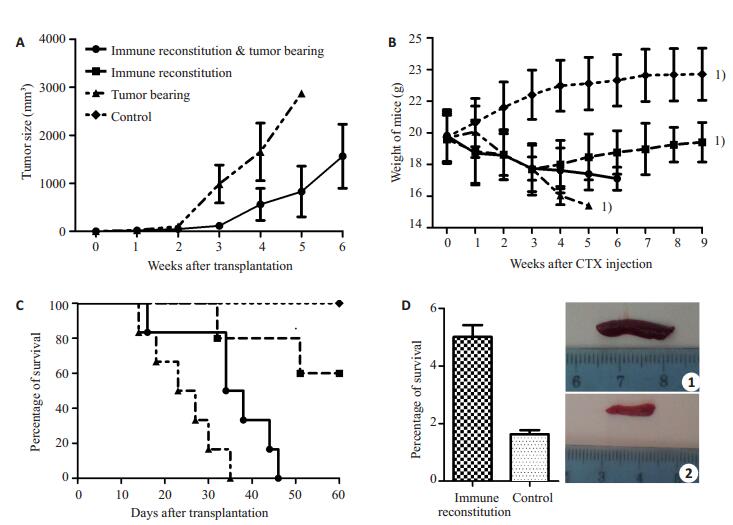
|
图 1 各组小鼠接受处理后生物学表现 Figure 1 Changes of tumor size and body weight, survival rate, and spleen indexof the mice in each group. A: Tumor size in immune reconstitution & tumor-bearing and immune reconstitution groups (P < 0.01); B: Body weight of the mice in each group after CTX injection. 1) P < 0.01 vs immune reconstitution & tumor-bearing group; C: Survival curves in each group. P < 0.01 between immune reconstitution & tumor-bearing group and tumor-bearing group; P > 0.05 between immune reconstitution group and control group; D: Spleen index and spleen size (① and ②) in immune reconstitution group and control group (P < 0.01). |
免疫荷瘤组小鼠体质量相比单纯免疫组及空白对照组明显下降(P < 0.01),但对比单纯荷瘤组从第3周开始有明显改善(P < 0.01,图 1B)。单纯荷瘤组小鼠在荷瘤后第14天即开始出现死亡,濒死前出现消瘦,精神萎靡,毛发杂乱松散,并于第35天全部死亡。免疫荷瘤组小鼠(除外因GVHD死亡1只小鼠)从34 d才开始出现死亡,生存率明显提高(P < 0.01)。单纯免疫组与空白对照组在9周内生存率无统计学差异(P>0.05,图 1C)。因免疫荷瘤组与单纯荷瘤组小鼠于第9周前全部死亡,无法取得相应脾脏数据。单纯免疫组脾指数5.01±0.41 mg/g高于空白对照组1.63±0.14 mg/g(P < 0.01,图 1D),图 1D ①和②分别为单纯免疫组及空白对照组第9周末小鼠脾脏大小。
2.2 小鼠外周血人IgG含量接受免疫重建的小鼠(免疫荷瘤组与单纯免疫组)外周血于第2周即可测到一定量人IgG,并在第2~6周内呈上升趋势,对比未免疫重建小鼠(单纯荷瘤组及空白对照组)差异有统计学意义(P < 0.01)。免疫荷瘤组与单纯免疫组间的差异也有统计学意义(P < 0.01,表 1)。
| 表 1 小鼠外周血中人IgG含量 Table 1 Human IgG content in the peripheral blood of the mice (μg/ml, Mean±SD) |
免疫荷瘤组及单纯免疫组小鼠外周血中于免疫重建后第2周即可检测到人CD3+T细胞(54.4%及51.7%),并呈递减趋势,但在第9周末仍可测到,对比两组未免疫重建小鼠(单纯荷瘤组及空白对照组)差异均有统计学意义(P < 0.01)。两组接受免疫重建的小鼠间差异也具有统计学意义(P < 0.01,图 2)。第9周末处死小鼠后取脾脏细胞,去除红细胞后可测得单纯免疫组及空白对照组小鼠脾脏中人CD3+T细胞比例分别为52.7%及0.45%(图 3)
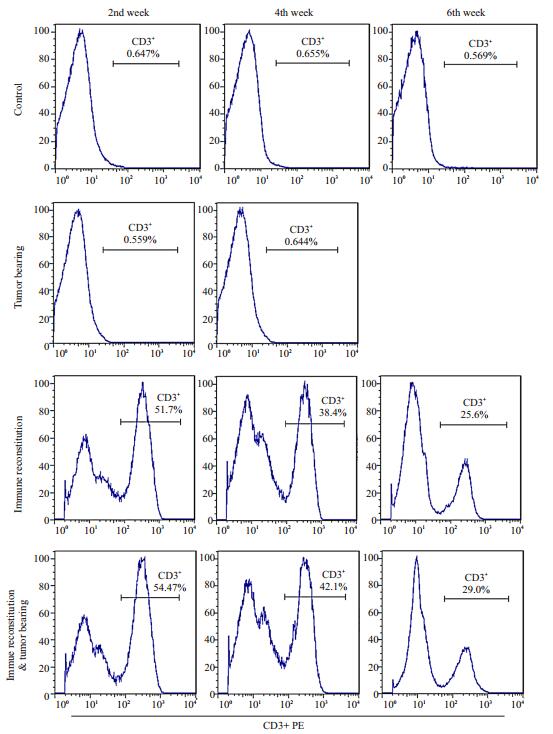
|
图 2 小鼠外周血中人CD3+T细胞比例 Figure 2 Percentage of human CD3+T cells in the peripheral blood of the mice. |
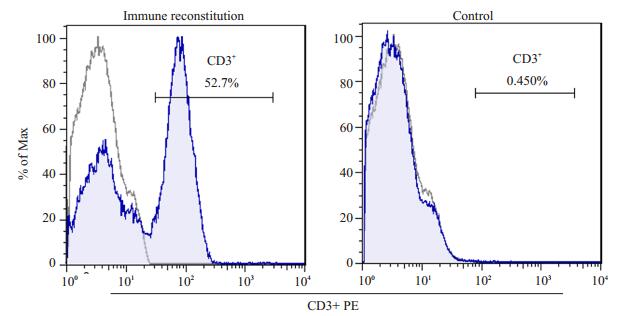
|
图 3 第9周末小鼠脾脏中人CD3+T细胞比例 Figure 3 Percentage of human CD3+T cells in the spleen of the mice at 9 weeks. |
现国内外用于免疫重建的免疫缺陷鼠包括裸鼠、SCID鼠及NOD/SCID鼠[9-11]。因为裸鼠体内存在正常的B细胞免疫,对植入的人淋巴细胞产生排斥反应,导致免疫重建成功率低[9, 12]。NOD/SCID (none obesity disease Severe Combined Immune-Deficiency)小鼠是在SCID小鼠的基础上与非肥胖性糖尿病小鼠(NOD/ Lt)品系回交而得到的免疫缺陷鼠。其免疫特征为:T、B细胞缺陷,NK细胞活性降低,并不再发生自身免疫性糖尿病[5]。相较B、NK细胞免疫正常的裸鼠及NK细胞正常的SCID鼠,NOD/SCID鼠免疫背景更干净,免疫重建的成功率也更高。Shultz等[13]的研究表明SCID小鼠约90%可发生免疫渗漏,而NOD/SCD小鼠不到10%。Hesselton等[14]筛查实验评价了一系列SCID小鼠与不向遗传背景品系的小鼠回交的后代,发现NOD/SCID小鼠对人外周血移植水平较其他遗传品系SCID小鼠高5~10倍。为保证建模的成功率及模型的稳定性,本实验选取了NOD/SCID小鼠作为免疫重建的对象。为进一步抑制NOD/SCID小鼠体内残存的NK细胞对植入的异种淋巴细胞产生的排斥反应,提高免疫重建成功率,植入淋巴细胞前3 d先行注射CTX [15]。虽经CTX注射后小鼠体质量有所下降,但并不增加小鼠死亡率。
国内外免疫重建的方法很多,包括取脐带血、骨髓、外周血、胎肝、胎胸腺等经小鼠腹腔、尾静脉注射或肾包膜下移植[16-20],其中经腹腔注射人外周血淋巴细胞的方法最为简单有效,且人外周血细胞来源充足,成为小鼠免疫重建最为常用的方法。人免疫重建的关键在于PBMC的移植,其输注量过多,易产生GVHD [21-22],导致模型建立的失败,过少则无法达到免疫重建的目的。参考既往实验,本实验中采用4×107移植数量,结果显示免疫荷瘤组及单纯免疫组小鼠GVHD发生率低(1/ 12),移植成功率高(11/12),且单纯免疫组与空白对照组小鼠生存状态无明显差异,是较为适合的PBMC移植数量。
免疫荷瘤组及单纯免疫组小鼠外周血从第2周开始即可检测到人IgG,明显高于单纯荷瘤组及空白对照组,并在6周内随时间逐渐升高,证明小鼠体液免疫功能建立并逐渐增强。同时,从第2周开始可检测到免疫荷瘤组及单纯免疫组小鼠外周血中人CD3+T细胞,明显高于单纯荷瘤组及空白对照组,虽然随时间逐渐减少,但于第9周仍可检测到。进一步检测发现单纯免疫组小鼠脾脏内人CD3+T细胞及脾指数远高于空白对照组,表明移植的淋巴细胞活化,由腹腔迁移入外周血,并进一步定居在小鼠的重要免疫器官--脾脏中,提示免疫重建成功。
免疫荷瘤组小鼠成瘤率为100%,较单纯荷瘤组小鼠成瘤潜伏期延长,同期体积缩小,免疫荷瘤组小鼠体质量和生存率均较单纯荷瘤组小鼠提高,且免疫荷瘤组小鼠外周血中人IgG及CD3+T细胞含量高于单纯免疫组小鼠,证明免疫重建后小鼠体内人免疫系统对移植瘤产生免疫应答,进一步活化增殖并起一定的抑制移植瘤生长作用,给小鼠带来生存受益。
综上所述:采用腹腔注射人淋巴细胞、皮下接种人三阴乳腺癌细胞的方法可以有效地建立较稳定的具有人免疫学特征的荷人三阴乳腺癌NOD/SCID小鼠模型。小鼠来源充足,取材方便,操作简单,并能较好地模拟三阴乳腺癌人体内免疫情况,为研究三阴乳腺癌的免疫治疗提供了较为理想的模型。
| [1] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of Cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer,2010, 127 (12) : 2893-917. DOI: 10.1002/ijc.v127:12. |
| [2] | Foulkes WD, Smith IE, Reis-Filho JS. Triple-negative breast Cancer[J]. N Engl J Med,2010, 363 (20) : 1938-48. DOI: 10.1056/NEJMra1001389. |
| [3] | Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast Cancer[J]. J Clin Oncol,2008, 26 (8) : 1275-81. DOI: 10.1200/JCO.2007.14.4147. |
| [4] | Bosma GC, Custer RP, Bosma MJ. A severe combined immunodeficiency mutation in the mouse[J]. Nature,1983, 301 (5900) : 527-30. DOI: 10.1038/301527a0. |
| [5] | Greiner DL, Hesselton RA, Shultz LD. SCID mouse models of human stem cell engraftment[J]. Stem Cells,1998, 16 (3) : 166-77. DOI: 10.1002/stem.v16:3. |
| [6] | 张鹏, 刘瑞磊, 姜华, 等. 三阴乳腺癌细胞-树突状细胞融合疫苗的抗肿瘤免疫效应[J]. 南方医科大学学报,2012, 32 (6) : 778-83. |
| [7] | King M, Pearson T, Shultz LD, et al. A new Hu-PBL model for the study of human islet alloreactivity based on NOD-scid mice bearing a targeted mutation in the IL-2 receptor gamma chain gene[J]. Clin Immunol,2008, 126 (3) : 303-14. DOI: 10.1016/j.clim.2007.11.001. |
| [8] | Williamson LM, Warwick RM. Transfusion-associated graft-versushost disease and its prevention[J]. Blood Rev,1995, 9 (4) : 251-61. DOI: 10.1016/S0268-960X(95)90016-0. |
| [9] | 马云龙, 郑铮, 郭华, 等. 树突状细胞疫苗联合胸腺肽α1对人源化免疫重建裸鼠结肠癌生长的抑制效应[J]. 中华实验外科杂志,2007, 24 (11) : 1357-9. |
| [10] | Gilet J, Chang Y, Chenivesse C, et al. Role of CCL17 in the Generation of cutaneous inflammatory reactions in Hu-PBMCSCID mice grafted with human skin[J]. J Invest Dermatol,2009, 129 (4) : 879-90. DOI: 10.1038/jid.2008.333. |
| [11] | Vlad G, D'agati VD, Zhang QY, et al. Immunoglobulin-like transcript 3-Fc suppresses T-cell responses to allogeneic human islet transplants in hu-NOD/SCID mice[J]. Diabetes,2008, 57 (7) : 1878-86. DOI: 10.2337/db08-0054. |
| [12] | 聂唯, 唐医亚, 容鹏飞, 等. CD4+T细胞抗体标记超顺磁性氧化铁MR成像诊断异种胰岛移植免疫排斥反应的实验研究[J]. 中华放射学杂志,2008, 42 (10) : 1084-8. |
| [13] | Shultz LD, Schweitzer PA, Christianson SW, et al. Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice[J]. J Immunol,1995, 154 (1) : 180-91. |
| [14] | Hesselton RM, Greiner DL, Mordes JP, et al. High levels of human peripheral blood mononuclear cell engraftment and enhanced susceptibility to human immunodeficiency virus type 1 infection in NOD/LtSz-scid/scid mice[J]. J Infect Dis,1995, 172 (4) : 974-82. DOI: 10.1093/infdis/172.4.974. |
| [15] | Welsh RM, O'donnell CL, Shultz LD. Antiviral activity of NK 1.1+ natural killer cells in C57BL/6 scid mice infected with murine cytomegalovirus[J]. Nat Immun,1995, 13 (5) : 239-45. |
| [16] | Huang J, Li X, Coelho-dos-Reis JG, et al. An AAV vector-mediated gene delivery approach facilitates reconstitution of functional human CD8+T cells in mice[J]. PLoS One,2014, 9 (2) : e88205. DOI: 10.1371/journal.pone.0088205. |
| [17] | Zibara K, Hamdan R, Dib L, et al. Acellular bone marrow extracts significantly enhance engraftment levels of human hematopoietic stem cells in mouse xeno-transplantation models[J]. PLoS One,2012, 7 (7) : e40140. DOI: 10.1371/journal.pone.0040140. |
| [18] | Lee SH, Kim DS, Lee MW, et al. A strategy for enhancing the engraftment of human hematopoietic stem cells in NOD/SCID mice[J]. Ann Hematol,2013, 92 (12) : 1595-602. DOI: 10.1007/s00277-013-1830-1. |
| [19] | Joo SY, Chung YS, Choi B, et al. Systemic human T cell developmental processes in humanized mice cotransplanted with human fetal thymus/liver tissue and hematopoietic stem cells[J]. Transplantation,2012, 94 (11) : 1095-102. DOI: 10.1097/TP.0b013e318270f392. |
| [20] | Gonzalez L, Strbo N, Podack ER. Humanized mice:novel model for studying mechanisms of human immune-based therapies[J]. Immunol Res,2013, 57 (1/3) : 326-34. |
| [21] | Chiang EY, Kolumam G, Mccutcheon KM, et al. In vivo depletion of lymphotoxin-alpha expressing lymphocytes inhibits xenogeneic graft-versus-host-disease[J]. PLoS One,2012, 7 (3) : e33106. DOI: 10.1371/journal.pone.0033106. |
| [22] | Chen X, Chang CH, Stein R, et al. Prevention of acute graftversus-host disease in a xenogeneic SCID mouse model by the humanized anti-CD74 antagonistic antibody milatuzumab[J]. Biol Blood Marrow Transplant,2013, 19 (1) : 28-39. DOI: 10.1016/j.bbmt.2012.09.015. |
 2015, Vol. 35
2015, Vol. 35
