2. 蚌埠医学院药学系,安徽 蚌埠 233030 ;
3. 蚌埠丰原医 药科技发展有限公司,安徽 蚌埠 233010
2. Faculty of Pharmacy, Bengbu Medical College, Bengbu 233030, China ;
3. Bengbu Fengyuan Medical Science and Technology Development Co., Bengbu, 233010, China
硫酸乙酰肝素(HS)是一类广泛存在于组织细胞表面、细胞外基质中的糖胺聚糖,是一个由糖醛酸-氨基葡萄二糖为基本单元的重复聚合体,糖链上分布有低硫酸化的葡萄糖醛酸-N位乙酰化的氨基葡萄糖区(NA)和高硫酸化的艾杜糖醛酸-N位硫酸化的氨基葡萄糖区(NS),两区中间隔一NA/NS混合区,相对分子质量约2000~15 000 [1]。本课题组早年的研究工作证实正常人乳腺上皮细胞合成的HS对MDA-MB-231和MCF-7细胞的增殖具有明显抑制作用[2],人乳腺癌MCF-7细胞提取的HS对C3H小鼠自发性乳腺癌同种移植瘤也具有明显抑制作用[3],提示HS很可能是细胞自身合成、分泌,并用来调节自身增殖活动的内源性物质。Schmidt等[4]研究进一步证实HS中能抑制血管内皮细胞增殖活动的活性中心为富硫酸区的约8~12个糖。HS的抗增殖活性提示体内可能存在有一个内源性抗细胞增殖活动的物质,且该物质很可能具有抗肿瘤细胞恶性增殖的作用。可惜的是HS的内源性合成和合成后的化学性修饰是一个连续的、有序地、精密调节的和低产率的过程,很难获得足量这一内源性的HS来进行抗肿瘤细胞增殖的研究。UFH与HS一样具有同样的糖醛酸-氨基葡萄糖重复二糖架构,同属于糖胺聚糖(GAG)家族[5]。与HS相比,UFH的[葡萄糖醛酸(GlcA)-N乙酰氨基葡萄糖(GlcNAc)]n聚合链的修饰较分散,UFH聚糖链含有较少的GlcNAc。UFH的GlcNS/GlcNAc大于4:1(HS的该比值约为1:1)。UFH的硫酸根量远较HS多,HS每个双糖的硫酸根的含量变化在0.2~0.7之间,而UFH平均每个双糖的硫酸根(包括N-位,O-位硫酸根)量高达2.4个。此外,同时含有GlcNAc和GlcNS的能与抗凝血酶结合的戊糖结构就位于相当于HS的NA/NS混合区中。UFH的抗肿瘤作用、延长肿瘤患者生存期的作用已为许多研究所证实[6-7]。但很显然UFH强大的抗凝血作用则成了肝素用于抗肿瘤不可跨越的鸿沟。LMWH*虽然改变了UFH的给药途经,方便了临床给药,但其仍具有的抗凝血活性和低抗肿瘤活性限制了临床抗肿瘤的应用。近年来以类肝素多糖化合物作为先导,对其结构进行改造,以改变其生物活性的研究越来越受到关注。Roy等[8]用选择性化学降解法降解UFH,获得不同分子量的LMWH,体内外检查这些修饰物的生物活性发现化学性修饰可降低所获LMWH的抗凝血活性,改变LMWH与生长因子的亲和力,抑制P-选择素/ P选择素糖蛋白配基1的相互作用,表现出对小鼠实验性黑色素瘤转移模型的抗瘤作用。Garg等[9]对低抗凝血活性LMWH进行丁酰化修饰,发现丁酰化低抗凝血活性LMWH体外可以显著抑制牛肺动脉平滑肌细胞的增殖,100 mg/kg给药时可以显著抑制小鼠移植瘤的增长。但是这类低分子肝素酰化物是在小分子催化剂DMAP存在下的对肝素糖链上的羟基进行的酰化反应,选择性差,反应条件控制困难,得到的酰化产物活性不稳定,且需要大剂量给药,至今尚未进入临床研究。我们采用氧化还原方法将UFH降解成低抗凝血性LMWH,用大位阻DCC和DMAP为催化剂,对LMWH糖链上艾杜糖醛酸的羟基选择性进行乙酰化,同时对6位羧基进行酰基脲修饰,得到选择性修饰的低抗凝性ALMWH。通过对MDA-MB-231和MCF-7人乳腺癌细胞系进行的抗增殖和抗侵袭作用活性检测证明该修饰方法可提高LMWH的抗肿瘤活性,降低其抗凝活性。
1 材料与方法 1.1 材料 1.1.1 细胞株人乳腺癌细胞株MDA-MB-231、MCF-7均购自ATCC(Manassas, VA),蚌埠医学院生化药理研究室冻存培养。实验动物昆明种小白鼠,体质量19~22 g,蚌埠医学院动物房提供(动物合格证:0023430)。
1.1.2 主要试剂MEM培养基、胰蛋白酶、HEPES购于Gibco公司,青链霉素、庆大霉素为市售。胎牛血清购于杭州四季青公司。人工重建基底膜材料Matrigel购于Sigma公司。Transwell小室(24孔,0.8 mm)购于Corning公司。LMWH*、UFH均为市售。LMWH(Mw: 5683 g/mol)、ALMWH(Mw: 7707 g/mol)安徽省生化药物工程技术研究中心自制,专利号:201210574597.1。
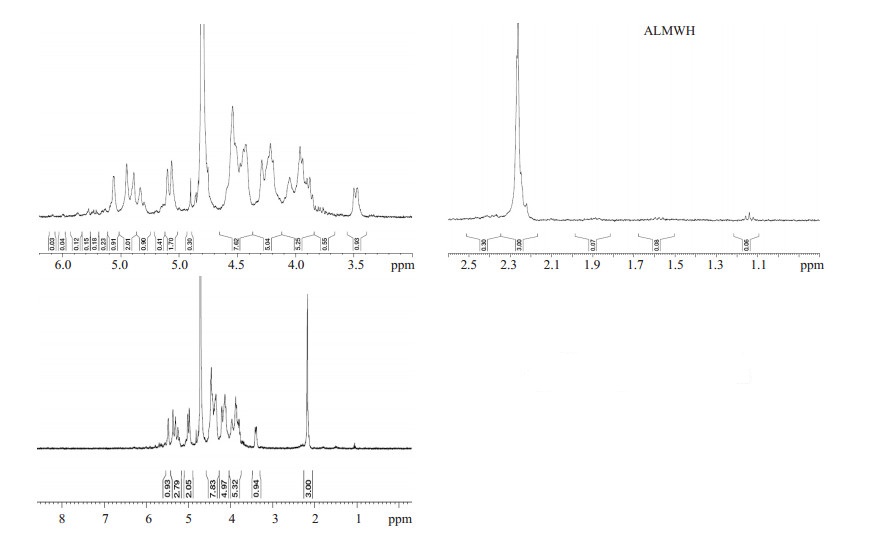
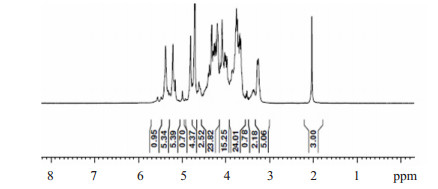
1.2 方法 1.2.1 氧化还原法制备LMWH参照文献[9]方法,普通肝素钠经高碘酸钠氧化,硼氢化钠还原,制得低抗凝血性的低分子肝素。将肝素钠(20 g,1.67 mmol)溶于175 ml去离子水,用1 N HCl将溶液pH调整为5,加入NaIO4(15 g,70 mmol),将溶液调整为500 ml,用1 N HCl调整溶液pH至5。于4 ℃反应24 h。透析,得透析液1.5 L,加10 N NaOH水溶液32 ml,室温下于暗处反应3 h。然后加NaBH4(1 g,26 mmol)于室温下反应4 h后,用37% HCl将溶液pH调整为4并反应15 min。用1 N NaOH将溶液中和至pH 7.0。加2.54 L乙醇。静止3 h,析出沉淀,用乙醇重新精制,减压干燥得LMWH,9.8 g收率49%。LMWH氢谱检测结果见图 4。2 ppm是氨基葡萄糖N位乙酰基上氢质子的吸收峰,3.2、3.3、3.7、3.8、4.0 ppm处是氨基葡萄糖环上氢质子的吸收峰,4.1、4.2、4.3、4.75 ppm处是艾杜醛酸上氢质子的吸收峰,5.2 ppm处是艾杜醛酸1位碳上氢质子的吸收峰。5.4、5.58 ppm处是氨基葡萄糖1位碳上氢质子的吸收峰。
1HNMR(400 MHz,D2O) δ:2(N-AC),3.2(GlcNS6X,H-2;X:S or H),3.3(GlcNS3S6S,H-2),3.7(GlcNS6S,H-3),3.8(GlcNS6S,H-4),4.0(GlcNS6S,H-5),4.1(IdoA2S,H-4),4.2(IdoA2S,H-3),4.3(IdoA2S,H-2),4.75(IdoA2S,H-5),5.2(IdoA2S,H-1),5.4(GlcNS6S,H-1),5.58(GlcNS3S6S,H-1)。
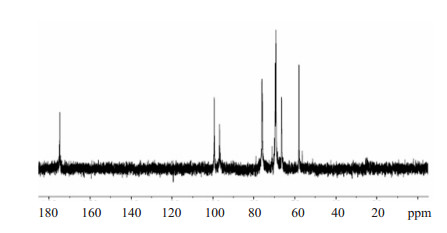
1.2.2 乙酰化低分子肝素ALMWH的制备参照文献[9]方法,将上述LMWH 10 g溶于水(50 ml),过离子交换柱,用胺将其中和,减压蒸馏干燥得13 g肝素盐。将其复溶于DMF 110 ml,加入DCC 0.7 g(3.39 mmol)、DMAP 0.1 g(0.82 mmol)和乙酸酐(0.1 ml),于室温下反应10 h,加5% NaOH水溶液230 ml于室温下水解48 h。加盐酸将其中和,加95%乙醇5 L,肝素钠析出,用无水乙醇精制,得ALMWH 4 g,收率40%。ALMWH氢谱检测结果见图 3。2.25 ppm是氨基葡萄糖N位乙酰基上氢质子的吸收峰,3.45、3.5、3.95、4.05、4.2 ppm处是氨基葡萄糖环上氢质子的吸收峰,4.3、4.4、4.55、5.05 ppm处是艾杜醛酸上氢质子的吸收峰,5.3、5.35、5.4是艾杜醛酸1位碳上氢质子的吸收峰,5.55、5.8 ppm处是氨基葡萄糖1位碳上氢质子的吸收峰。0.9~2.4 ppm区间的多个小的吸收峰为环己基脲环己基的吸收峰。6 ppm处为环己基脲上氢质子的吸收峰。ALMWH碳谱检测结果见图 5。
|
图 3 LMWH的1HNMR核磁图谱 Figure 3 1H-NMR spectrum of ALMWH. |
|
图 5 ALMWH的13CNMR核磁图谱 Figure 5 13C-NMR spectrum of ALMWH. |
1HNMR (400 MHz, D2O) δ:2.25 (NA),3.45 (GlcNS6X,H-2;X:S or H),3.5(GlcNS3S6S,H-2),3.95(GlcNS6S,H-3),4.05(GlcNS6S,H-4),4.2(GlcNS6S,H-5),4.3(IdoA2S,H-4),4.4(IdoA2S,H-3),4.55(IdoA2S,H-2),5.05(IdoA2S,H-5),5.3,5.35,5.4,5.45(IdoA2S,H-1),5.55(GlcNS6S,H-1),5.8(GlcNS3S6S,H-1) 1.15,1.55,1.9,3.5(cyclohexyl),6(CON-H)。
ALMWH的13CNMR检测结果见图 5。其中,174.74 ppm为羰基的吸收,100 ppm为艾杜醛酸一位碳质子的吸收,97 ppm为氨基葡萄糖一位碳的吸收峰。58~76.06 ppm为糖环上其他碳原子的混合吸收峰。
13CNMR(400 MHz,D2O)δ:175(C=O),100(IdoA C-1),97(Glc C-1’),76,70,66(C-2,C-3,C-5,C-4),58(C-6),23(N-AC)。
1.2.3 相对分子质量检测低分子肝素钠及其酰化物的相对分子量(Mw)用Waters SEC3010 Gel chromatography(GPC)凝胶色谱仪进行测定,以USP依诺肝素为标准品,流动相为0.2 mol/L NaSO4水溶液,样品浓度为10 mg/ml,流速0.5 ml/min。
1.2.4 核磁分析LMWH或ALMWH (10 mg)溶于0.5 ml氘代水(99.996%)减压干燥,如此重复3次。Varian Unity 400(400 MHz) NMR进行核磁分析,以氘代水为溶剂,在室温下进行测定。
1.2.5 小鼠全血凝固时间CT的测定按参考文献[10]方法,以生理盐水溶解LMWH*和ALMWH,配制成不同浓度的注射液。小鼠20只,随机分为2组,每组10只,雌雄各半。腹腔注射给药。40 min后,毛细血管在眼球后静脉丛取血。然后每隔30 s轻轻折断毛细管,至毛细管间出现血丝为止,记录血凝时间,并计算延长凝血时间1倍所需的药物浓度。
1.2.6 抗肿瘤细胞增殖活性测试按(3~7) ×104细胞/皿的密度接种人乳腺癌MDA-MB-231、MCF-7于改良的MEM培养基中(10%的灭活FCS,20 mmol/L Hepes,2.0 g/L碳酸氢钠,1×10 U/L青霉素,100 mg/L链霉素,l0 mg/L庆大霉素,0.33 mg/L胰岛素),37.0 ℃、95%空气、5% CO2温湿环境下培养。48 h后,吸弃培养液,用无FCS的MEM淋洗细胞2次,复换以低血清(0.1% FBS)培养液继续培养24 h。继之用0.1、0.3、0.9、2.7、8.1 mmol/L浓度的ALMWH和LMWH处理细胞,于药后48 h用胰酶释放游离细胞,分别收集、计数细胞数,绘制药物作用曲线,并计算半数抑制浓度(IC50)。增殖抑制率按下述公式计算:
| $ 抑制率 = \left( {1-\frac{{干预组细胞数}}{{对照组细胞数}}} \right) \times 100\% $ |
将Materigel胶与预冷的无血清MEM培养基按1:8的比例稀释,50 ml/孔均匀包被在Transwell小室底部膜的内表面,细胞培养箱内30 min使之成胶。用无血清MEM培养对数生长的肿瘤细胞24 h,释放、离心收集细胞,复用无血清MEM重悬计数。按细胞2×104/200 ml(含或不含药物细胞悬液) /室接种细胞于小室内。加700 ml的含5% FCS的MEM外室内,连续观察1 h,注意避免气泡产生。然后移入培养箱,于37 ℃、5% CO2、饱和湿度下培养48 h。取出小室,PBS清洗两次,90%乙醇固定10 min,用PBS湿润的棉签轻轻擦去小室表面未侵袭的细胞,1%结晶紫染液室温下染色10 min。PBS漂去多余染料,显微镜下每孔随机取5个视野拍照,计数并计算抑制率。
1.3 统计学方法数据以均数±标准差表示,采用SPSS13.0统计软件作Dunnett-t检验。
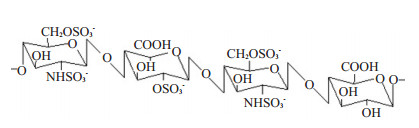
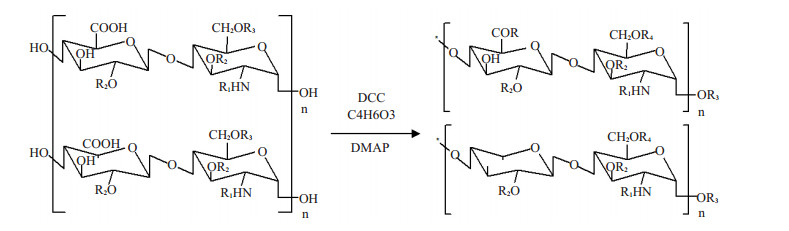
2 结果 2.1 ALMWH的制备UFH经高碘酸钠氧化,硼氢化钠还原,得到相对分子质量为5683 g/mol的低抗凝活性LMWH(图 1)。对该LMWH在DCC、DMAP催化下进行乙酰化(图 2),得到相对分子质量为7707 g/mol的低抗凝血性ALMWH。
|
图 1 低抗凝血性LMWH分子结构单元 Figure 1 Structural unit of the low anticoagulant LMWH. |
|
图 2 ALMWH的分子结构单元 Figure 2 Structural unit of the acetylated anticoagulant LMWH. R1: COCH3 or SO3-; R2: H or SO3-; R3: SO3- or H or COCH3; R4: COCH3 or SO3-; R: DCU; n: arbitrary integer from 2 to 16. |
ALMWH和LMWH的1HNMR检测结果图 3、4。ALMWH的0.9~2.4 ppm区间的多个小的吸收峰为二环己基脲(DCU)的环己基的吸收峰,3.47~5.56 ppm为糖环上氢质子的吸收峰,氨基葡萄糖N位乙酰基与艾杜醛酸乙酰基的混合吸收峰在2.24 ppm处。IdoA2S的异头质子在5.30 ppm处有4个分裂,提示艾杜醛酸六位羧基均被DCU修饰,肝素的羟基乙酰化也以艾杜醛酸上的羟基居多。6 ppm处为DCU氮上氢质子的吸收峰。LMWH的3.0~5.4 ppm为糖环上氢质子的吸收,氨基葡萄糖N位乙酰基氢质子出峰位置在2 ppm,IdoA2S的异头质子出峰位置在5.08 ppm。与LMWH相比,ALMWH的乙酰基的混合吸收峰积分面积明显增大,以糖环上氢质子积分面积为常数,ALMWH的乙酰基积分面积是LMWH的3.26倍。
|
图 4 LMWH的1HNMR核磁图谱 Figure 4 1H-NMR spectrum of LMWH. |
ALMWH的13CNMR检测结果见图 5。其中,174.74 ppm为羰基的吸收,100 ppm为艾杜醛酸一位碳质子的吸收,97 ppm为氨基葡萄糖一位碳的吸收峰。58~76.06 ppm为糖环上其他碳原子的混合吸收峰,未见有DCU单体的吸收峰出现,提示低分子肝素六位羧基以酰脲形式与DCU缩合。
市售LMWH、UFH经氧化、还原、降解所得低抗凝活性LMWH以及乙酰化修饰后所得的ALMWH的Mw、Mw/Mn列于表 1。
| 表 1 LMWH和ALMWH的相对分子质量 Table 1 Molecular weight of LMWH and ALMWH |
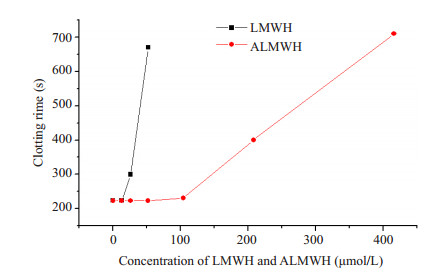
ALMWH和市售LMWH*对小鼠CT的影响实验结果见图 6。市售LMWH*和ALMWH均可浓度依赖性延长CT,但在低浓度给药剂量下,ALMWH的CT无明显增加,直至32 mg/kg时才出现CT的明显延长。计算结果证实,市售LMWH*使CT延长1倍的浓度为33.04 μmol·L-1,ALMWH使CT延长1倍的浓度为223.56 μmol·L-1。
|
图 6 市售LMWH*和ALMWH对小鼠CT的影响 Figure 6 Effects of ALMWH and commercial LMWH* on coagulation time in mice. |
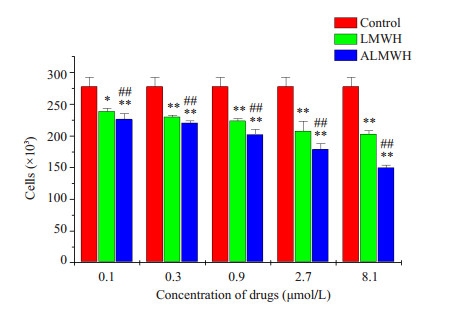
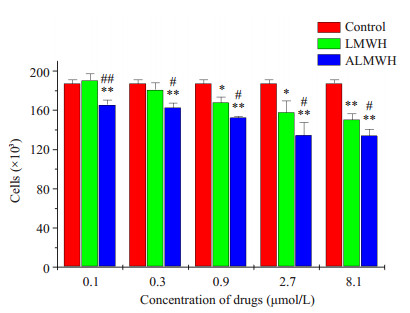
ALMWH和LMWH对MDA-MB-231和MCF-7两株人乳腺癌细胞表现出明显的增殖抑制效应,且这种抑制效应呈剂量依赖性(图 7、8)。与LMWH抗MDA-MB-231和MCF-7增殖效应比较,ALMWH表现出较强的增殖抑制作用,两者的抗人乳腺癌细胞增殖作用具有非常明显的差异。LMWH和ALMWH的半数抑制MCF-7增殖浓度(IC50)分别为3168.4 μmol·L-1和152.6 μmol·L-1,LMWH的IC50约为ALMWH的20倍。LMWH和ALMWH的半数抑制MDA-MB-231增殖的IC50分别为12299.6 μmol·L-1和22.2 μmol·L-1。LMWH的IC50较ALMWH的IC50提高了近560倍。
|
图 7 ALMWH和LMWH对人乳腺癌细胞MDA-MB-231增殖活动的影响 Figure 7 Effects of ALMWH and LMWH on the growth of MDA-MB-231 cells. The results were representative of 3 separate experiments (total n=9) and the error bars represent standard deviations. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs LMWH. |
|
图 8 ALMWH和LMWH对人乳腺癌细胞MCF-7增殖活动的影响 Figure 8 Effect of ALMWH and LMWH on the growth of MCF-7 cells. The results were representative of 3 separate experiments (total n=9) and the error bars represent standard deviations. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs LMWH. |
ALMWH和市售LMWH*抑制人乳腺癌MDA-MB-231细胞的侵袭实验结果见图 9。0.1、1、10 μmol·L-1的LMWH*和ALMWH分别处理MDA-MB-231细胞48 h后,将侵袭和迁移的细胞进行固定染色,分别于200×和400 ×显微镜下拍照并计数(表 2)。可见LMWH*和ALMWH对MDA-MB-231细胞的侵袭均有显著的抑制作用(P < 0.05),但未见二者在抑制MDA-MB-231细胞侵袭作用的明显差别。
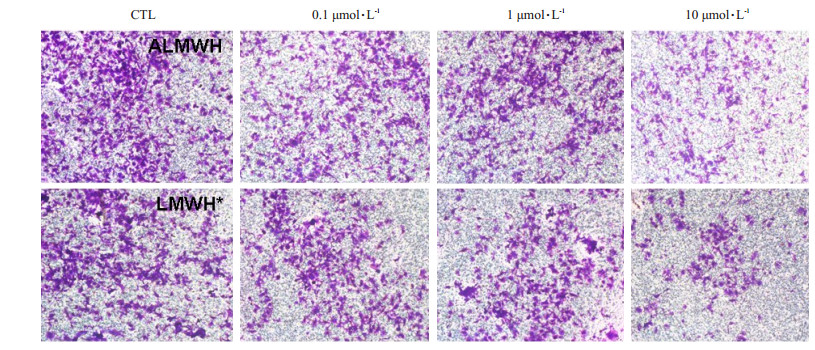
|
图 9 ALMWH和市售LMWH*对MDA-MB-231细胞侵袭活性的影响 Figure 9 Impacts of ALMWH and commercial LMWH* on invasion activity of MDA-MB-231 cells (1% crystal violet staining, original magnification: ×200). |
| 表 2 LMWH*和ALMWH对MDA-MB-231侵袭活性的抑制 Table 2 Inhibitory effect of commercial LMWH* and ALMWH on the invasion of MDA-MB-231 cells |
LMWH因具有抗肿瘤转移作用,延长癌症患者的生存时间、生物利用度高、可口服而广受关注。但较弱的抗肿瘤作用,需大剂量、长期用药所带来的出血和血小板减少的不良反应使其在临床的应用中备受限制。细胞汇合之后合成的HS的强大抗细胞增殖作用,以及UFH、LMWH具有同HS同样的重复二糖结构的研究成果激励着许多研究工作者着手通过对肝素的结构进行化学修饰来提高其抗肿瘤活性,降低其抗凝血活性。利用过碘酸氧化裂解肝素非硫酸化的艾杜糖醛酸可降低肝素的抗凝血活性[11]。过碘酸盐氧化是碳水化合物化学的经典反应。氧化断裂的C-C键要求两个碳原子必须被OH或氨基取代。因为类肝素的单糖均呈C1→C4连接,所以,过碘酸盐唯一能攻击的是C2-C3键。而类肝素所有的C2氨基均被乙酰化或硫酸化,所以GlcN是抗过碘酸的;C2被硫酸化的GLcA和IdoA也是抗过碘酸的。因此,只有非硫酸化的GlcA和IdoA的C2-C3才是过碘酸氧化的可能部位。而位于NA/NS混合区的、能与抗凝血酶特异性结合的特殊戊糖序列含有非硫酸化的GlcA和IdoA,成了过碘酸氧化断裂的靶结构[12]。故而过碘酸氧化可降低LMWH的抗凝血活性。对ALMWH的抗凝血活性检测的结果证明ALMWH延长小鼠CT 1倍的浓度为223.56 μmol·L-1,而LMWH*延长小鼠CT 1倍的浓度为33.04 μmol·L-1。化学修饰的ALMWH将小鼠CT延长1倍的所需药物浓度提高到LMWH*的6倍之多,再次验证了过碘酸氧化修饰能降低LMWH的抗凝血活性。过碘酸氧化可致肝素线性糖链中所有的非硫酸化糖醛酸的C2-C3键断裂,却很少涉及到糖苷键,故裂解后的UFH分子量保持不变或稍降。再配合以硼氢化钠还原,NaOH水解,可将UFH降解成低抗凝血性两端为羟基的LMWH,其相对分子质量为5683 g/mol。
LMWH抗癌作用涉及到对组织因子、肝素酶、趋化因子、基质蛋白、细胞间相互作用、血管生成以及免疫学反应等多重环节[13],然而,以抗转移为其主要作用的LMWH具有较弱的抗肿瘤活性是一个不争的事实。鉴于UFH与内源性细胞增殖活动调节物质HS具有相同的重复二糖结构这一事实,很多研究者把注意力聚焦在对UFH抗癌活性中心的筛选确认和化学改造上。Roy等系统地筛选了部分脱硫酸化LMWH的生物活性,并开展了结构与活性关系的研究。研究结果提示对UFH某些特殊二糖序列进行修饰可对UFH复杂的生物活性产生重要的影响[8]。Yu [14]对LMWH进行O-位丁酰化,提高了LMWH的体外抗癌活性,但体内抗癌剂量需用至10~100 mg/kg。尽管该实验证明丁酰化肝素的抗凝血活性很低,且对心、肝、肾、肺无毒性,但如此大的剂量仍让临床望而却步。同一实验室的Garg等[9]用4-,6-,8-,10-,12-,18-个碳酸酐对LMWH进行O-位酰化,并测试了这些酰化物对牛肺动脉平滑肌细胞增殖的抑制活性和对FGF1、FGF2与表面固定肝素结合能力的影响。可惜的是并未进行O-丁酰化低分子肝素对肿瘤细胞增殖活性以及侵袭活性的测试。我们对UFH进行了化学降解,获得相对分子质量为5683 g/mol的低抗凝活性LMWH,在此基础上对该低抗凝活性LMWH进行乙酰化得到相对分子质量为7707 g/mol的低抗凝血性选择性修饰的ALMWH。通过对人乳腺癌细胞MDAMB-231和MCF-7的抗增殖活性检测,发现LMWH和ALMWH均表现出明显的抗肿瘤细胞增殖作用,但二者的抗增殖活性有显著的差别。LMWH抑制MCF-7和MDA-MB-231人乳腺癌细胞增殖的IC50分别是3168.4 μmol·L-1和12299.6 μmol·L-1,ALMWH抑制MCF-7和MDA-MB-231人乳腺癌细胞增殖的IC50分别是152.6 μmol·L-1和22.2 μmol·L-1。LMWH抑制MCF-7和MDA + MB-231细胞增殖的IC50分别是ALMWH的20和560倍。MCF-7和MDA-MB-231两种人乳腺癌细胞对LMWH和ALMWH所表现的不同敏感性的原因尚需探讨,可能是两种肿瘤细胞所具有的不同的生物学行为所致。虽然MCF-7和MDA-MB-231两种肿瘤细胞同是从乳腺癌患者的胸水分离而出的人乳腺上皮癌细胞株[15-16],但前者具有上皮细胞表型化特征,后者则呈纤维细胞型;前者分化程度高,后者则分化程度差;前者不具有浸润性,而后者表现出很强的浸润性;前者拥有完整的雌激素、孕激素受体,且呈激素依赖性[17],后者则否;前者对EGF、FGF2的刺激表现出强大的增殖反应,后者与FGF2结合能力较前者为高,但不表现任何的增殖反应[18]。抑制MDA-MB-231细胞侵袭活性的检测结果再次证明了LMWH*和ALMWH均可有效地抑制肿瘤的转移侵袭活性。
| [1] | Rabenstein DL. Heparan and heparan sulfate:structure and function[J]. Nat Prod Rep,2002, 19 (3) : 312-31. DOI: 10.1039/b100916h. |
| [2] | 蒋志文, Le BourhisX, HondermarckH, 等. 肿瘤细胞的进行性增殖和Bip/GRP78的合成[J]. 中国药理学通报,2002, 18 (1) : 79-83. |
| [3] | 刘浩, 蒋志文, 童旭辉, 等. 硫酸乙酰肝素蛋白聚糖对C3H小鼠乳腺癌移植瘤的抑制作用及其机制[J]. 中国药理学通报,2008, 24 (6) : 744-8. |
| [4] | Schmidt A, Yoshida K, Buddecke E, et al. The antiproliferative activity of arterial heparan sulfate resides in domains enriched with2-O-Sulfated uronic acid residues[J]. J Biol Chem,1992, 267 (27) : 19242-7. |
| [5] | Rabenstein DL. 肝素和硫酸乙酰肝素的三维结构[J]. 食品与药,2012, 14 (9) : 3-4. |
| [6] | Niers TM, Klerk CP, DiNisio M, et al. Mechanisms of heparin induced anticancer activity in experimental cancer models[J]. Crit Rev Oncol Hematol,2007, 61 (3) : 195-207. DOI: 10.1016/j.critrevonc.2006.07.007. |
| [7] | Hoppensteadt D, Walenga JM, Fareed J, et al. Heparin, low molecular weight heparins, and heparin pentasaccharide basic and clinical differentiation[J]. Hematol Oncol Clin North Am,2003, 17 (1) : 313-41. DOI: 10.1016/S0889-8588(02)00091-6. |
| [8] | Roy S, Lai H, Zouaoui R, et al. Bioactivity screening of partially desulfated low-molecular-weight heparins:a structure/activity relationship study[J]. Glycobiology,2011, 21 (9) : 1194-205. DOI: 10.1093/glycob/cwr053. |
| [9] | Garg HG, Mrabat H, Yu L, et al. Anti-proliferative effects of Oacyl-low-molecular-weight heparin derivatives on bovine pulmonary artery smooth muscle cells[J]. Glycoconj J,2011, 28 (6) : 419-26. DOI: 10.1007/s10719-011-9341-6. |
| [10] | Chu V, Brown K, Colussi D, et al. In vitro characterization of a novel factor Xa inhibitor, RPR130737[J]. Thromb Res,2000, 99 (1) : 71-82. DOI: 10.1016/S0049-3848(00)00227-9. |
| [11] | Ono K, Ishihara M, Ishikawa K, et al. Periodate-treated, nonanticoagulant heparin-carrying polystyrene (NAC-HCPS) affects angiogenesis and inhibits subcutaneous induced tumour growth and metastasis to the lung[J]. Br J Cancer,2002, 86 (11) : 1803-12. DOI: 10.1038/sj.bjc.6600307. |
| [12] | Garg HG, Linhardt RJ, Hales CA.Chemistry and biology of hepain and heparin sulfate[M].Elsevier Ltd, 2005:461-81. |
| [13] | Bochenek J, Püsküllüoǧlu M, Krzemieniecki K, et al. The antineoplastic effect of low-molecular-weight heparins-a literature review[J]. Contemp Oncol (Pozn),2013, 17 (1) : 6-13. |
| [14] | Yu L, Garg HG, Li B, et al. Antitumor effect of butanoylated heparin with low anticoagulant activity on lung cancer growth in mice and rats[J]. Curr Cancer Drug Targets,2010, 10 (2) : 229-41. DOI: 10.2174/156800910791054176. |
| [15] | Pihie AH, Stanslas J, Din LB, et al. Non-steroid receptor-mediated antiproliferative activity of styrylpyrone derivative in human breast cancer cell lines[J]. Anticancer Res,1998, 18 (3A) : 1739-43. |
| [16] | Soule HD, Vazguez J, Long A, et al. A Human cell line from a pleural effusion derived from a breast carcinoma[J]. J Natl Cancer Inst,1973, 51 (5) : 1409-16. |
| [17] | Nohara K, Wang F, Spiegel S. Glycosphingolipid composition of MDAMB-231and MCF-7human breast cancer cell lines[J]. Breast Cancer Res Treat,1998, 48 (2) : 149-57. DOI: 10.1023/A:1005986606010. |
| [18] | Delehedde M, Deudon E, Boilly B, et al. Heparan sulfate proteoglycans play a dual role in regulating fibroblast growth factor-2mitogenic activity in human breast cancer cells[J]. Exp Cell Res,1996, 229 (2) : 398-406. DOI: 10.1006/excr.1996.0385. |
 2015, Vol. 35
2015, Vol. 35
