2. 成都医学院公共卫生系,四川 成都 610500 ;
3. 食品安全监测与风险评估四川省重点实验室,四川 成都 610041
2. Department of Public Health, Chengdu Medical College, Chengdu 610500, China ;
3. Key Laboratory of Food Safety Monitoring and Risk Assessment of Sichuan Province, Chengdu 610041, China
常见产毒性真菌,如曲霉属(Aspergillus)、青霉属(Penicillium)和镰刀菌属(Fusarium),可在适当条件下繁殖并产生有毒次级代谢产物真菌毒素,这些毒素已发现400多种,可致急、慢性中毒并存在“三致”(致癌、致畸、致突变)危害[1]。我国辣椒等香辛料受真菌及其毒素的污染情况严重,辣椒中真菌污染量可达103~106 CFU/g,其优势菌主要为曲霉属、青霉属和镰刀菌属真菌[2-5],产生的真菌毒素如黄曲霉毒素(aflatoxin, AF)、赭曲霉毒素A (ochratoxin A, OTA)和伏马菌素(fumonisin, FB)等在香辛料中普遍存在,须对其进行及时的预防和控制,许多国家及国际组织为此制定了真菌毒素的限量标准[6-7]。然而,对于真菌毒素危害的预防不能仅针对真菌毒素本身,对于产毒性真菌的监测也同样重要。传统真菌定量检测方法为计数培养法[8],产毒性真菌鉴定则需要进行分离镜检[9],操作繁琐费时且依赖经验,培养鉴定时间长达7~14 d,存在严重滞后性,无法对污染进行及时预警,因此迫切需要建立产毒性真菌快速定量检测的方法。裸磁珠(non-modified magnetic beads, NMB)具有在磁场中非特异性富集的特性,目前利用裸磁珠对细菌进行富集的研究已有不少[10-12],但针对真菌进行富集的研究仍未见报道。因此本研究拟将裸磁珠与多重实时荧光定量PCR (multiple qPCR)技术联用,利用裸磁珠富集能力提高方法检出限,建立辣椒中常见三类产毒性真菌裸磁珠-多重实时荧光定量PCR (NMB-Multiple qPCR)的快速检测方法,为辣椒等香辛料中常见产毒性真菌污染的监测提供更为高效的技术方法。
1 材料与方法 1.1 菌株与培养基本研究所使用标准菌株由广东环凯生物技术有限公司、中国普通微生物保藏中心提供及四川大学华西公共卫生学院卫生检验与检疫学系保存,食品分离菌株由本研究前期调查获得(表 1),所用察氏、沙氏琼脂、LB及麦康凯培养基购自北京陆桥技术有限责任公司。
| 表 1 研究所用菌株 Table 1 Strains used in this study |
样品辣椒粉购自成都市区农贸市场,真菌基因组DNA提取试剂盒购自BioFlux公司,10 × Reaction Buffer、Taq DNA polymerase及pGM-T载体试剂盒购自TIANGEN公司,dNTPs购自Roche公司,引物由Invitrogen公司合成,TaqMan探针由上海生工公司合成,PCR扩增仪为S1000 Thermal Cycler (Bio-Rad)。
1.3 方法 1.3.1 孢子悬液及样品悬液的制备以无菌生理盐水冲洗察氏斜面中菌苔后,转移孢子悬液至无菌试管中充分振荡,用血细胞计数板计数[13]并用生理盐水调节所需孢子悬液浓度。
称取灭菌辣椒粉25 g,加入225 ml无菌生理盐水中均质2 min,制备为辣椒均质液[8]。取1ml孢子悬液加入9 ml上述均质液,混匀后制备为模拟样品悬液。
1.3.2 裸磁珠的吸附及真菌模板的提取基于前期自制裸磁珠吸附细菌的研究基础[14],利用化学沉降法制备所需的裸磁珠[15]。将50 μl浓度为100 μg/μl裸磁珠加入1 ml悬液中,在室温下缓慢振荡吸附1 min。用磁分离架分离弃上清后,按真菌DNA提取试剂盒相关说明操作。提取的模板于-20 ℃保存备用。非磁珠吸附法提取的模板仅取1 ml悬液按试剂盒相关说明操作。
1.3.3 引物和探针序列查阅相关文献后,根据三类常见产毒性真菌rDNA基因的内转录间隔区(Internal Transcribed Spacer, ITS)序列,选择1对真菌广谱引物(ITSF和ITSR)以及3条属特异性TaqMan探针(曲霉属探针ASPP,青霉属探针PENP,镰刀菌属探针FUSP)[16]进行扩增(表 2)。
| 表 2 引物及探针 Table 2 Primers and probes used in this study |
建立并优化如下扩增反应体系:10×Buffer 4.0 μl、dNTP (10 mmol/L)0.4 μl、Mg2+ (25 mmol/L)2.4 μl、引物及探针(10 μmol/L)各0.8 μl、Taq DNA聚合酶(2.5 U/μl)0.8 μl、模板1.0 μl、ddH2O 7.4 μl,共20 μl;反应参数为:95 ℃,5 min;95 ℃,30 s;65 ℃,1 min,共50个循环,退火阶段采集荧光信号。
1.3.5 NMB-Multiple qPCR检出限及线性范围的评价以pGM-T载体试剂盒说明制备重组质粒,分别提取鉴定后曲霉属、青霉属、镰刀菌属三种重组质粒的模板进行107-100 copies/反应的梯度稀释,测定Multiple qPCR检测三类真菌重组质粒模板的检出限并绘制标准曲线。
分别制备含曲霉属、青霉属、镰刀菌属孢子的模拟样品悬液以磁珠吸附法提取模板,并10倍系列稀释,测定NMB-Multiple qPCR检测三类产毒性真菌模板检出限并绘制标准曲线。以非磁珠法取的模板做为对照评价磁珠富集效果。模板的准确浓度以标准培养计数法确定。
1.3.6 NMB-Multiple qPCR特异性评价提取表 1-1中所列全部菌株模板,进行Multiple qPCR扩增,评价方法的特异性。
1.3.7 NMB-Multiple qPCR重复性评价根据检出限及线性范围检测结果,对曲霉属、青霉属和镰刀菌属孢子悬液高中低3个浓度的模板分别进行3次重复测定,评价方法的重复性。
1.3.8 NMB-Multiple qPCR与标准培养法一致性评价制备浓度为107 CFU/ml曲霉属、青霉属、镰刀菌属孢子悬液并进行混合,将该混合悬液适当稀释加入6份无菌辣椒均质液中,随机制备成含一定浓度孢子悬液的盲样。每一个模拟样品同时进行NMB-Multiple qPCR与标准培养计数法检测,比较两者结果,评价方法一致性。NMB-Multiple qPCR检测结果分别根据标准质粒以及模拟样品的标准曲线进行定量分析。
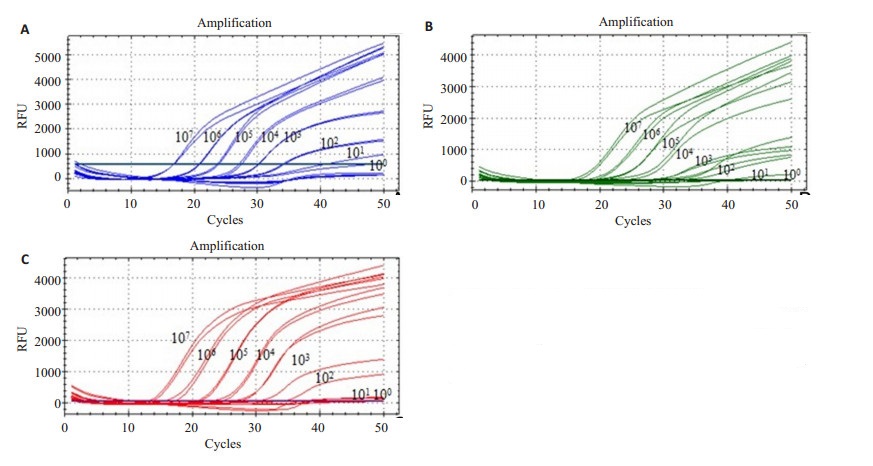
2 结果 2.1 NMB-Multiple qPCR检出限与线性范围的评价对鉴定后的曲霉属、青霉属、镰刀菌属三种重组质粒梯度模板进行Multiple qPCR扩增,Ct值≤35为阳性。结果显示,对于曲霉、青霉和镰刀菌其检出限分别为1.02×102 copies/反应,1.04×102 copies/反应和1.05× 102 copies/反应(图 1)。重组质粒的回归方程分别为:
|
图 1 Multiple qPCR检测曲霉属(A)青霉属(B)镰刀菌属(C)重组质粒的灵敏度(100~107copies/反应) Figure 1 Sensitivity analysis of multiple qPCR amplification for recombinant plasmids of Aspergillus (A), Penicillium (B) and Fusarium (C). |
曲霉属:Y=-3.264 lg (X)+38.920,R2=0.990(1.02× 102~1.02×107 copies/反应)
青霉属:Y=-3.602 lg (X)+41.870,R2=0.992(1.04× 102~1.04×107 copies/反应)
镰刀菌属:Y=-3.484 lg (X) + 41.150,R2=0.995 (1.05×102~1.05×107 copies/反应)
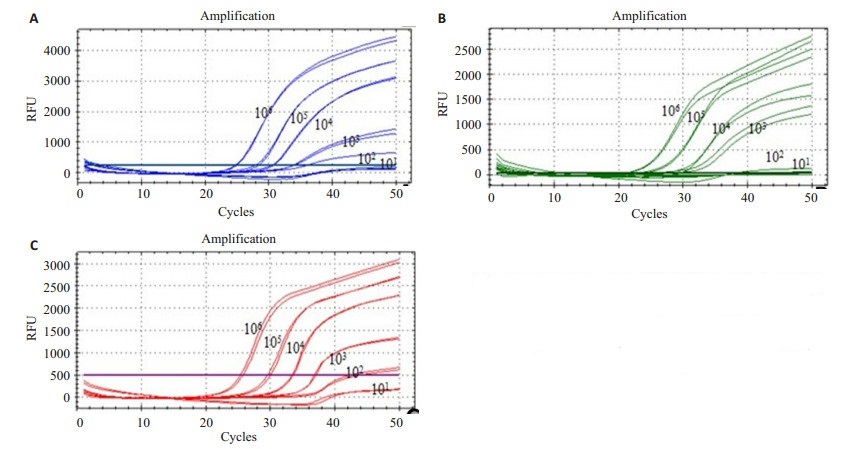
对模拟曲霉属、青霉属、镰刀菌属污染的辣椒样品,进行NMB-Multiple qPCR扩增,Ct值≤35为阳性。结果显示,对于3类产毒性真菌其检出限分别为曲霉属1.8×103 CFU/ml,青霉属1.6×103 CFU/ ml和镰刀菌1.4×103 CFU/ml,见图 2。模拟样品的回归方程分别为:
|
图 2 NMB-Multiple qPCR检测模拟曲霉属(A)、青霉属(B)、镰刀菌属(C)真菌污染样品灵敏度(101~106 CFU/ml) Figure 2 Sensitivity analysis of non-modified magnetic beads-multiple qPCR for Aspergillus (A), Penicillium (B) and Fusarium (C) in simulation samples. |
曲霉属:Y=-3.324 lg (X)+47.102,R2=0.972(1.8×103~1.8× 106 CFU/ml)
青霉属:Y=-3.402 lg (X)+47.607,R2=0.995(1.6×103~1.6× 106CFU/ml)
镰刀菌属:Y=-3.496 lg (X)+48.519,R2=0.999(1.4×103~1.4× 106 CFU/ml)
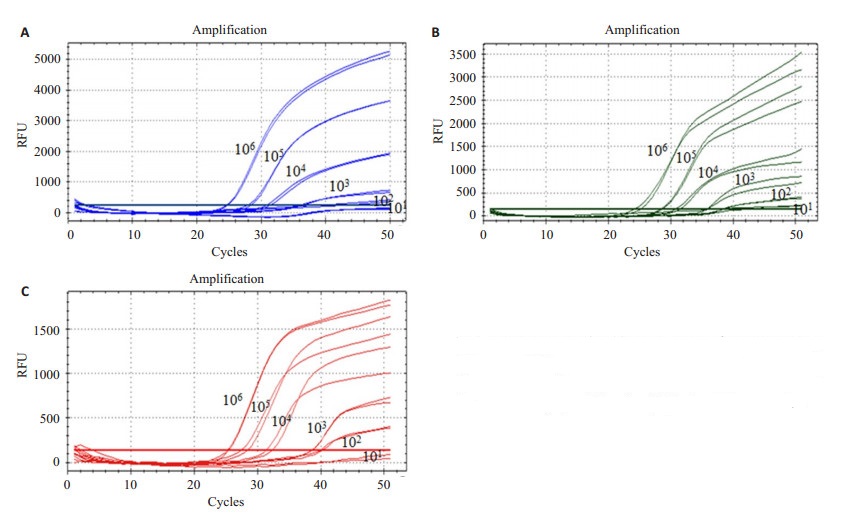
对非磁珠法提取的模拟污染样品模板进行multiple qPCR扩增,Ct值≤35为阳性。结果显示,对于3类产毒性真菌其检出限分别为曲霉属1.4×104 CFU/ml,青霉属1.1×104 CFU/ ml和镰刀菌属1.6×104 CFU/ml,检出限仅为NMB-Multiple qPCR方法的1/10,说明裸磁珠对于悬液中的真菌具有富集作用,能提高Multiple qPCR方法检测灵敏度(图 3)。
|
图 3 Multiple qPCR检测模拟曲霉属(A)、青霉属(B)、镰刀菌属(C)真菌污染样品灵敏度(101~106 CFU/ml) Figure 3 Sensitivity analysis of multiple qPCR for Aspergillus (A), Penicillium (B) and Fusarium (C) in simulation samples. |
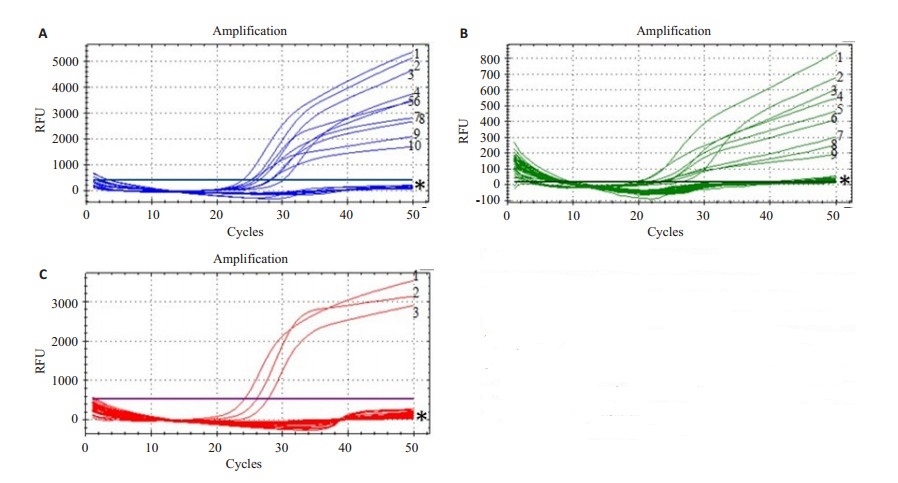
根据表 1-1中的菌株信息,对6种细菌27种真菌进行多重实时荧光扩增,Ct值≤35为阳性。结果显示,所选引物、曲霉属探针ASPP、青霉属探针PENP及镰刀菌属探针FUSP特异性良好,与非目标菌不存在交叉反应(图 4)。
|
图 4 NMB-Multiple qPCR特异性分析 Figure 4 Specificity analysis of non-modified magnetic beadsmultiple QPCR. (A) Aspergillus: 1 A. niger, 2 A. flavus, 3 A. parasiticus, 4 A. versicolor, 5 A. fumigatus, 6 A. albicans, 7 A.oryzae, 8 A. clavatus, 9 A. ochraceus, 10 A. nidulans, *Nontarget organism and Negtive control; (B) Penicillium: 1 P. funiculosum, 2 P. viridicatum, 3 P. citrinum, 4 P. roqueforti, 5 P. islandicum, 6 P. simplicissimum, 7 P. pinophilum, 8 P. resedanum, 9 Penicillium sp., *Nontarget organism and Negtive control; (C) Fusarium: 1 F. moniliforme, 2 F. tricinctum, 3 Fusarium sp., *Nontarget organism and Negtive control. |
根据方法检出限的检测结果,分别对不同浓度(103、104、106 CFU/ml)的曲霉、青霉和镰刀菌的孢子悬液模板进行3次重复测定。结果显示:3种真菌不同浓度模板NMB-Multiple qPCR检测的变异系数均小于1.5%,在允许误差范围内。说明该方法对高、中、低不同浓度的模板均具有较好的重复性(表 3)。
| 表 3 NMB-Multiple qPCR重复性评价 Table 3 Reproducibility analysis for non-modified magnetic beadsmultiple-qPCR |
对三类产毒真菌混合污染的6份模拟辣椒样品同时进行NMB-Multiple qPCR以及标准培养计数法的检测。
将标准培养计数法的结果与NMB-Multiple qPCR标准曲线获得的计数结果进行log变换后,用配对t检验进行比较,结果显示对于三种菌属的计数结果,两种方法的检测结果均无统计学差异(曲霉属t=-0.193,P>0.05;青霉属t=2.315,P>0.05;镰刀菌属t=-0.387,P>0.05)。
3 讨论建立常见产毒真菌的快速定量检测方法,可为产毒真菌的有效监测提供技术手段,利于从源头上预防和控制真菌毒素的危害。目前产毒真菌快速检测主要应用基于PCR的检测技术[16-19],但大多研究仅针对某些特定产毒真菌,对常见多种产毒真菌同时进行快速检测的研究却不多。Suanthie等[11]报道了针对曲霉属、青霉属和镰刀菌属的multiple qPCR,并成功应用于玉米发酵液中,但该方法能否应用于辣椒等香辛料的固体样品仍然未知。另一方面,PCR技术检测真菌的灵敏度还有待进一步提高,在Suanthie等的研究中,样品中的真菌检出限仅为106 CFU/g,而其他学者报道真菌纯培养物的检出限也仅为103~104 CFU/反应。针对这一问题,本研究利用裸磁珠对悬液中真菌的富集及对multiple qPCR反应体系的优化实现了方法灵敏度的提高,检出限可达103 CFU/ml,即104 CFU/g辣椒样品(国家农业部无公害香辛料霉菌总数的限量标准为104 CFU/g[20]),因此该方法可应用于香辛料中产毒性真菌的快速检测并及时指示污染。同时该方法特异性和重复性良好,检测结果与标准培养计数法相比无统计学差异,无需纯培养,全程7 h内即可获得结果,大大缩短了检测时间。
此外由于仪器限制,本研究中所选探针报告基团为FAM、HEX和Cy5,但研究中发现,HEX基团的荧光信号会受到另外两种基团的干扰,当使用三种探针进行多重实时荧光PCR检测时,HEX基团的RFU值可由4000降低至1000左右,但并不影响检出限。此外,在本研究中曲霉属探针检出了棒曲霉和烟曲霉,与原文献报道不符,以上问题将在日后研究中进一步验证。
本文首次将裸磁珠技术应用于真菌的分离富集并与多重实时荧光定量PCR联用,建立了对曲霉属、青霉属以及镰刀菌属三类常见产毒真菌进行定量检测的裸磁珠-多重实时荧光定量PCR方法,并成功应用于辣椒模拟样品,检出限可达104 CFU/g,可望用于香辛料中常见产毒性真菌的监测,具有潜在应用价值。
| [1] | Renard A, Gómez DP, Egea-Cortines M, et al. Application of whole genome amplification and quantitative PCR for detection and quantification of spoilage yeasts in orange juice[J]. Int J Food Microbiol,2008, 126 (1) : 195-201. |
| [2] | 樊竹青, 查卫华, 谢维, 等. 思茅农贸市场干花椒, 干辣椒中青霉, 曲霉含量的调查[J]. 思茅师范高等专科学校学报,2002, 18 (3) : 64-6. |
| [3] | 张加春, 王权飞, 张灼. 昆明市售辣椒面中真菌污染调查[J]. 菌物系统,1998, 17 (3) : 284-5. |
| [4] | 刘蓉, 徐池. 三种辛辣调料真菌菌种分析[J]. 四川省卫生管理干部学院学报,1998, 17 (1) : 1-2. |
| [5] | 张文华, 张国辉, 杨秀丽, 等. 贵州糊辣椒真菌分离鉴定与污染状况初步分析[J]. 中国调味品,2014, 39 (4) : 85-8. |
| [6] | 李新颖, 石英. 国际香辛料真菌毒素限量标准研究现状[J]. 中国调味品,2006, 12 : 9-16. |
| [7] | 施敬文, 韩伟, 顾鸣. 香辛料中多种生物毒素的污染状况调查[J]. 中国卫生检验杂志,2003, 13 (5) : 589-92. |
| [8] | 中华人民共和国卫生部.GB4789.15-2010, 食品卫生微生物学检验霉菌和酵母计数[S].北京:中国标准出版社, 2010. |
| [9] | 中华人民共和国卫生部.GB4789.16-2003, 食品卫生微生物学检验常见产毒霉菌的鉴定[S].北京:中国标准出版社, 2003. |
| [10] | 杨柳, 苏明权, 岳乔红, 等. 裸磁粒子对常见食源菌吸附效果的实验研究[J]. 实用预防医学,2009, 16 (5) : 1381-3. |
| [11] | 邱晋, 樊学军, 沈圣, 等. 自制裸磁珠对常见食源性致病菌吸附性能的研究[J]. 现代预防医学,2006, 33 (1) : 4-11. |
| [12] | 孙飞龙, 张周梅, 马军. Fe3O4纳米磁颗粒的制备及其对水中细菌富集的初步研究[J]. 化学与生物工程,2009, 26 (10) : 90-2. |
| [13] | 李爱华, 岳思君, 马海滨. 真菌孢子三种计数方法相关性的探讨[J]. 微生物学杂志,2006, 26 (2) : 107-10. |
| [14] | Zuo H, Xie Z, Ding X, et al. A novel magnetic capture-multiplex PCR assay for the simultaneous detection of three foodborne pathogens[J]. Quality Assurance Safety Crops Foods,2011, 3 (4) : 212-20. DOI: 10.1111/qas.2011.3.issue-4. |
| [15] | 漆红兰. 磁性微粒的制备方法和研究进展[J]. 生命的化学,2002, 22 (6) : 586-9. |
| [16] | Suanthie Y, Cousin MA, Woloshuk CP. Multiplex real-time PCR for detection and quantification of mycotoxigenic Aspergillu, Penicillium and Fusarium[J]. J Stored Prod Res,2009, 45 (2) : 139-45. DOI: 10.1016/j.jspr.2008.12.001. |
| [17] | Rodríguez A, Rodríguez M, Andrade MJ, et al. Development of a multiplex real-time PCR to quantify aflatoxin, ochratoxin A and patulin producing molds in foods[J]. Int J Food Microbiol,2012, 155 (1) : 10-8. |
| [18] | Mayer Z, Bagnara A, Färber P, et al. Quantification of the copy number of nor-1, a gene of the aflatoxin biosynthetic pathway by real-time PCR, and its correlation to the cfu of Aspergillus flavusin foods[J]. Int J Food Microbiol,2003, 82 (2) : 143-51. DOI: 10.1016/S0168-1605(02)00250-7. |
| [19] | Ben Amar A, Oueslati S, Ghorbel A, et al. Prediction and early detection of mycotoxigenic Fusarium culmorum in wheat by direct PCR-based procedure[J]. Food Control,2012, 23 (2) : 506-10. DOI: 10.1016/j.foodcont.2011.08.021. |
| [20] | 中华人民共和国农业部.NY5323-2006无公害食品香辛料[S].北京:中国标准出版社, 2006. |
 2015, Vol. 35
2015, Vol. 35
