2. 解放军总医院 基础研究所,北京 100853 ;
3. 吉林大学第一医院,麻醉科,吉林 长春 130021
2. Institute of Basic Medicine, Chinese PLA General Hospital, Beijing 100853, China ;
3. First Affiliated Hospital of Jilin University, Department of anesthesiology, Changchun 130021, China
在缺血性疾病中,缺氧的严重程度及时间长短是决定细胞死亡及组织病理变化的关键,有文献表明重复性低氧预处理(RHP)能减轻大鼠肾脏缺血再灌注损伤[1],也有研究证实肾缺血再灌注损伤同时常伴有肝脏功能受损[2],同样,研究发现在肝缺血再灌注损伤后可以发生严重的包括急性肾损伤在内的多器官功能障碍,其可能的发生机制与小肠隐窝内的Paneth细胞分泌的IL-17A有关[3-4]。本研究旨在探究RHP是否可以减轻大鼠肾脏缺血再灌注损伤后所导致的肝脏损伤,其可能机制是否与IL-17A相关?
1 材料与方法 1.1 实验动物分组健康清洁型成年雄性Sprague Dawley大鼠120只(解放军总医院实验动物中心提供,许可证号为SCXK(京)2012-0001),体质量220~240 g。适应环境1周,分笼饲养,室温20~25 ℃,湿度60%~70%,空气新鲜,通风良好,自由摄食、饮水。随机分为4组(n=30):低氧预处理手术组(RHP组),低氧预处理假手术组(RHPS组),常压手术组(IRI组),常压假手术组(S组)。RHP组及RHPS组适应环境后进行低压氧预处理,而IRI组及S组饲养于正常大气压下,预处理后RHP组及IRI组建立大鼠肾缺血再灌注模型,而RHPS组及S组不进行肾缺血再灌注处理。
1.2 重复性低压氧预处理方法及模型建立RHP组及RHPS组放入动物专用低压氧舱内进行为期5 d、5 h/d、0.66倍绝对大气压(ATA)的低氧预处理,IRI组及S组饲养于常温常压下。第6天参考文献[5]介绍的方法建立肾缺血再灌注损伤模型。RHP组及IRI组大鼠术前禁食12 h,自由饮水,大鼠称重后,3%戊巴比妥钠50 mg/kg腹腔注射麻醉,待翻正反射消失后,俯卧位于温度恒定于38 ℃的体温毯上,背侧入路,于肋弓下缘0.5 cm、脊柱旁开1 cm处做两侧纵形切口,分离肾蒂,游离输尿管,切除右侧肾脏,左侧肾蒂使用无损伤血管夹夹闭45 min。根据左肾颜色来判断缺血情况,确认其由鲜红转为整体肾脏暗红色时即可。45 min后松开血管夹进行再灌注,待肾脏由暗红色转为鲜红色,恢复血液供应后再将其还纳入腹腔并缝合伤口。S组及RHPS组仅切除右肾并分离左侧肾蒂,不进行钳夹处理。
1.3 ALT、IL-17A、TNF-α浓度测定于再灌注后2、8及24 h三个时间点每组各随机选取10只大鼠,经心脏取血5 ml后处死。血液样本置于4 ℃冰箱内静置30 min后,4 ℃、3000 r/min离心15 min,分离血清,置于-20 ℃冰箱。应用Beckman AU5400全自动生化分析仪检测血清谷丙转氨酶浓度。应用ELISA试剂盒,根据厂家说明书(达科为生物工程有限公司)检测IL-17A、TNF-α浓度。
1.4 超氧化物歧化酶(SOD)及一氧化氮(NO)含量测定收集肝左上叶,置入0.9%氯化钠盐水中清洗表面血液后置入液氮中冻存,使用时利用生理盐水制成10%组织匀浆,采用SOD及NO试剂盒(南京建成生物工程研究所),根据说明书方法测定肝脏组织SOD、NO含量。
1.5 肝脏组织形态观察收集肝左上叶,置入0.9%氯化钠盐水中清洗表面血液后置入4%多聚甲醛中固定12 h,石蜡包埋,切片,进行苏木精-伊红染色(HE染色),观察再灌注后3个时点各组肝脏形态学变化。
1.6 p-PI3K、p-Akt蛋白表达的检测常规提取肝脏蛋白质样品,BCA法定量。电泳转硝酸纤维素膜上,分别将两个单克隆抗体p-PI3K、p-Akt(Cell signal technology,美国)(1:1000)4 ℃孵育过夜,清洗。过氧化物酶标记的二抗(1:3000)37 ℃孵育40 min,清洗。ECL试剂X线底片上显像。扫描测定条带灰度值,以与β-actin的比值作为表达强度。
1.7 统计学方法采用SPSS 17.0统计学软件进行分析,计量资料以均数±标准差表示,每组不同时间点指标比较采用双因素方差分析,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 血清ALT、IL-17A、TNF-α浓度与IRI组相比,RHP组ALT水平在再灌注后2、8、24 h均显著降低(P < 0.05),24 h时回落至正常水平,与S组相比无统计学差异(P > 0.05);与IRI组相比,RHP组TNF-α水平在再灌注2、8 h有所下降,但无统计学意义(P > 0.05),再灌注24 h时IRI组TNF-α浓度显著升高(P < 0.05);IRI组及RHP组IL-17A水平显著高于S组(P < 0.05),二者增长趋势相似,差异无统计学意义(P > 0.05,图 1)。
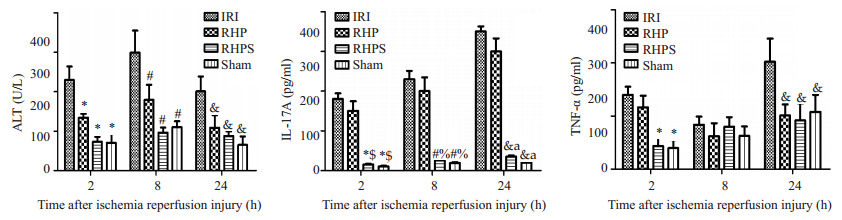
|
图 1 大鼠肾缺血再灌注后各时点血清ALT、IL-17A、TNF-α检测结果 Figure 1 Comparison of serum ALT, IL-17A and TNF-α concentrations between four groups. *P < 0.05 vs IRI 2 h; #P < 0.05 vs IRI 8 h; &P < 0.05 vs IRI 24 h; $P < 0.05 vs RHP 2 h; %P < 0.05 vs RHP 8 h; aP < 0.05 vs RHP 24 h. |
与IRI组相比,RHP组SOD含量在再灌注后2 h有所上升,但无统计学意义(P > 0.05),再灌注后8 h,RHP组含量显著升高(P < 0.05),24 h时回落,与RHPS组相比无统计学差异(P > 0.05)。与IRI组相比,RHP组肝脏总NO含量在3个时间点均升高,且差别具有统计学意义(P < 0.05),再灌注后8 h,RHPS组NO含量较RHP组高,且差异具有统计学意义,再灌注后8 h肝脏总NO含量达峰,24 h时较前有所回落(图 2)。
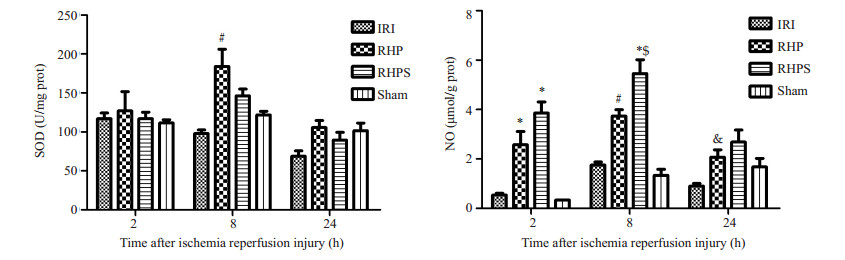
|
图 2 大鼠肾缺血再灌注后各时点肝组织SOD、NO检测结果 Figure 2 Comparison of SOD and NO levels in the liver tissue between four groups. *P < 0.05 vs IRI 2 h; #P < 0.05 vs IRI 8 h; &P < 0.05 vs IRI 24 h; $P < 0.05 vs RHP 8 h. |
HE染色结果见图 3。图 3L及图 3I显示,肝脏细胞呈条索状排列,肝窦无充血,可见少量淋巴细胞浸润;图 3C显示,肝窦扩张,少量空泡形成,中等程度淋巴细胞浸润,肝细胞排列紊乱;图 3F显示,肝细胞形态较图 3C正常,但存在汇管区炎性细胞浸润。图 3K及图 3H显示,肝细胞排列正常,肝窦少量充血;图 3B显示,大量空泡形成,淋巴、中性粒细胞浸润,细胞排列紊乱;图 3E显示,损伤较图 3B减轻,但汇管区仍有大量炎性细胞浸润,肝窦轻度充血;图 3J及图 3G显示,较正常肝细胞,少量炎性细胞浸润;图 3A显示,肝窦充血,肿胀的肝细胞挤压肝窦,大量淋巴细胞浸润,可见深染固缩的细胞核及淡染的胞质;图 3D显示,肝细胞形态较图 3A正常,汇管区周围炎性细胞浸润,淋巴细胞浸润,损伤缓解。
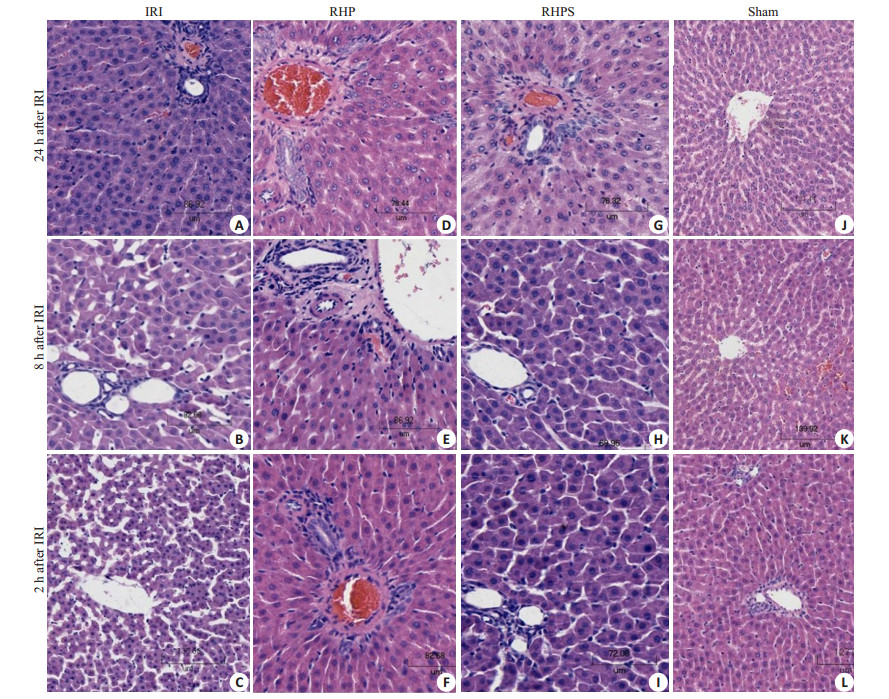
|
图 3 大鼠肾缺血再灌注后各时点各组肝脏HE染色 Figure 3 HE staining of liver tissue in different groups after renal ischemia reperfusion (HE, original magnification: ×200). A-C: IRI group; D-F: RHP group; G-I: RHPS group; J-L: Sham group. |
与IRI组相比,再灌注24 h时,RHP组P-PI3K、P-AKT蛋白表达增加(P < 0.05),再灌注8 h时两种蛋白表达最强烈(P < 0.05);再灌注24 h时,RHPS组P-PI3K、P-AKT蛋白表达均显著高于IRI组及S组(P < 0.05,图 4)。
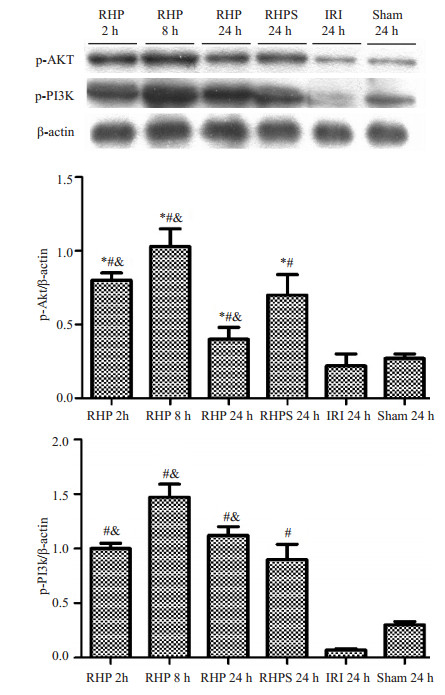
|
图 4 大鼠肾缺血再灌注后不同时间点三组p-PI3K、p-Akt蛋白表达情况 Figure 4 Expression of p-PI3K and p-Akt in different groups after reperfusion. *P < 0.05 vs IRI 24 h; #P < 0.05 vs Sham 24 h; &P < 0.05 vs RHPS 24 h. |
肾脏缺血再灌注损伤是临床大型心血管、器官移植手术常见的临床问题,严重时可导致急性肾损伤,使患者术后全身并发症的发生率升高,住院时间延长,远期生存率降低[6-9]。肾脏缺血再灌注损伤引起体内炎症反应的发生,加之再灌注期间体内产生高浓度的活性氧簇,从而导致远隔脏器,如肝脏的功能障碍,严重时可导致肝脏衰竭[2],增大术后并发症处理难度。肝脏是人体内最大的实质性脏器,也是唯一受双重血液供应的器官,单位时间血流量大,易受循环中有害物质的影响。有研究表明RHP可以减轻肾脏缺血再灌注后所带来的肾脏损伤,提高动物术后存活率[1, 10]。
本实验发现:与S组相比,IRI组各时间点血清中ALT浓度均显著升高(P < 0.05),说明肝脏在肾缺血再灌注过程中肝功能受到了损害;与IRI组相比,RHP组各时间点ALT水平显著下降,除再灌注后2 h高于S组外,再灌注8、24 h与S组相比无差异(P > 0.05),表明RHP提高了肾脏缺血再灌注损伤后的肝脏功能。同时,本实验进行了血清TNF-α及IL-17A水平测定,结果显示再灌注后2 h,IRI组及RHP组TNF-α水平均升高,RHP组TNF-α水平于再灌注后24 h回归正常,相比IRI组下降显著(P < 0.05),表明RHP可促进抗凋亡蛋白的表达,从而起到减少肝脏细胞凋亡,提高肝脏功能的作用;研究发现,IL-17A在肝或肾缺血再灌注后所致的多脏器功能衰竭的发生过程中意义重大,IL-17A主要由肠隐窝中的Paneth细胞所分泌,研究人员将Paneth基因敲除后再建立缺血再灌注模型,发现损伤明显减轻[3, 11]。本实验血清IL-17A结果显示,IRI组及RHP组血清IL-17A水平与S组及RHPS组差异显著(P < 0.05),而IRI组及RHP组血清IL-17A水平在各时间点无统计学意义(P > 0.05),表明RHP对减轻肾脏缺血再灌注损伤后所产生的级联炎症反应意义不大,而是从其他方面起到了远端肝脏的保护作用。在缺氧或缺血时,机体ROS产物增加会导致异常信号通路的激活从而导致细胞功能障碍,并启动一些列细胞凋亡程序[12-15]。肝脏组织SOD含量结果显示,与S组相比,IRI组SOD含量于再灌注后8、24 h显著降低,表明肾脏缺血再灌注后产生大量氧自由基,经血液循环进入肝脏后,导致肝脏细胞因子增多,清除自由基能力下降;而RHP组SOD值于再灌注后8 h达峰,表明RHP提高了肝脏对高浓度氧自由基的清除能力,且可能再灌注后8 h为氧自由基经血液循环入肝的早期爆发时期,此结论有待后期延长观察时间进而验证。肝脏总NO含量结果显示,RHP可以提高肾缺血再灌注后肝脏的总NO含量,且RHPS组的NO含量也相应升高,表明NO含量升高主要原因可能为预处理所致。就目前研究所知,体内NOS分为3种类型,即内皮型,神经型及诱生型。内皮型及神经型NOS参与人体正常生理活动,而诱生型NOS在感染、创伤等刺激所产生的大量细胞因子作用下,合成NO参与应激反应。3种类型NOS在机体应激状态下所产生的NO的确切作用尚不清楚。本实验仅对肝脏总NO进行测量,得出RHP后肝脏总NO含量可升高,而其具体作用有待进一步研究。
肝脏组织学检测结果显示,RHP可以减轻肝细胞变性程度,同时缓解肿胀的肝细胞对肝窦产生的压迫。然而,RHP似乎没能很好地减轻由于肾缺血再灌注所造成的炎症反应,图片上可以明显看出淋巴细胞浸润及血管周围的炎性细胞浸润。这一结果与IL-17A结果相一致,二者再次说明,RHP可以减轻肾缺血再灌注所致的肝脏损伤,但抑制再灌注后所产生的炎症反应方面作用较弱。
研究表明,低氧诱导因子1(HIF-1)可激活下游抗凋亡基因,包括热休克蛋白70、Bcl-2、促红细胞生成素及血管内皮生长因子[16-18],下调促凋亡基因Bax的表达[19]。RHP可提高缺血再灌注肾脏HIF-1的表达[10],使磷脂酰肌醇-3激酶(PI3K)磷酸化,进而激活下游蛋白激酶B(Akt),通过PI3K/Akt信号通路产生上调抗凋亡基因、下调促凋亡基因的表达而起到器官功能保护的作用[20]。本实验对肾脏缺血再灌注后肝脏细胞表达的磷酸化PI3K/Akt进行了Western blot检测,结果显示与IRI组比较,各时间点RHP组p-PI3K及p-Akt表达显著增高(IRI组及S组各时间点的比值类似,故此处仅列出再灌注后24 h结果),表明RHP所产生的肝脏保护作用可能通过PI3K/Akt信号通路产生,另一发现是,RHPS组的p-PI3K及p-Akt的表达高于IRI组及S组,可能的解释为RHP过程中,长期低压氧刺激激活了PI3K/Akt信号通路,使机体适应低氧环境,提高器官缺氧耐受能力,进而产生保护作用。
综上所述,RHP对于肾脏缺血再灌注损伤后所致的肝脏损伤具有保护作用,可能通过增加自由基清除能力、减弱氧化应激反应及上调抗凋亡蛋白表达等方式,PI3K/ Akt信号通路可能参与其中,进一步机制尚待深入研究。
| [1] | Yang CC, Lin LC, Wu MS, et al. Repetitive hypoxic preconditioning attenuates renal ischemia/reperfusion induced oxidative injury via upregulating HIF-1 alpha-dependent bcl-2 signaling[J]. Transplantation,2009, 88 (11) : 1251-60. DOI: 10.1097/TP.0b013e3181bb4a07. |
| [2] | Serteser M, Koken T, Kahraman A, et al. Changes in hepatic TNF-alpha levels, antioxidant status, and oxidation products after renal ischemia/reperfusion injury in mice[J]. J Surg Res,2002, 107 (2) : 234-40. DOI: 10.1006/jsre.2002.6513. |
| [3] | Park SW, Kim M, Brown KM, et al. Paneth cell-derived interleukin-17A causes multiorgan dysfunction after hepatic ischemia and reperfusion injury[J]. Hepatology,2011, 53 (5) : 1662-75. DOI: 10.1002/hep.24253. |
| [4] | Kono H, Fujii H, Ogiku M, et al. Role of IL-17A in neutrophil recruitment and hepatic injury after warm ischemia-reperfusion mice[J]. J Immunol,2011, 187 (9) : 4818-25. DOI: 10.4049/jimmunol.1100490. |
| [5] | Sugita S, Okabe T, Sakamoto A. Continuous infusion of dexmedetomidine improves renal ischemia-reperfusion injury in rat kidney[J]. J Nippon Med Sch,2013, 80 (2) : 131-9. DOI: 10.1272/jnms.80.131. |
| [6] | Stafford-Smith M, Shaw A, Swaminathan M. Cardiac surgery and acute kidney injury: emerging concepts[J]. Curr Opin Crit Care,2009, 15 (6) : 498-502. DOI: 10.1097/MCC.0b013e328332f753. |
| [7] | Perico N, Cattaneo D, Sayegh MH, et al. Delayed graft function in kidney transplantation[J]. Lancet,2004, 364 (9447) : 1814-27. DOI: 10.1016/S0140-6736(04)17406-0. |
| [8] | Koo DD, Welsh KI, Roake JA, et al. Ischemia/reperfusion injury in human kidney transplantation: an immunohistochemical analysis of changes after reperfusion[J]. Am J Pathol,1998, 153 (2) : 557-66. DOI: 10.1016/S0002-9440(10)65598-8. |
| [9] | Akhtar MZ, Henderson T, Sutherland A, et al. Novel approaches to preventing ischemia-reperfusion injury during liver transplantation[J]. Transplant Proc,2013, 45 (6) : 2083-92. DOI: 10.1016/j.transproceed.2013.04.004. |
| [10] | Yeh CH, Hsu SP, Yang CC, et al. Hypoxic preconditioning reinforces HIF-alpha-dependent HSP70 signaling to reduce ischemic renal failure-induced renal tubular apoptosis and autophagy[J]. Life Sci,2010, 86 (3/4) : 115-23. |
| [11] | Park SW, Kim M, Kim JY, et al. Paneth cell-mediated multiorgan dysfunction after acute kidney injury[J]. J Immunol,2012, 189 (11) : 5421-33. DOI: 10.4049/jimmunol.1200581. |
| [12] | Liu G, Sun Y, Li Z, et al. Apoptosis induced by endoplasmic reticulum stress involved in diabetic kidney disease[J]. Biochem Biophys Res Commun,2008, 370 (4) : 651-6. DOI: 10.1016/j.bbrc.2008.04.031. |
| [13] | Chien CT, Shyue SK, Lai MK. Bcl-xL augmentation potentially reduces ischemia/reperfusion induced proximal and distal tubular apoptosis and autophagy[J]. Transplantation,2007, 84 (9) : 1183-90. DOI: 10.1097/01.tp.0000287334.38933.e3. |
| [14] | Chien CT, Lee PH, Chen CF, et al. De novo demonstration and co-localization of free-radical production and apoptosis formation in rat kidney subjected to ischemia/reperfusion[J]. J Am Soc Nephrol,2001, 12 (5) : 973-82. |
| [15] | Bhatt K, Feng L, Pabla N, et al. Effects of targeted Bcl-2 expression in mitochondria or endoplasmic reticulum on renal tubular cell apoptosis[J]. Am J Physiol Renal Physiol,2008, 294 : F499-507. DOI: 10.1152/ajprenal.00415.2007. |
| [16] | Bernaudin M, Nedelec AS, Divoux D, et al. Normobaric hypoxia induces tolerance to focal permanent cerebral ischemia in association with an increased expression of hypoxia-inducible factor-1 and its target genes, erythropoietin and VEGF, in the adult mouse brain[J]. J Cereb Blood Flow Metab,2002, 22 (4) : 393-403. |
| [17] | Uchiyama T, Engelman RM, Maulik N, et al. Role of Akt signaling in mitochondrial survival pathway triggered by hypoxic preconditioning[J]. Circulation,2004, 109 (24) : 3042-9. DOI: 10.1161/01.CIR.0000130647.29030.90. |
| [18] | Date T, Mochizuki S, Belanger AJ, et al. Expression of constitutively stable hybrid hypoxia-inducible factor-1alpha protects cultured rat cardiomyocytes against simulated ischemia-reperfusion injury[J]. Am J Physiol Cell Physiol,2005, 288 (2) : C314-20. DOI: 10.1152/ajpcell.00374.2004. |
| [19] | Erler JT, Cawthorne CJ, Williams KJ, et al. Hypoxia-mediated down-regulation of Bid and Bax in tumors occurs via hypoxiainducible factor 1-dependent and -independent mechanisms and contributes to drug resistance[J]. Mol Cell Biol,2004, 24 (7) : 2875-89. DOI: 10.1128/MCB.24.7.2875-2889.2004. |
| [20] | Zhou J, Schmid T, Frank R, et al. PI3K/Akt is required for heat shock proteins to protect hypoxia-inducible factor 1alpha from pVHL-independent degradation[J]. J Biol Chem,2004, 279 (14) : 13506-13. DOI: 10.1074/jbc.M310164200. |
 2015, Vol. 35
2015, Vol. 35
