2. 西门子(中国)有限公司医疗业务领域磁共振事业部,北京 100102
2. Group of MR Business, China Healthcare Sector, Siemens Ltd., Beijing 100102, China
膝关节软骨损伤在人群中的发病率极高,由于软骨自身的修复能力微弱,软骨的修复治疗显得尤为困难。软骨修复治疗的目的不仅在于缓解临床症状,还要求修复后的软骨组织在结构及力学性能上达到或接近正常透明软骨[1]。基质诱导的自体软骨细胞移植技术(matrixassociated autologous chondrocyte transplantation, MACT)作为最新的软骨移植技术,逐渐被用于临床。磁共振成像(magnetic resonance imaging, MRI)因其高软组织分辨率、无创性、可重复性成为评估关节软骨修复的首选方法[2]。随着磁共振成像技术的发展,MRI对关节软骨的评价已从单纯的形态学发展为提供组织生化信息的功能学评价,并成为研究的热点。其中,T2mapping成像是生理性定量评估关节软骨组织构成的一个功能指标,T2值空间分布可以揭示水和胶原纤维含量及方向的改变,便于客观、动态监测MACT术后软骨修复情况[3]。目前,国内外研究报道T2mapping成像评估MACT术后软骨修复相对较少,特别是MACT术后软骨深浅层T2值特点与生化信息关系国内未见相关报道。本研究旨在应用磁共振成像对MACI术后进行动态随访评估,探讨T2mapping成像在软骨修复过程中的诊断价值。
1 对象和方法 1.1 研究对象收集2012年5月~2014年2月6例膝关节接受MACT术的患者(共9膝9处软骨损伤),男4例,女2例,年龄40~50(44±2.6)岁。所有受试者均签署知情同意书。按照国际软骨修复协会(ICRS)标准,软骨缺损程度均为Ⅲ~Ⅳ度。软骨缺损分布:髌骨4处,股骨内侧髁3处,股骨滑车2处。软骨缺损平均面积2.599±0.657 cm2/处(1.8~4.0 cm2,n=9)
1.2 研究方法(1)采用Siemens 3.0T Skyra高场强磁共振扫描仪,15通道膝关节表面线圈。采用脚先进、仰卧位模式,尽量保持膝关节位于线圈中央。患者检查前静卧30 min以消除关节运动及承重差异对扫描结果的影响。扫描序列包高分辨率横轴位、冠状位和矢状位FS-PDWI,矢状位3D-VIBE,矢状位T2mapping序列;(2)成像参数:高分辨率横轴位FS-PDWI:重复时间3790 ms,回波时间31 ms,视野140×140 mm,矩阵336×448 mssa,扫描时间4 min 27 s;高分辨率冠状位FS-PDWI:重复时间2400 ms,回波时间35 ms,视野140×140 mm,矩阵381× 448 mssa,扫描时间4 min 42 s;高分辨率矢状位FS-PDWI:重复时间3000 ms,回波时间31 ms,视野140×140 mm,矩阵336×448 mssa,扫描时间4 min 44 s;矢状位3D-VIBE:重复时间11.6 ms,回波时间5.4 ms,视野150×150 mm,矩阵381×448 mssa,扫描时间5 min 27 s;矢状位T2mapping(采用5个回波SE序列):重复时间1921.3 ms,回波时间13.8/27.6/41.4/55.2/69 ms,视野160×160 mm,矩阵384×384 mssa,扫描时间8 min 42 s。
1.3 图像分析数据传输至Siemens syngo workplace后处理工作站,由两名经培训后的影像诊断医师采用双盲法完成数据测量及记录,共同讨论后得出一致性结论。T2伪彩图由软件自动计算处理获得,结合高分辨率矢状位FS-PDWI及矢状位3D-VIBE图像,选择软骨最佳显示层面,T2图上选择软骨修复区和邻近正常对照区作为感兴趣区(region of interest, ROI),分别测量感兴趣区的全层T2值及将其等分的深、浅层T2值。测量时尽量包全修复组织全层,正常对照区的感兴趣区为移植区旁开5 mm(要求包全软骨全层、表面完整、无异常信号改变)(图 1、2),每处均连续测量3次T2值并取平均值。3、6、12月三个时间点的ROI尽量置于同一位置。
|
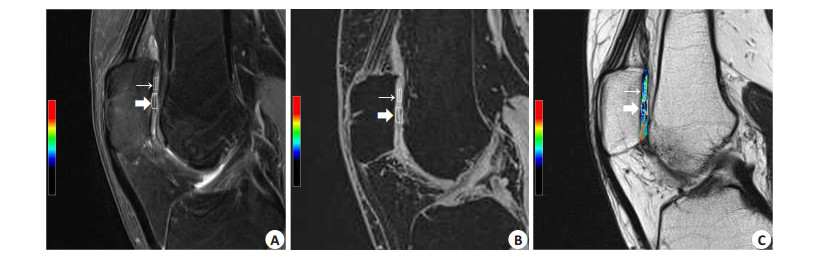
图 1 MACT术后6个月同一患者髌软骨FS-PDWI图像(A)、3D-VIBE图像(B)及T2map图(C),箭头所示分别为移植软骨区域(粗箭头)及邻近正常软骨(细箭头) Figure 1 High-revolution FS-PDWI image (A), matched 3D-VIBE image (B) and quantitative T2 map image (C) of the cartilage in a patient at 6 month after MACT of the patella. Arrows mark the repaired cartilage and control cartilage. |
|
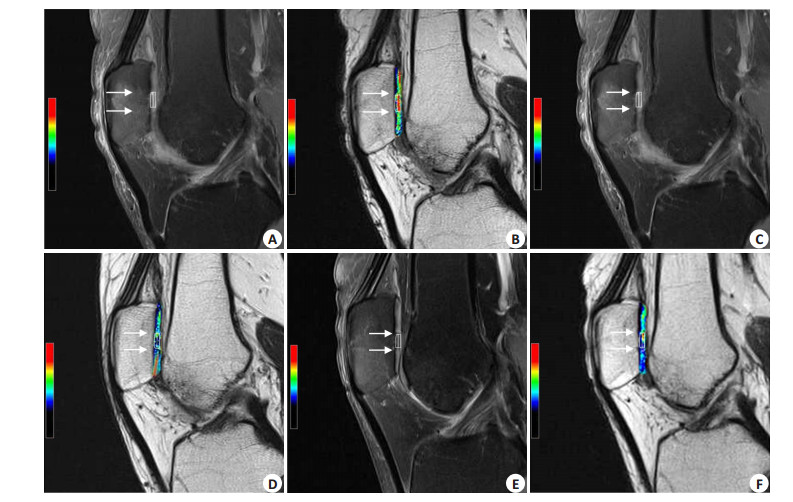
图 2 MACT术后3个月(A: FS-PDWI; B:T2map)、6个月(C: FS-PDWI; D: T2map)及12个月(E: FS-PDWI; F: T2map)同一患者髌软骨FS-PDWI图像和T2map图 Figure 2 FS-PDWI and T2 images of one patient at 3 months (A: FS-PDWI; B: T2 map), 6 months (C: FS-PDWI; D: T2map) and 12 month (E: FS-PDWI; F: T2 map) after MACT. Arrows mark the area of the repaired cartilage. |
采用SPSS 16.0统计软件,计量资料用均数±标准差表示。采用配对t检验比较各时间点(3、6、12个月)修复区与正常对照区全层及深浅层T2值差异。采用单因素方差分析纵向对比修复区三个时间点(3、6及12个月)深浅层的T2值差异。P < 0.05表示差异有统计学意义。
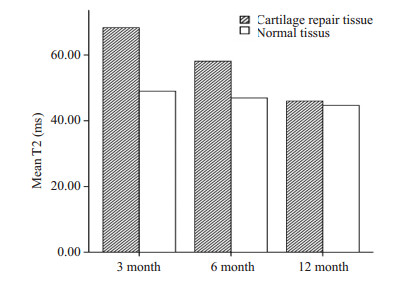
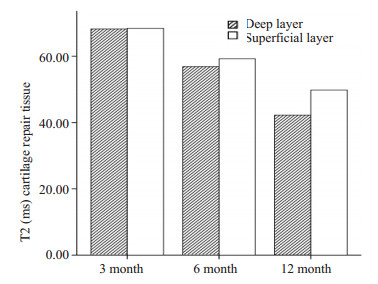
2 结果 2.1 MACT术后各时间点修复区与正常对照区软骨T2值横向比较修复区与正常对照区全层T2值比较(表 1、图 3),结果表明:术后3月、6月修复组织全层T2值高于邻近正常软骨,差异有统计学意义(3月:P=0.001;6月:P=0.003),术后12个月两者T2值差异无明显统计学差异(P=0.063)。软骨修复区深、浅层T2值比较(表 1、图 4),结果表明:术后6、12个月修复区软骨的深浅层T2值变化有统计学意义(P均 < 0.05), 表现为由深层到浅层T2值逐渐升高。而术后3个月修复区软骨的深浅层T2值变化无明显统计学意义(P=0.233)。对于正常对照区,各时间点浅层T2值均大于深层,并具有显著统计学差异(P均 < 0.05)。
| 表 1 术后各时间点修复区与正常区软骨全层及深浅层T2值比较 Table 1 Mean (full-thickness) and zonal (deep and superficial) T2 values (ms) of the repaired cartilage (RT) and normal cartilage (NC) at 3, 6, and 12 months after MACT |
|
图 3 术后各时间点修复区与正常区软骨全层(平均)T2值比较 Figure 3 Mean T2 values of the repaired and normal cartilages in different time points after MACT. |
|
图 4 术后各时间点软骨修复组织深层与浅层T2值比较 Figure 4 Comparison of deep and superficial T2 values of the repaired cartilages at different time points after MACT. |
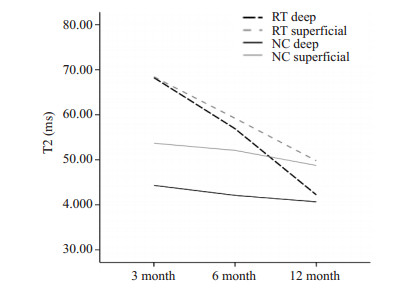
MACT术后各随访时间点对修复区和正常区深浅层进行纵向对比(图 5),结果表明:随着随访时间延长,修复区深浅层T2值呈下降趋势,并逐渐接近于正常软骨。修复区的深浅层T2值区域变化逐渐明显,尤其以术后12个月时最为显著(P=0.005)。术后3个月和6个月、6个月和12个月修复区T2值两两比较,差别均具有统计学意义(P均 < 0.05)。而正常区各随访时间T2值无明显统计学差异(P=0.327)。
|
图 5 术后各时间点修复区与正常区深浅层T2值比较 Figure 5 Comparison of the zonal T2 values of the repaired and control cartilages at different time points after MACT. |
随着生物医学工程的发展,组织工程被引入软骨缺损治疗中,其中以MACT最具有代表性,它将自体软骨细胞作为种子细胞,培养扩增后接种在Ⅰ/Ⅲ型胶原膜上,移植前修剪成与缺损部位相应的形状,手术时用生物蛋白胶将其黏贴在软骨缺损处[4]。MACT的优势在于易形成透明软骨样修复,与周围正常软骨整合度高,术后并发症发生率低,能够保持良好的长期临床效果。移植后的软骨细胞依靠关节液的支持与营养,生长、繁殖并分泌细胞外基质,形成含有胶原、蛋白多糖及水分子的分层结构。临床随访观察MACT术后软骨修复过程的手段包括MRI检查、关节镜检查。然而,关节镜检查为有创性检查,临床开展时患者接受性差,再加上术后并发症的存在,故关节镜检查在临床应用具有局限性[5]。磁共振成像检查不仅具有无创性、可重复性等优点,磁共振T2mapping成像还可以反映软骨内胶原纤维排列及水含量及方向改变[6]。较多研究表明软骨内胶原含量、胶原纤维分布各向异性及水含量是软骨T2值变化的主要决定因素[3, 6]。Nishioka等[7]报道T2值是衡量胶原网状纤维结构完整性的一个重要指标,T2mapping以非侵入性方式检测软骨细胞外胶原成分及排列变化,展示软骨超微结构。基于关节透明软骨胶原网状纤维排列及分布特点,分层评估T2值在国外已有报道。在一项动物实验研究中发现,MACI术后移植区T2值分层表现提示移植后软骨接近透明软骨样修复[8]。通过观察测量软骨深浅层T2值的空间分布特征,可用于动态观察缺损组织的修复过程,检测修复组织胶原及水含量的组成及构象变化[9]。另外,T2-mapping序列无需注射造影剂,扫描时间较短,敏感性高,在软骨修复术后评估中具有重要临床应用价值。
本研究发现MACT术后早期(3个月),移植区全层T2值较正常组明显升高,这可能是由于手术创伤造成表面软骨水肿、关节液渗入、软骨基质尚未形成、自由水流动增加等综合因素的结果[10]。术后6个月,移植区T2值逐渐下降,但较正常组仍增高,这主要由于此时细胞外基质的合成与分解尚未达到平衡,胶原网状结构仍松散紊乱,修复的软骨内富含自由水,故T2值仍升高。这与Trattnig等[11]研究的结果相符,其研究结果也提示术后6个月内移植区T2值高于正常软骨,统计分析具有显著差异(P < 0.036)。随着时间进展,至术后12个月时,移植区T2值较前明显下降并趋于正常,提示随着修复组织成熟,胶原纤维排列逐渐规整,胶原含量及水含量逐渐恢复正常。Watrin-pinzano等[12]报道老鼠在接受MACI术后,修复组织T2值随时间延长而逐渐减低,指出T2mapping可评估修复过程中细胞外基质成分及胶原网状结构的排列方向改变。
以往对MACT术后移植区软骨T2值变化的研究,集中在全层T2值研究,对移植软骨深浅层区域T2值变化相关研究较少。Welsch等[5]在随访评估软骨修复的研究中发现,修复组织T2值的空间区域变化能够作为鉴别修复组织类型的一项影像特征表现,透明软骨样修复组织深浅区域T2值发生变化,而纤维修复组织深浅层T2值无明显变化趋势。修复组织软骨T2值的深浅区域变化是透明软骨样软骨修复的一个影像标志[12-13]。本研究结果显示,无论软骨移植区还是正常区,各时间点深浅层T2值变化均存在,表现为由深层到浅层T2值逐渐升高。Domayer等[14]应用7.0T磁共振观察踝关节MACT术后软骨修复过程发现,术后软骨各层组织结构尤其是胶原纤维的各向异性改变是形成软骨深浅层T2值变化的基础。与本研究结果一致,说明软骨深浅层胶原纤维的排列构象影响软骨T2值。本研究证实MACT术后6个月内移植区软骨深层T2值与正常区T2值有明显差异,Welsch等[15]认为这是由于修复过程中胶原纤维空间构架基础上水分子运动的各向异性的影响,这一差异在浅层T2值表现并不明显。随着时间进展,至术后12月时,修复组织区与正常软骨深浅层T2值均未见统计学差异,可能提示移植软骨的塑形修复已趋向于正常软骨,并逐渐形成透明软骨样的修复组织。
结果提示从MACT术后3个月到12个月,移植区深浅区域T2值变化逐渐明显,术后6个月时移植区软骨深浅区域T2值差别即具有统计学意义,这与移植后软骨逐渐修复塑形与成熟有关[11]。但Welsch等[16]报道MACT术后12个月以上股骨内侧髁移植区深浅区域T2值才表现出明显的统计学差异,与本研究统计结果存在一定差异,分析可能有以下几点因素(1)本研究因为样本量小,未对膝关节缺损移植部位进行进一步分组;(2)Welsch等[16]将术后3~12个月作为一个随访时间点,时间间隔跨度大。由于不同个体间T2值存在差异,故本研究评价修复组织T2值时,选择同一患者邻近正常软骨作为对照。研究结果提示正常对照区各随访时间点均表现出明显的T2值由深层向浅层增加的趋势,这也进一步证实了透明软骨各层组织结构的各向异性是形成软骨深浅层T2值区域变化的基础[14, 8]。
本研究还存在一定的局限性。首先,本研究结果缺乏相应的组织学依据。在临床工作中,MACT术后关节镜检查并不易开展,因为在患者术后临床随访报告中,基本均能达到令人满意的效果,此时进行有创的关节镜检查很难被患者接受。今后我们将补充动物实验内容,进行T2mapping与组织学的对照研究,为MACT术后软骨修复过程提供组织病理依据。其次,由于样本量较少、随访时间较短,有限的临床数据尚不足以提供全面的信息,有待于扩充样本量及增加随访时间来进一步证实本研究结果的准确性。最后,由于移植后软骨较薄,T2mapping分辨率有限,我们仅对软骨进行了深层及浅层的评估。通过MRI生化成像技术对软骨修复组织进行3层或以上的生化评估,以更加真实的模拟关节软骨的解剖结构,是未来将面临的挑战[15]。
综上所述,我们的研究结果表明,MACT术后3、6个月,移植软骨T2值较正常软骨明显增高,术后12个月T2值逐渐下降并接近正常软骨,同时移植区具有一定的空间区域变化规律,表现为从深层到浅层T2值逐渐增加的趋势,提示MACT术后软骨修复组织在塑形成熟过程中达到或接近透明软骨样修复。T2-mapping技术是一种可行的、敏感的无创性关节软骨分子影像技术。磁共振T2mapping成像可以提供生化信息,监测修复过程,鉴别组织属性,对MACT术后关节软骨修复效果评估有较高的诊断价值。
| [1] | Welsch GH, Trattnig S, Hughes T, et al. T2 and T2* mapping in patients after matrix-associated autologous chondrocyte transplantation: initial results on clinical use with 3.0-Tesla MRI[J]. Eur Radiol,2010, 20 (6) : 1515-23. DOI: 10.1007/s00330-009-1669-y. |
| [2] | Trattnig S, Millington SA, Szomolanyi P, et al. Mr imaging of osteochondral grafts and autologous chondrocyte implantation[J]. Eur Radiol,2007, 17 (1) : 103-18. DOI: 10.1007/s00330-006-0333-z. |
| [3] | Welsch GH, Mamisch TC, Marlovits S, et al. Quantitative T2 mapping during follow-up after matrix-associated autologous chondrocyte transplantation (MACT): full-thickness and zonal evaluation to visualize the maturation of cartilage repair tissue[J]. J Orthop Res,2009, 27 (7) : 957-63. DOI: 10.1002/jor.v27:7. |
| [4] | Zhang ZW, Ye QB, Yang ZC, et al. Matrix-induced autologous chondrocyte implantation for treatment of chondral defect of knee:a preliminary report[J]. J Musculoskelet Res,2006, 10 (2) : 95-101. DOI: 10.1142/S0218957706001765. |
| [5] | Welsch GH, Mamisch TC, Domayer SE, et al. Cartilage T2 assessment at 3-T Mr imaging: in vivo differentiation of normal hyaline cartilage from reparative tissue after two cartilage repair procedures--initial experience[J]. Radiology,2008, 247 (1) : 154-61. DOI: 10.1148/radiol.2471070688. |
| [6] | Trattnig S, Ba-Ssalamah A, Pinker K, et al. Matrix-based autologous chondrocyte implantation for cartilage repair: noninvasive monitoring by high-resolution magnetic resonance imaging[J]. Magn Reson Imaging,2005, 23 (7) : 779-87. DOI: 10.1016/j.mri.2005.04.010. |
| [7] | Nishioka H, Hirose J, Nakamura E, et al. T1ρ and T2 mapping reveal the in vivo extracellular matrix of articular cartilage[J]. J Magn Reson Imaging,2012, 35 (1) : 147-55. DOI: 10.1002/jmri.v35.1. |
| [8] | White LM, Sussman MS, Hurtig M, et al. Cartilage T2 assessment: differentiation of normal hyaline cartilage and reparative tissue after arthroscopic cartilage repair in equine subjects[J]. Radiology,2006, 241 (2) : 407-14. DOI: 10.1148/radiol.2412051750. |
| [9] | Filardo G, Vannini F, Marcacci M, et al. Matrix-assisted autologous chondrocyte transplantation for cartilage regeneration in osteoarthritic knees: results and failures at midterm follow-up[J]. Am J Sports Med,2013, 41 (1) : 95-100. DOI: 10.1177/0363546512463675. |
| [10] | 陈敏, 徐贤, 韩邵军, 等. 磁共振T2mapping成像对移植软骨的评估价值[J]. 中国医学科学院学报,2014, 36 (1) : 86-91. |
| [11] | Trattnig S, Mamisch TC, Welsch GH, et al. Quantitative T2 mapping of matrix-associated autologous chondrocyte transplantation at 3 Tesla: an in vivo cross-sectional study[J]. Invest Radiol,2007, 42 (6) : 442-8. DOI: 10.1097/01.rli.0000262088.67368.49. |
| [12] | Watrin-Pinzano A, Ruaud JP, Cheli Y, et al. Evaluation of cartilage repair tissue after biomaterial implantation in rat patella by using T2 mapping[J]. MAGMA,2004, 17 (3/6) : 219-28. |
| [14] | Watrin-Pinzano A, Ruaud JP, Cheli Y, et al. T2 mapping: an efficient Mr quantitative technique to evaluate spontaneous cartilage repair in rat patella[J]. Osteoarthritis Cartilage,2004, 12 (3) : 191-200. DOI: 10.1016/j.joca.2003.10.010. |
| [15] | Domayer SE, Apprich S, Stelzeneder D, et al. Cartilage repair of the ankle: first results of T2 mapping at 7.0 T after microfracture and matrix associated autologous cartilage transplantation[J]. Osteoarthritis Cartilage,2012, 20 (8) : 829-36. DOI: 10.1016/j.joca.2012.04.015. |
| [16] | Welsch GH, Mamisch TC, Zak L, et al. Evaluation of cartilage repair tissue after matrix-associated autologous chondrocyte transpantation using a hyaluronic-based or a collagen-based scaffold with morphological MOCART scoring and biochemical T2 mapping: preliminary results[J]. Am J Sports Med,2010, 38 (5) : 934-42. DOI: 10.1177/0363546509354971. |
| [17] | Welsch GH, Mamisch TC, Quirbach S, et al. Evaluation and comparison of cartilage repair tissue of the patella and medial femoral condyle by using morphological MRI and biochemical zonal T2 mapping[J]. Eur Radiol,2009, 19 (5) : 1253-62. DOI: 10.1007/s00330-008-1249-6. |
 2015, Vol. 35
2015, Vol. 35
