利妥昔单抗(Rituximab,美罗华),一种单克隆抗体,与CD20抗原特异性结合,其不仅作为CD20+B细胞非霍奇金淋巴瘤一线治疗方案R-CHOP的关键组成部分在临床广泛使用,也作为免疫抑制剂使用于一些自身免疫性疾病。近年美罗华相关的间质性肺炎(RTX-IP)的报道越来越多,其起病隐匿,临床症状不典型,一旦出现症状往往病情急、重,进展快,病死率高[1-3],早期诊断和治疗显得尤其重要。我们在使用R-CHOP方案治疗非霍奇金淋巴瘤(NHL)患者的过程中遇到过类似病例,现报道如下并结合文献分析讨论。
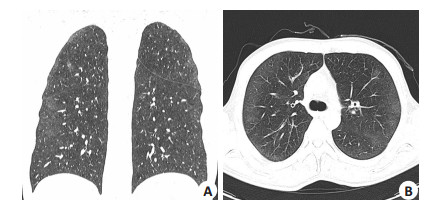
1 资料和方法 1.1 临床资料例1,男,51岁,因“反复下腹绞痛1月”入院,2012年5月25日术后病理及临床诊断为右结肠弥漫大B细胞淋巴瘤Ⅱ期A,于2012年6月26日始予R-CHOP(美罗华,环磷酰胺、表柔比星、长春新碱、地塞米松)方案化疗(每疗程21 d)。治疗期间除反复口腔溃疡外无其他并发症出现。第4疗程化疗结束1周后无明显诱因出现39 ℃左右高热,伴乏力、畏寒、头痛,无咳嗽、咳痰,无寒战,肺部听诊无明显异常,胸片检查未发现异常,经验性口服抗菌药物治疗5 d无效,双肺出现广泛干啰音。行HRCT(2012年9月17日)示双肺内中外叶多发磨玻璃样密度增高影,边界欠清晰,右肺为甚,诊断双肺间质性炎症(图 1A、B)。检验白细胞4.96×109/L,淋巴细胞0.62×109/L,中性粒细胞2.99×109/L,HGB97g/L,PLT263× 109/L。血清真菌D葡聚糖、病毒抗体均为阴性,CRP升高为50.5 mg/L,其余常规检查均无明显异常。
|
图 1 例1患者4疗程R-CHOP方案化疗后胸部CT示双肺磨玻璃样改变 Figure 1 High-resolution computed tomography of the chest demonstrating diffuse ground-glass opacity in both lungs of case 1 after four cycles of R-CHOP (9/17/2012). |
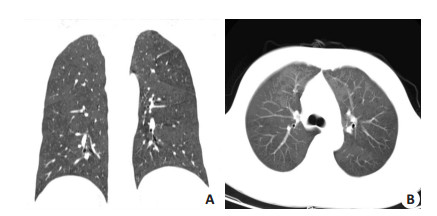
例2,男,46岁,2012年7月6日诊断为肝弥漫大B细胞淋巴瘤Ⅳ期B,并2012年7月7日始行R-CHOP方案化疗(每疗程21 d),过程顺利。4疗程化疗后原发病达CR,后进一步予R-CHOP方案巩固治疗。第6疗程化疗前2 d无明显诱因出现低热,2012年10月29日行胸部CT检查发现双肺纹理增粗,肺野透光度普遍减低,呈磨玻璃样改变,考虑为间质性炎症(图 2A、B)。当时无咳嗽、咳痰,无胸闷、气促,双肺未闻及干、湿性啰音,检验白细胞2.47×109/L,淋巴细胞0.57×109/L,中性粒细胞正常,CRP、真菌D葡糖及常规生化检查均无明显异常,EB病毒、巨细胞病毒抗体均为阴性。
|
图 2 例2患者5疗程R-CHOP方案化疗后胸部CT示双肺磨玻璃样改变 Figure 2 High-resolution computed tomography of the chest demonstrating diffuse ground-glass opacity in both lungs of case 2 after five cycles of R-CHOP (10/29/2012). |
相关文献报道RTX是IP发生的独立危险因素,机制尚不明确,部分患者可能是由于使用RTX增加了其对卡氏肺孢子菌和真菌等机会菌的易感性而致IP发生,类固醇激素、磺胺甲基异恶唑和醋酸卡泊芬净治疗有效。以上两例患者行检查短期内均无发现明确的感染相关病因,经验性抗细菌治疗无效,并既往无心肺疾患,而在前期治疗中使用类固醇激素的情况下出现IP,我们考虑了使用RTX增加了患者对机会菌的易感性而致IP发生,但通常病原学检查阳性率很低,病情及后续原发病治疗需要我们予以磺胺甲基异噁唑和醋酸卡泊芬净进行治疗。
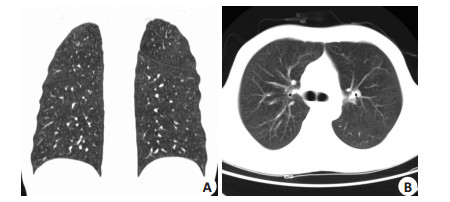
2 结果例1患者在用药3 d后体温峰值下降至37.2 ℃,双肺干啰音范围减小,病情渐好转。体温正常1周后(2012年9月27日),复查胸部HRCT,示双肺间质性炎症明显改善(图 3A、B),患者未再出现不适症状,后改为口服伏立康唑及磺胺甲基异恶唑治疗。2周后行全身PET/CT检查,示肺部炎性病灶消失,未见高代谢灶,血液学检验无明显异常,原发病达完全缓解,继续完成后续巩固化疗。
|
图 3 例1患者抗机会菌治疗2周后胸部CT示肺部病灶消失 Figure 3 High-resolution computed tomography of the chest demonstrating clearing of pulmonary inflammation in case 1 after two weeks anti opportunistic pathogens therapy (9/27/2012). |
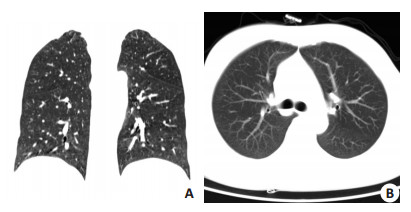
例2患者用药期间无发热及呼吸系统症状,1周后(2012年11月6日)复查胸部CT,磨玻璃样改变基本消失(图 4A、B),治疗显效,且淋巴细胞计数恢复正常,继续治疗1周后完成第6疗程化疗。20 d后复查胸部CT病灶完全消失,后续治疗顺利。
|
图 4 例2患者抗机会菌治疗1周后胸部CT示肺部病灶消失 Figure 4 High-resolution computed tomography of the chest demon strating clearing of pulmonary inflammation in case 2 after one week anti opportunistic pathogens therapy (11/06/2012). |
IP是肺间质疾病的总称,以弥漫性肺实质、肺泡炎和间质纤维化为病理基本改变,多数由于病毒感染所致,也可见于其它原因。临床表现为活动性呼吸困难、气急、气短,胸部X线示弥漫性阴影,肺功能检查为限制性通气障碍、弥散功能(DLCO)降低及低氧血症。分子靶向药物是当今抗肿瘤的趋势,药物相关的IP也逐渐引起人们的重视。
长期以来,利妥昔单抗在临床广泛使用,其安全性和疗效都得到了认可,NHL的缓解率明显提高[4-5],并在免疫相关疾病的治疗中也显示出很好的疗效[6-7]。其通过多种机制发挥作用[8],包括抗体介导的细胞毒效应,补体依赖的细胞毒效应以及启动细胞凋亡信号通路等。其常见的副作用主要是输注相关反应,一般均可耐受。既往研究报道[9]美罗华相关的肺部毒性不到0.03%,也有报道[10]为11%,但随着广泛使用,近年来关于使用美罗华后出现的亚急性副作用-间质性肺炎(IP)的报道越来越多[1, 2, 9, 11-13]。虽然多数为个案报道或小规模临床研究,但多项研究证实[1, 14-15]美罗华作为一线治疗药物是IP发生的独立危险因素,且IP发病无典型症状,病死率高,早发现、早诊断和及时治疗提高患者生存率,需要引起临床医生的重视。结合不同机构文献报道,我们对RTX-IP的特征做简要概述:(1)RTX-IP发生率相对较低,根据目前统计[3, 10-12, 15-18]约为3.5%-16.7%,但相关病例报道逐年增加,RTX-IP逐渐被临床医生所认识。该病老年、中青年和儿童患者均可见[19-20];(2)中位发病时间为利妥昔单抗治疗4个周期后,累及剂量达到1500 mg/m2或总量达到2595 mg时[11, 21],常发生在最后一次美罗华输注15 d前后[13];(3)患者表现为无明确诱因出现发热、乏力、干咳,严重者有呼吸困难。淋巴细胞绝对值小于1×109为RTX-IP发生的独立危险因素[17],也有多因素分析[3, 22]指出ECOG评分高、高龄、低白蛋白血症均是其危险因素;(4)胸部HRCT表现为明显的磨玻璃样改变,较临床症状更早出现,结合我们报道的病例早期胸部X线未能发现明显异常;(5)部分患者很可能是机会菌感染所致,包括卡氏肺孢子虫和白色念珠菌等,但痰液、血清及血培养等病原检查阳性率不高,CRP正常或轻度升高[16]。支气管镜活检可确诊,但患者常常拒绝侵入性操作,临床实践中HRCT的应用价值更高;(6)患者一旦出现症状后病情进展快,经验性抗病毒或抗细菌治疗效果差[13],部分患者对类固醇激素治疗反应好[12-13],但未能改善病情急重者的预后[23]。有学者提倡[24]预防性用药抗机会菌感染,我们认为非急重患者无需预防性用药,而在化疗过程中联合使用大剂量激素的情况下发生IP,需考虑抗机会性致病菌治疗。有报道[1]称严重者使用TNF-α抗体有一定有效率,治疗越早预后越好;(7)关于RTX-IP的机制尚未清楚,目前认为[1]是美罗华相关的多种机制共同导致,包括B细胞信号通路激活、补体活化、直接启动细胞凋亡、补体依赖的细胞毒作用等。有报道提出“细胞毒T细胞二次激活学说”,该学说认为静滴美罗华后细胞毒T细胞被激活,细胞因子释放,补体激活,引起血管和肺泡损伤。补体活化还引起巨噬细胞和肥大细胞活化,进一步释放细胞因子及活化C3a和C5a。TNF-α是其中起主要作用细胞因子[25],抗TNF-α治疗可考虑用于严重或激素治疗反应差的病例[23]。另一种假说[26]认为美罗华介导了B细胞凋亡,激活宿主免疫活细胞,介导细胞毒T细胞激活并间接的引起血管、肺泡损伤。也有学者[15]认为RTX-IP的发生与细胞刺激因子的使用有关,但以上病例均无细胞刺激因子使用史,有待进一步证实。同时有学者[16-17]根据检测血β-D葡聚糖以及痰液人源性肺孢子菌DNA的基因扩增提示IP的发生可能是由于美罗华的使用增加了机会性感染(病原学检验多见为卡氏肺囊虫或真菌)的易感性,而致IP发生,以上病例我们多次检测未获得阳性的病原学依据,但抗机会菌治疗显效支持这一观点。而明确的真菌感染经过一周抗真菌治疗又可能难以达到上述效果,因此对于其发病机制与治疗是值得我们进一步思考与探讨的问题。
总之,RTX-IP发病机制尚不明确,也无统一的诊疗标准,但应引起临床工作者的重视。综合相关文献,认为近期有美罗华使用史,无明显诱因出现发热、乏力、干咳等不典型症状的患者,要考虑到RTX-IP的可能,有轻微症状者亦应引起注意,建议:(1)短期内停止使用美罗华;(2)及时行HRCT,以早发现肺部影像学改变,如出现明显的磨玻璃样改变,在进一步寻找证据的同时应高度怀疑RTX-IP,并尽早治疗,不必等到症状加重或血液病原学检查发现阳性指标;(3)类固醇激素是治疗的常规选择,而根据病情对考虑为卡氏肺孢子虫及真菌等机会菌感染所致的IP可使用抗真菌药物及磺胺甲基异噁唑,根据临床症状及肺部HRCT改善情况作疗效评估。一般治疗持续2周,效果不显著的重症患者考虑使用TNF-α抑制剂;(4)对于高龄、治疗前一般情况差、处于化疗后骨髓抑制期(特别是淋巴细胞绝对值 < 1×109/L)的患者要特别注意保护及病情监视,并告知其IP发生的可能;(5)对于NHL患者14 d为周期的R-CHOP方案较21 d方案增加了用药频率,RTX-IP的发生率增加[12],且RTX-IP多发生于淋巴瘤患者,而自身免疫性疾病患者相对少见[12],这提示其发生可能与药物的使用频率和累及使用量有关。因此对于CD20+NHL患者,从降低药物毒副作用角度,建议21 d R-CHOP方案化疗。
本文主要通过文献回顾对利妥昔单抗相关的间质性肺炎进行学习总结,并报道了临床实践中遇到的类似病例。由于病例数少,且未获得阳性病原学证据,仅根据文献进行了诊疗分析,故虽治疗显效,但需后续收集更多病例并完善检查提供更有参考价值的资料。
| [1] | Wagner SA, Mehta AC, Laber DA. Rituximab-induced interstitial lung disease[J]. Am J Hematol,2007, 82 (10) : 916-9. DOI: 10.1002/(ISSN)1096-8652. |
| [2] | Herishanu Y, Polliack A, Leider-Trejo L, et al. Fatal interstitial pneumonitis related to rituximab-containing regimen[J]. Clin Lymphoma Myeloma,2006, 6 (5) : 407-9. DOI: 10.3816/CLM.2006.n.019. |
| [3] | Cha SI, Choi KJ, Shin KM, et al. Risk factors for rituximab-induced interstitial lung diseases in patients with malignant lymphoma[J]. Respiration,2013, 85 (2) : 175. DOI: 10.1159/000345211. |
| [4] | Cheson BD, Leonard JP. Monoclonal antibody therapy for B-cell non-Hodgkin's lymphoma[J]. N Engl J Med,2008, 359 (6) : 613-26. DOI: 10.1056/NEJMra0708875. |
| [5] | Buske C, Hoster E, Dreyling M, et al. The addition of rituximab to front-line therapy with CHOP (R-CHOP) results in a higher response rate and longer time to treatment failure in patients with lymphoplasmacytic lymphoma: results of a randomized trial of the German Low-Grade Lymphoma Study Group (GLSG)[J]. Leukemia,2009, 23 (1) : 153-61. DOI: 10.1038/leu.2008.261. |
| [6] | Arnold DM, Dentali F, Crowther MA, et al. Systematic review: efficacy and safety of rituximab for adults with idiopathic thrombocytopenic purpura[J]. Ann Intern Med,2007, 146 (1) : 25-33. DOI: 10.7326/0003-4819-146-1-200701020-00006. |
| [7] | Sibilia J, Gottenberg J E, Mariette X. Rituximab: a new therapeutic alternative in rheumatoid arthritis[J]. Joint Bone Spine,2008, 75 (5) : 526-32. |
| [8] | Zhou X, Hu W, Qin X. The role of complement in the mechanism of action of rituximab for B-cell lymphoma: implications for therapy[J]. Oncologist,2008, 13 (9) : 954-66. DOI: 10.1634/theoncologist.2008-0089. |
| [9] | Burton C, Kaczmarski R, Jan-Mohamed R. Interstitial pneumonitis related to rituximab therapy[J]. N Engl J Med,2003, 348 (26) : 2690-1. DOI: 10.1056/NEJM200306263482619. |
| [10] | Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma[J]. N Engl J Med,2002, 346 (4) : 235-42. DOI: 10.1056/NEJMoa011795. |
| [11] | Liu X, Hong X N, Gu Y J, et al. Interstitial pneumonitis during rituximab-containing chemotherapy for non-Hodgkin lymphoma[J]. Leuk Lymphoma,2008, 49 (9) : 1778-83. DOI: 10.1080/10428190802270886. |
| [12] | Patel V, Patel P, Dawson J. Comment on: non-infectious pulmonary toxicity of rituximab: a systematic review[J]. Rheumatology (Oxford),2012, 51 (11) : 2111-3. DOI: 10.1093/rheumatology/kes221. |
| [13] | Liote H, Liote F, Seroussi B, et al. Rituximab-induced lung disease: A systematic literature review[J]. Eur Respir J,2010, 35 (3) : 681-7. DOI: 10.1183/09031936.00080209. |
| [14] | Huang YC, Liu CJ, Liu CY, et al. Low absolute lymphocyte count and addition of rituximab confer high risk for interstitial pneumonia in patients with diffuse large B-cell lymphoma[J]. Ann Hematol,2011, 90 (10) : 1145-51. DOI: 10.1007/s00277-011-1268-2. |
| [15] | Katsuya H, Suzumiya J, Sasaki H, et al. Addition of rituximab to cyclophosphamide, doxorubicin, vincristine, and prednisolone therapy has a high risk of developing interstitial pneumonia in patients with non-Hodgkin lymphoma[J]. Leuk Lymphoma,2009, 50 (11) : 1818-23. DOI: 10.3109/10428190903258780. |
| [16] | Ennishi D, Terui Y, Yokoyama M, et al. Increased incidence of interstitial pneumonia by CHOP combined with rituximab[J]. Int J Hematol,2008, 87 (4) : 393-7. DOI: 10.1007/s12185-008-0066-7. |
| [17] | Kanelli S, Ansell SM, Habermann TM, et al. Rituximab toxicity in patients with peripheral blood malignant B-cell lymphocytosis[J]. Leuk Lymphoma,2001, 42 (6) : 1329-37. DOI: 10.1080/10428190127502. |
| [18] | Nieuwenhuizen L, Verzijlbergen FJ, Wiltink E, et al. A possible role of 18F-FDG positron-emission tomography scanning in the early detection of rituximab-induced pneumonitis in patients with non-Hodgkin's lymphoma[J]. Haematologica,2008, 93 (8) : 1267-9. DOI: 10.3324/haematol.12802. |
| [19] | Chaumais M C, Garnier A, Chalard F, et al. Fatal pulmonary fibrosis after rituximab administration[J]. Pediatr Nephrol,2009, 24 (9) : 1753-5. DOI: 10.1007/s00467-009-1195-9. |
| [20] | Kishi J, Nanki T, Watanabe K, et al. A case of rituximab-induced interstitial pneumonitis observed in systemic lupus erythematosus[J]. Rheumatology (Oxford),2009, 48 (4) : 447-8. DOI: 10.1093/rheumatology/kep015. |
| [21] | Fernandez CM, Esposito G, Gonzalez A, et al. Rituximab-induced interstitial lung disease[J]. Medicina (B Aires),2013, 73 (4) : 343-5. |
| [22] | Kang HJ, Park JS, Kim DW, et al. Adverse pulmonary reactions associated with the use of monoclonal antibodies in cancer patients[J]. Respir Med,2012, 106 (3) : 443-50. DOI: 10.1016/j.rmed.2011.11.009. |
| [23] | Wu Y, Jia Y, Xu J, et al. Fatal interstitial lung disease induced by rituximab-containing chemotherapy, treatment with TNF-alpha antagonist and cytokine profiling: a case-report and review of the literature[J]. J Clin Pharm Ther,2013, 38 (3) : 249-53. DOI: 10.1111/jcpt.2013.38.issue-3. |
| [24] | Smith MR. Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance[J]. Oncogene,2003, 22 (47) : 7359-68. DOI: 10.1038/sj.onc.1206939. |
| [25] | Dimopoulou I, Bamias A, Lyberopoulos P, et al. Pulmonary toxicity from novel antineoplastic agents[J]. Ann Oncol,2006, 17 (3) : 372-9. DOI: 10.1093/annonc/mdj057. |
| [26] | Subramanian M, Manjunath R, Kilara N, et al. Rituximab-induced subacute interstitial pneumonitis: a case report and review of literature[J]. J Cancer Res Ther,2010, 6 (3) : 344-6. DOI: 10.4103/0973-1482.73356. |
 2015, Vol. 35
2015, Vol. 35
